
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Газовые смеси. Закон Дальтона
В термодинамических расчетах реальные газы, входящие в состав газовой смеси с относительно невысоким давлением, рассматриваются как идеальные газы, при этом и сама газовая смесь тоже рассматривается как идеальная. Такое допущение дает возможность при расчетах газовых смесей пользоваться законами идеальных газов, в частности законом Дальтона, который лежит в основе изучения газовых смесей. Давление газовой смеси (p) равно сумме парциальных давлений ее компонентов:
Для газовой смеси, подчиняющейся закону Дальтона, справедливы следующие положения: 1) каждый газ, входящий в газовую смесь, имеет температуру, равную температуру смеси; 2) каждый из компонентов газовой смеси распространяется по всему объему, занимаемому смесью, а поэтому объем каждого из них равен объему всей смеси; 3) каждый из газов, входящих в смесь, подчиняется своему уравнению состояния; 4) смесь в целом условно является как бы новым газом, отличающимся от ее компонентов и подчиняющимися своему уравнению состояния. Например, уравнение Менделеева имеет вид: для какого-нибудь одного компонента газовой смеси
и для всей смеси
Разделив первое уравнение на второе, получим:
откуда следует
Следовательно, парциальное давление компонента газовой смеси равно произведению его молярной доли на давление смеси. Объемные доли газовой смеси Объемной долей компонента газовой смеси называется отношение приведенного объема компонента к объему всей смеси. Понятие приведенного объема компонента рассмотрим на примере. Пусть в баллоне, разделенном перегородкой на две не сообщающиеся между собой части, содержится два газа 1 и 2. Давление и температуры этих газов одинаковы. Если перегородку убрать, то оба газа через некоторое время перемешаются (путем диффузии) и образуют газовую смесь. При отсутствии теплообмена с внешней средой температура образовавшейся газовой смеси ( Очевидно, что в нашем примере приведенными объемами газов 1 и 2 являются их объемы до смешения
Как будет показано далее, объемные доли компонентов смеси идеальных газов равны их молярным долям, вследствие чего и молярные и объемные доли можно обозначить одной и той же буквой Х:
Запишем уравнения Менделеева для одного компонента смеси идеальных газов при давлении
Разделив первое уравнение на второе, получим:
т.е. объемные доли компонентов смеси идеальных газов равны их молярным долям. Примеры решения задач Пример 4.1 Найти газовую постоянную смеси, состоящей из азота с приведенным объемом 0,4 м3 и кислорода с приведенным объемом 0,2 м3. Решение Общий объем смеси:
Объемные (или молярные) доли компонентов:
Молярная масса смеси:
Газовая постоянная смеси:
Пример 4.2 Найти парциальное давление азота и кислорода газовой смеси, состоящей из азота с приведенным объемом 0,4 м3 и кислорода с приведенным объемом 0,2 м3. Давление смеси равно 0,1 МПа. Решение Парциальное давление компонентов равно:
Пример 4.3. Продукты сгорания топлива массой 1 кг имеют следующий молярный состав: пары воды Решение Число молей продуктов сгорания:
Молярные доли компонентов:
Молярная масса смеси:
М = 0,0554 · 18,02·10-3 + 0,0667 · 44,01·10-3 + 0,1113 · 32·10-3 + 0,7676 · 28,04·10-3 = = 28,04·10-3 кг/моль Масса смеси:
4.6. Задачи для самостоятельного решения 4.1. Горючая смесь газового двигателя состоит по объему из 8 частей воздуха 1 части светильного газа. Найти удельную газовую постоянную и плотность смеси при давлении 0,1 МПа и температуре 15 оС, если светильный газ состоит из следующих объемных частей: 48,5 %
Ответ: 4.2. Объемные доли сухих продуктов сгорания (т.е. не содержащих водяного пара) следующие: Ответ: 4.3. Газовая смесь задана следующими молярными долями: Ответ: 4.4. Продукты сгорания нефти имеют следующий молярный состав: Ответ: Теплоемкость 5.1. Общие понятия и определения Для того чтобы нагреть два различных вещества с одинаковой массой до одной и той же температуры, необходимо подвести разное количество теплоты. Таким образом, каждое тело по-своему воспринимает теплоту. Способность тела воспринимать теплоту характеризуется теплоемкостью. Теплоемкостью называется количество теплоты, которое необходимо подвести к телу для повышения его температуры на 1 о С. Теплоемкость не является постоянной величиной, а зависит от температуры и давления. В некоторых случаях эта зависимость может быть значительной, поэтому вводят понятие средней и истинной теплоемкости. Средняя теплоемкость определяется в интервале температур Т2 – Т1:
Если же представить, что к телу подведено элементарное количество теплоты dQ и его температура увеличилась на малую величину dT, то истинная теплоемкость равна:
Удельной теплоемкостью называется количество теплоты, которое необходимо для нагревания единичного количества вещества. Количество вещества может быть измерено в килограммах, кубических метрах и молях. В зависимости от того, к какой количественной единице относится теплоемкость, различают массовую, объемную и мольную теплоемкость. Массовая теплоемкость (с) – это количество теплоты, которую необходимо подвести к единице массы тела (обычно 1 кг), чтобы нагреть его на 1 оС, измеряется в джоулях на килограмм на кельвин (Дж/кг К). Объемная теплоемкость (с′) – это количество теплоты, которую необходимо подвести к 1 м3 вещества, чтобы нагреть его на 1 оС, измеряется в джоулях на кубический метр на кельвин (Дж/м3·К). Мольная теплоемкость (сμ) – это количество теплоты, которую необходимо подвести к 1 молю вещества, чтобы нагреть его на 1 оС, измеряется в джоулях на моль на кельвин (Дж/моль·К). Связь между теплоемкостями следующая:
|
||||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 547; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.147.252 (0.015 с.) |
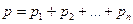 . (4.8)
. (4.8)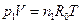 ,
,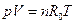 .
.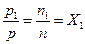 ,
,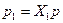 . (4.9)
. (4.9)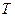 ) будет равна температуре газов до перемешивания. После смешения каждый газ распространится во всем объеме смеси
) будет равна температуре газов до перемешивания. После смешения каждый газ распространится во всем объеме смеси 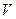 , и давления газов 1 и 2 уменьшится до значений парциальных давлений
, и давления газов 1 и 2 уменьшится до значений парциальных давлений 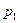 и
и 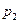 .
.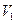 и
и 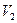 . Если газовая смесь состоит из
. Если газовая смесь состоит из 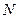 газов и если приведенные объемы компонентов этой смеси обозначить через
газов и если приведенные объемы компонентов этой смеси обозначить через 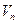 , а объем смеси через
, а объем смеси через 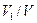 ;
; 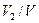 ;
; 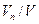 .
.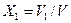 ;
; 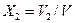 ; …
; … 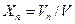 (4.10)
(4.10)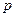 смеси и для всей смеси в целом:
смеси и для всей смеси в целом: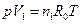 ;
;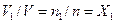 , (4.11)
, (4.11)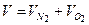 = 0,4 + 0,2 = 0,6 м3.
= 0,4 + 0,2 = 0,6 м3.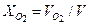 = 0,2/0,6 = 0,333;
= 0,2/0,6 = 0,333;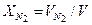 = 0,4/0,6 = 0,667.
= 0,4/0,6 = 0,667.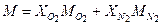 = 0,333 · 32·10-3 + 0,667 · 28,01·10-3 = 29,34·10-3 кг/моль
= 0,333 · 32·10-3 + 0,667 · 28,01·10-3 = 29,34·10-3 кг/моль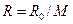 = 8,314 / 29,34·10-3 = 283 Дж/(кг·К)
= 8,314 / 29,34·10-3 = 283 Дж/(кг·К)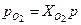 = 0,333·0,1 = 33,3 кПа,
= 0,333·0,1 = 33,3 кПа,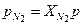 = 0,667·0,1 = 66,7 кПа.
= 0,667·0,1 = 66,7 кПа.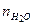 = 60,3; углекислый газ
= 60,3; углекислый газ 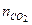 = 73,9; азот
= 73,9; азот 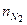 = 849,5; кислород
= 849,5; кислород 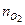 = 132,2. Найти массу и молярную массу смеси.
= 132,2. Найти массу и молярную массу смеси.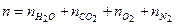 = 60,3 + 73,9 + 123,3 + 849,5 = 1106,9 моль.
= 60,3 + 73,9 + 123,3 + 849,5 = 1106,9 моль.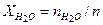 = 60,3 / 1106,9 = 0,0544;
= 60,3 / 1106,9 = 0,0544;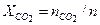 = 73,9 / 1106,9 = 0,0667;
= 73,9 / 1106,9 = 0,0667;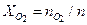 = 123,2 / 1106,9 = 0,1113;
= 123,2 / 1106,9 = 0,1113;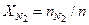 = 849,5 / 1106,9 = 0,7676.
= 849,5 / 1106,9 = 0,7676.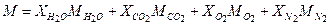 ;
;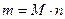 = 28,04·10-3 · 1106,9 = 31,04 кг
= 28,04·10-3 · 1106,9 = 31,04 кг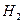 , 39,5 %
, 39,5 % 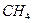 , 7 %
, 7 % 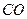 и 5 %
и 5 % 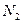 .
.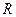 = 308,7 Дж/(кг·К),
= 308,7 Дж/(кг·К), 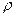 = 1,12 кг/м3.
= 1,12 кг/м3.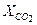 = 0,123;
= 0,123; 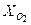 = 0,072;
= 0,072; 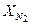 = 0,805. Найти удельную газовую постоянную, плотность и удельный объем продуктов сгорания, если их давление 0,1 МПа и температура 800 оС.
= 0,805. Найти удельную газовую постоянную, плотность и удельный объем продуктов сгорания, если их давление 0,1 МПа и температура 800 оС.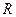 = 274,7 Дж/(кг·К),
= 274,7 Дж/(кг·К), 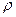 = 0,34 кг/м3,
= 0,34 кг/м3, 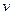 = 2,95 м3/кг.
= 2,95 м3/кг.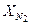 = 0,03;
= 0,03; 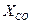 = 0,1;
= 0,1; 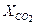 = 0,03;
= 0,03; 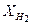 = 0,45;
= 0,45; 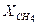 = 0,35 и
= 0,35 и 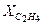 = 0,04. Давление смеси
= 0,04. Давление смеси 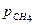 = 31,5 кПа.
= 31,5 кПа.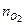 = 70 моль,
= 70 моль, 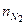 = 60 моль,
= 60 моль, 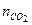 = 70 моль и
= 70 моль и 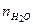 = 66 моль. Найти удельную газовую постоянную смеси и ее удельный объем при нормальных условиях.
= 66 моль. Найти удельную газовую постоянную смеси и ее удельный объем при нормальных условиях.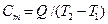 .
.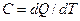 .
.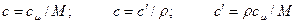 . (5.1)
. (5.1)


