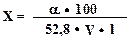Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кафедра фармацевтической химии и фармакогнозииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Кафедра фармацевтической химии и фармакогнозии
Фармакопейный анализ лекарственных веществ Часть I
Методическое руководство к проведению лабораторно-практических работ по фармацевтической химии для студентов IV курса заочного отделения фармацевтического факультета
Нижний Новгород
Фармакопейный анализ лекарственных веществ Методическое руководство к проведению лабораторно-практических работ по фармацевтической химии разработано в соответствии с Федеральным государственным образовательным стандартом высшего профессионального образования по специальности «Фармация», утвержденном приказом №38 от 17 января 2011 г Министерством образования и науки Российской Федерации.
Руководство включает планы проведения и методики анализа фармацевтических субстанций и лекарственных форм на их основе, вопросы и задания для самостоятельной работы студента.
Составители: ЗАНЯТИЕ 1 Анализ лекарственных веществ: производных альдегидов, лактонов ненасыщенных полиоксикарбоновых кислот и Углеводов. Цель работы. Освоить способы оценки качества лекарственных веществ: производных альдегидов, лактонов ненасыщенных полиоксикарбоновых кислот и углеводов. Самостоятельная подготовка. Написать формулы, латинские и химические названия лекарственных веществ. Изучить физические и химические свойства, методы идентификации и количественного анализа указанных веществ, их фармакологическое действие, формы выпуска, применение. Условия хранения. Объекты исследования. Раствор формальдегида (формалин), Кислота аскорбиновая, Глюкоза.
План занятия 1. Установка преподавателя о порядке проведения занятия. 2. Собеседование по теме занятия. 3. Самостоятельная работа студентов. Описание, растворимость, подлинность, испытание на чистоту, количественное определение. 4. Оформление протоколов и отчёт преподавателю о выполненной работе.
Самостоятельная работа студентов.
Раствор формальдегида Solutio formaldehydi Formalinum. Формалин CH 2O М. в. 30,03 Свойства. Прозрачная, бесцветная жидкость своеобразного острого запаха. Смешивается с водой и спиртом во всех соотношениях. Раствор формальдегида содержит метиловый спирт, прибавляемый для стабилизации. Испытание на подлинность. К 2 мл раствора нитрата серебра прибавляют 10 - 12 капель раствора аммиака и 2 - 3 капли препарата, нагревают на водяной бане до 50—600С; при этом выделяется металлическое серебро в виде зеркала или серого осадка. К раствору 0,02—0,03 г салициловой кислоты в 5 мл концентрированной серной кислоты прибавляют 2 капли препарата и нагревают; при этом появляется красное окрашивание. Удельный вес 1,081—1,096. Испытание на чистоту. 10 мл препарата титруют 0,1 н. раствором едкого натра до розового окрашивания (индикатор — фенолфталеин). 1 мл 0,1 н. раствора едкого натра соответствует 0,0046 г муравьиной кислоты, содержание которой в препарате не должно превышать 0,2%. 20 мл препарата выпаривают на водяной бане досуха. Полученную белую массу сжигают и прокаливают. Остаток после прокаливания не должен быть более 0,005%. Количественное определение. Около 1 г препарата (точная навеска) разбавляют водой в мерной колбе емкостью 100 мл до метки. К 5 мл этого раствора в колбе с притертой пробкой прибавляют 20 мл 0,1 н. раствора йода и 10 мл 1 н. раствора едкого натра, взбалтывают и оставляют в темном месте на 10 минут. Затем прибавляют 11 мл 1 н. раствора серной кислоты и выделившийся йод титруют 0,1 н. раствором тиосульфата натрия до обесцвечивания (индикатор - крахмал). 1 мл 0,1 н. раствора йода соответствует 0,001501 г формальдегида, которого в препарате должно быть не менее 36,0% и не более 40,0%
Примечание. Для приготовления водных растворов формалина можно применять формалин с содержанием формальдегида менее 36,0%, но с учетом фактического содержания формальдегида. Хранение. В хорошо закупоренных склянках, в защищенном от света месте, при температуре не ниже 90С. Примечание. Если в рецепте прописан раствор формалина иной концентрации, то при расчетах исходный препарат формалин - принимается за единицу (10,0%). Если же прописан раствор формальдегида (а не раствор формалина) той или иной концентрации, то при расчетах исходят из фактического содержания формальдегида в исходном препарате - формалине.
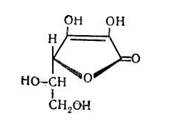
Кислота аскорбиновая Acidum ascorbiniciim, Vitaminum С, Витамин С, Acidum Ascorbicum * γ-лактон-2,3-дегидро-L-гулоновой кислоты
С6Н8О6 М. в. 176,13 Описание. Белый кристаллический порошок без запаха, кислого вкуса Растворимость. Легко растворим в воде, растворим в спирте, практически нерастворим в эфире, бензоле и хлороформе. Подлинность. 0,05 г препарата растворяют в 2 мл воды и приливают 0,5 мл раствора нитрата серебра; выпадает темный осадок. При добавлении к раствору препарата (1: 1000) по каплям раствора 2,6-дихлорфенолиндофенола синяя окраска последнего исчезает. Температура плавления 190—1930 (с разложением). Скорость подъема температуры 50 в минуту. Препарат предварительно сушат при 600 в течение 2 часов. Удельное вращение от +22° до +240 (2% водный раствор). Органические примеси. К 0,1 г препарата прибавляют 2 мл концентрированной серной кислоты и оставляют на 30 минут. Окраска раствора не должна превышать окраску эталона № 5б, разведенного в 2 раза. Сульфатная зола и тяжелые металлы. Сульфатная зола из 0,5 г препарата не должна превышать 0,1% и должна выдерживать испытание на тяжелые металлы (не более 0,001% в препарате). Количественное определение. Около 0,5 г препарата (точная навеска) растворяют в воде в мерной колбе емкостью 50 мл, доводят объем раствора водой до метки и перемешивают. К 10 мл приготовленного раствора прибавляют 0,5 мл 1% раствора йодида калия, 2 мл раствора крахмала и 1 мл 2% раствора соляной кислоты и титруют 0,1 М раствором йодата калия до появления стойкого слабо синего окрашивания. 1 мл 0,1 М раствора йодата калия соответствует 0,008806 г С6Н8О6, которой в препарате должно быть не менее 99,0%. Хранение. В хорошо укупоренной таре, предохраняющей от действий света и воздуха.
Глюкоза, раствор для инфузий 5% и 10 % Декстроза Состав. Глюкозы безводной, - 50 г или 100 г (ФС 42-0004-00, или другой зарегистрированной в РФ) Натрия хлорида (ФС 42-2572-95) - 0,26 г Раствора кислоты хлористоводородной 0,1 М - до рН 3,0 - 4,1 (ГФ XI, вып. 2, с. 77) Воды для инъекций (ФС 42-2620-97) - до 1 л Описание. Бесцветная прозрачная жидкость. Подлинность. К 1 мл препарата прибавляют 5 мл реактива Фелинга и нагревают до кипения; образуется кирпично-красный осадок (глюкоза). Реакция на натрий хлорид. Хлориды. 0,5 мл препарата дают характерную реакцию на хлориды (ГФ XI, вып с. 159). Натрий. 5 мл препарата дают характерную реакцию на натрий (ГФ XI, вып. с. 159). Прозрачность. Препарат должен быть прозрачным (ГФ XI, вып. 1, с. 198). Цветность. Препарат должен быть бесцветным (ГФ XI, вып. 1, с. 194). рН. От 3, 0 до 4,1 (потенциометрически, ГФ XI, вып. 1, с. 113). Испытание на чистоту. 5-гидроксиметилфурфурол и родственные соединения. В мерную колбу вместимостью 250 мл помещают точно измеренный объем раствора глюкозы, эквивалентный 1,0 г глюкозы, доводят водой до метки. Определяют оптическую плотность полученного раствора при длине волны 284 нм в кювете с толщиной слоя 10 мм, используя в качестве раствора сравнения воду. Оптическая плотность раствора не должна превышать 0,25. Тяжелые металлы. 20 мл 5 % раствора глюкозы, упаренные на водяной бане до 10 мл должны выдерживать испытание на тяжелые металлы (не более 0,0005 %; ГФ XI, вып. 1, с. 171). Номинальный объем. Не менее номинального (ГФ XI, вып.2, с.141). Контролируют выборочно 5 бутылок из каждой серии путем измерения объема раствора бутылки мерным цилиндром. Механические включения. Препарат должен выдерживать требования Инструкции по контролю на механические включения инъекционных лекарственных средств (РД 42-501-98). Количественное определение. Поляриметрическое определение. Объем исследуемого раствора, эквивалентный 2,5 г глюкозы (50 мл 5 %, 25 мл – 10 %, 10 мл – 25 %, 6,25 мл – 40 % растворов) помещают в мерную колбу вместимостью 100 мл, прибавляют 0,2 мл раствора гидроксида аммония, доводят водой до метки, перемешивают и оставляют на 40 мин. Измеряют угол вращения полученного раствора на поляриметре. Содержание глюкозы в 1 мл в граммах (X) рассчитывают по формуле:
где: α - угол вращения испытуемого раствора, в градусах; V- объем исследуемого раствора, взятый для определения, в мл; l - толщина слоя, в дм; 52,8 – удельное вращение глюкозы в градусах.
Рефрактометрическое определение. На призму рефрактометра наносят несколько капель воды и по шкале находят показатель преломления (n0). Осторожно вытирают призму досуха, наносят на нее несколько капель испытуемого раствора и находят показатель преломления (n). Содержание глюкозы в 1 мл в граммах (X) рассчитывают по формуле:
где 0,.00142 - фактор показателя преломления безводной глюкозы.
Йодометрическое определение Разводят 1 мл 5% раствора глюкозы водой до 10 мл (1 мл 10% раствора – до 20 мл, 1 мл 25% раствора - до 50 мл, 1 мл 40% раствора - до 100 мл). К 10 мл полученного раствора прибавляют 10 мл 0,1 М раствора йода, 2 мл 10% раствора гидроксида натрия, закрывают склянку пробкой и реакционную смесь оставляют стоять в темном месте 5 минут. Далее прибавляют 5 мл кислоты хлористоводородной разведенной и титруют 0,1 М раствором тиосульфата натрия до обесцвечивания раствора (индикатор - крахмал). Параллельно проводят контрольный опыт. 1 мл 0,1 М раствора иода соответствует 0,0099 г (водной) или 0,0090 (безводной) глюкозы. Упаковка. По 200, 400 мл в бутылки стеклянные для крови, инфузионных и трансфузионных препаратов вместимостью 250 и 450 мл соответственно по ГОСТ 10782-85, укупоренные пробками из резиновой смеси марок ИК-21 и 52-369/1 по ТУ 38.006269-95 и обжатые колпачками алюминиевыми по ГОСТ Р51314-99. На бутылку наклеивают этикетку из бумаги этикеточной по ГОСТ 7625-86 или писчей по ГОСТ 18510-87. Каждую бутылку с инструкцией по применению помещают в пачку из картона по ГОСТ 7933-89. По 28 бутылок по 200 мл или по 15 бутылок по 400 мл с инструкциями по применению упаковывают в ящики из картона гофрированного» по ГОСТ 7933-89 (для стационаров). Групповая упаковка и транспортная тара в соответствии с ГОСТ 17768-90. Маркировка. На этикетке указывают предприятие-изготовитель и его товарный знак, адрес предприятия, телефон/факс, название препарата на русском языке, международное непатентованное название, концентрацию в процентах, состав, объем в миллилитрах, «При помутнении содержимого бутылку не использовать», «Стерильно», «Внутривенно», условия хранения, условия отпуска, peгистрационный номер, номер серии, срок годности, штриховой код. На групповой упаковке дополнительно указывают количество упаковок, на упаковке без пачек дополнительно указывают количество бутылок в упаковке, «Для стационаров». Маркировка транспортной тары в соответствии с ГОСТ 14192-96. Контрольные вопросы и ситуационные задачи 1. Какими химическими реакциями доказывают принадлежность анализируемых веществ к альдегидам? Напишите уравнение химических реакций. 2. С какой целью к раствору формальдегида добавляют метанол? 3. Какие методы количественного определения веществ производных альдегидов Вы знаете? Напишите уравнения химических реакций. 4. Каковы условия хранения лекарственных веществ производных альдегидов? 5. При хранении раствора формальдегида образовался белый осадок. Какой химический процесс при этом произошел? Каков химический состав осадка? 6. Напишите графическую формулу, латинское и химическое названия кислоты аскорбиновой, глюкозы. 7. Как получают вышеперечисленные вещества? 8. Какими химическими реакциями можно подтвердить подлинность кислоты аскорбиновой? Напишите уравнения реакций. 9. Какие химические реакции используются для количественного анализа кислоты аскорбиновой, глюкозы? 10.Как применяют кислоту аскорбиновую, глюкозу в медицинской практике? 11.Какие условия необходимы для хранения этих веществ? 12.Почему при испытании на подлинность кислоты аскорбиновой с 2,6-дихлорфенолиндофенолом раствор последнего добавляют по каплям? 13.Приведите уравнения реакций, подтверждающих наличие полуацетального гидроксила в молекулах глюкозы и лактозы. 14.Приведите пример реакции конденсации для углеводов. 15.Приведите уравнения реакций, подтверждающих наличие как гидроксильной, так и альдегидной групп в молекуле глюкозы. 16.Какие изомеры известны Вам для молекулы глюкозы? 17.Обоснуйте возможность применения рефрактометрии для анализа глюкозы. Приведите формулу расчета содержания глюкозы. 18.Объясните, на чем основано поляриметрическое определение глюкозы в растворе? Приведите формулу расчета. 19.Можно ли кислоту аскорбиновую отличить от глюкозы реакциями окисления? 20.Дайте заключение о качестве раствора формальдегида по количественному определению с учетом требований ГФ Х (должно быть формальдегида в лекарственном средстве 36,5%-37,5%), если на определение 5 мл раствора приготовленного в результате разведения навески 1,0025 г в мерной колбе вместимостью 100 мл до метки взято 20 мл 0,1 моль/л раствора йода с К = 0,9974 и на титрование израсходовалось 7,63 мл 0,1 моль/л раствора натрия тиосульфата с К = 1,0021. 21.Какую массу кислоты аскорбиновой следует взять, чтобы на титрование (М. м. = 176,13) пошло 5 мл 0,1 М раствора йода? 22.Если взять две одинаковые массы кислоты аскорбиновой и одну из них титровать 0,1 М раствором гидроксида натрия, а другую 0,1 М раствором йодата калия, одинаковый ли объем этих растворов пойдет на титрование? Oтвет пояснить. 23.Рассчитайте, какую навеску порошка растертых таблеток кислоты аскорбиновой следует взять для количественного определения, чтобы на титрование израсходовалось 10,00 мл раствора калия йодата (0,1 моль/л) с К 1,0028? Таблетки по 0,05 г, средняя масса таблеток 0,200 г. М.м. кислоты аскорбиновой 176,13 г/моль. 24.На титрование 5 мл 5% раствора кислоты аскорбиновой для инъекций израсходовалось 25,00 мл раствора калия йодата (0,1 моль/л) с К 1,0015. Сделайте заключение о качестве. Согласно ФС, в 1 мл препарата должно быть от 0,0475 до 0,0525г кислоты аскорбиновой. 25.Рассчитайте удельное вращение глюкозы в пересчете на сухое вещество, если угол вращения водного раствора, содержащего 2,5 г лекарственного вещества в 25 мл растворителя, при длине кюветы 10 см равен + 4,74°. 26.При определении глюкозы рефрактометрическим методом в порошке состава: Эритромицина 25000 ЕД Глюкозы 0,2 показатель преломления раствора, приготовленного растворением в 1,5 мл воды и доведением водой до 2,0 мл навески порошка массой 0,1 г равен 1,3397, воды 1,333.Рассчитайте содержание глюкозы в лекарственной форме. Фактор показателя преломления глюкозы 0,00142. 1ЕД эритромицина соответствует 0,001 мг. (Преломлением света эритромицином можно пренебречь). Список литературы для подготовки. 1. Государственная Фармакопея. Издание XI, вып. 1,2. – Москва: Медицина, 1987. 2. Беликов, В.Г. Фармацевтическая химия: Учеб. Для вузов. – Пятигорск, 2007. 3. Фармацевтическая химия: Учеб. Пособие / Под ред. А.П. Арзамасцева. – 2-е изд., испр. – М.: ГОЭТАР-Медиа, 2005. 4. Химический анализ лекарственных веществ по функциональным группам. Учебно-методическое пособие для студентов фармацевтического факультета. – Нижний Новгород: Изд-во Нижегородской государственной медицинской академии, 2003. 5. Органические лекарственные препараты. Алифатические соединения. Краткий конспект лекций. – Нижний Новгород: Изд-во Нижегородской медицинской академии, 2003. ЗАНЯТИЕ 2 План занятия 1. Установка преподавателя о порядке проведения занятия. 2. Собеседование по теме занятия. 3. Самостоятельная работа студентов. 4. Оформление протоколов и отчёт преподавателю о выполненной работе. Самостоятельная работа студентов. Калия ацетат Kalii acetas, Kalium aceticum CH3COOK M.в. 98,15 Описание. Белый кристаллический порошок без запаха или со слабым запахом уксусной кислоты, солоноватого вкуса. Гигроскопичен, расплывается на воздухе. Растворимость. Очень легко растворим в воде, легко растворим в спирте 95%. Подлинность. Ион калия. См. ГФ XI Нагревают 2 мл 2% раствора калия ацетата с равным объёмом кислоты серной концентрированной и 0,5 мл спирта 95%. Ощущается запах этилацетата (ацетат -ион). К 2 мл нейтрального 2% раствора калия ацетата прибавляют 0,2 мл раствора хлорида железа (III). Появляется красно-бурое окрашивание, исчезающее при добавлении разведённых минеральных кислот (ацетат-ион). Щелочность. Растворяют 5 г вещества в 50 мл свежепрокипяченной и охлажденной воды (раствор А). К 10 мл этого раствора прибавляют 5 капель раствора фенолфталеина. Если при этом появляется розовое окрашивание, то оно должно исчезнуть от прибавления не более 0,5 мл 0,1 М раствора кислоты хлористоводородной. Хлориды. 2 мл раствора А (см. щелочность), разведенные водой до 10 мл должны выдерживать испытание на хлориды (не более 0,01%). Сульфаты. Разведенные водой до 10 мл 5 мл раствора А (см. щелочность) должны выдерживать испытание на сульфаты (не более 0,02%). Кальций. 10 мл раствора А должны выдерживать испытание на кальций (не более 0,03% в препарате). Железо. 3 мл раствора А (см. щелочность), разведенные водой до 10 мл, должны выдерживать испытание на железо (не более 0,01%). Тяжелые металлы. Разведенные водой до 10 мл 5 мл раствора А (см. щелочность) должны выдерживать испытание на тяжелые металлы (не более 0,001%). Восстанавливающие вещества. Нагревают 1 мл раствора А (см. щелочность) с 1 мл кислоты серной разведенной и 0,15 мл раствора перманганата калия. Розовая окраска раствора должна сохраниться в течение 1мин. Количественное определение. (Фармакопейный метод) Около 0,08 г вещества (точная навеска), предварительно высушенного при 110°С до постоянной массы, растворяют в 10 мл кислоты уксусной ледяной и титруют 0,1 М раствором хлорной кислоты до зеленовато-желтой окраски (индикатор - кристаллический фиолетовый). Параллельно проводят контрольный опыт. 1мл 0,1 М раствора хлорной кислоты соответствует 0,009815 г калия ацетата, которого должно быть не менее 99,0 % в высушенном веществе. (Альтернативный метод) Около 0,5 г вещества (точная навеска) сушат до постоянного веса при 105-110 0С. Высушенную навеску переносят количественно 50 мл воды в колбу вместимостью 100 мл, прибавляют 3 купли раствора тропеолина 00 и титруют 0,5 моль/л раствором хлористоводородной кислоты до перехода желтой окраски в красноватую, одинаковую с окраской контрольной пробы, состоящей из 50 мл воды, 1 капли 0,5 моль/л раствора хлористоводородной кислоты и 3 капель того же индикатора. 1 мл 0,5 моль/л раствора хлористоводородной кислоты соответствует 0,04907 г ацетата калия, которого в высушенном препарате должно быть не менее 99,0%. Хранение. В хорошо закупоренных стеклянных банках, залитых парафином, в сухом месте.
Кальция лактат Calcii lactas, Calcium lacticum
C6H10CaO6·5H2O М.в. 308,30 Описание. Белый аморфный порошок почти без запаха. На воздухе выветривается. Растворимость. Растворим в воде (медленно), легко растворим в горячей воде, очень мало растворим в эфире и хлороформе, практически нерастворим в спирте 95%. Подлинность. Инфракрасный спектр кальция лактата, снятый в вазелиновом масле в области от 4200 до 1200 см -1 и от 1400 до 400 см -1, должен иметь полное совпадение полос поглощения с полосами поглощения прилагаемых стандартных спектров по положению и относительным интенсивностям полос. 1 мл 1,5% раствора кальция лактата даёт характерную реакцию на кальций. (ГФ XI) К 0,25 г кальция лактата прибавляют 5 мл кислоты серной разведённой, раствор калия перманганата до красно-фиолетового окрашивания и нагревают: ощущается запах ацетальдегида. Прозрачность раствора. 1,5 гвещества растворяют в 50 мл свежепрокипячённой воды, нагревают на водяной бане почти до кипения, охлаждают. 10 мл полученного раствора должны выдерживать сравнение с эталонным раствором IV. Цветность раствора. 5 мл раствора, полученного при испытании на «Прозрачность», должны выдерживать сравнение с эталоном №7б. Щелочность или кислотность. К 1 г вещества прибавляют 20 мл свежепрокипячённой воды и нагревают на водяной бане почти до кипения. К охлажденному раствору прибавляют 0,08 мл раствора фенолфталеина. Раствор должен оставаться бесцветным. Розовое окрашивание должно появиться от прибавления не более 0,6 мл 0,02 М раствора гидроксида натрия. Летучие и жирные кислоты. К 0,5 г кальция лактата прибавляют 1 мл кислоты серной концентрированной, нагревают. Не должно ощущаться запаха жирных кислот. Хлориды. Раствор, полученный в испытании «Прозрачность раствора», фильтруют. 25 мл фильтрата разводят водой до 75 мл (раствор А). 10 мл полученного раствора должны выдерживать испытание на хлориды (не более 0,02%). Сульфаты. 10 мл раствора А (см. хлориды) должны выдерживать испытание на сульфаты (не более 0,1%). Магний и щелочные металлы. 1г вещества растворяют в 20 мл горячей воды в мерной колбе вместимостью 100 мл. Прибавляют 20 мл воды, 2 г аммония хлорида, 2 мл раствора аммиака концентрированного, нагревают до кипения и быстро прибавляют 40 мл горячего 4% растворааммония оксалата. Через 4 часа доводят объём раствора водой до 100 мл и фильтруют. К 50 мл фильтрата, помещённого в платиновую чашку, прибавляют 0,5 мл кислоты серной концентрированной, выпариваютдосуха. Остаток прокаливают до постоянной массы при температуре600°С. Остаток не должен превышать 1%. Железо. К 0,4 г вещества прибавляют 0,5 мл кислоты хлористоводородной концентрированной и 10 мл воды, нагревают на водяной бане до растворения. К охлажденному раствору прибавляют 0,7 мл растворааммиака концентрированного. Полученный раствор должен выдерживать испытание на железо (не более 0,0075%). Тяжелые металлы. 1 г вещества помещают в тигель, смачивают 1мл кислоты серной концентрированной и 1 мл пергидроля. Осторожносжигают, прокаливают. Сульфатная зола должна выдерживать испытаниена тяжелые металлы (не более 0,001%) Потеря в массе при высушивании. Около 0,5 г вещества (точная масса) сушат при 120°С до постоянной массы. Потеря в массе должна быть не менее 20 % и не более 30%. Мышьяк. 0,5 г вещества должны выдерживать испытание на мышьяк (не более 0,0001 %). Количественное определение. Около 0,3 г вещества (точная масса) растворяют при подогревании в 50 мл воды. По охлаждении прибавляют 6 мл аммиачного буферного раствора и титруют 0,05 М раствором трилона Б до сине-фиолетового окрашивания (индикатор - 0,1 г индикаторной смеси или 0,4 мл раствора хромового темно-синего). 1 мл 0,05 М раствора трилона Б соответствует 0,01091 г кальция лактата, которого должно быть не менее 98,0% в пересчете на безводное вещество.
Кальция глюконат Calcii gluconas, Calcium gluconicum
C12H22CaO14·H2O М.в. 448,4 Описание. Белый зернистый или кристаллический порошок без запаха и вкуса. Растворимость. Умеренно (медленно) растворим в воде, легко растворим в кипящей воде (с образованием мутных растворов), практически нерастворим в эфире и спирте 95%. Подлинность. Инфракрасный спектр вещества (10 мг кальция глюконата в 2 каплях масла вазелинового) в области от 4200 до 1200 см -1 и от 1200 до 400 см -1 должен иметь полное совпадение полос поглощения с полосами поглощения прилагаемых стандартных спектров по положению и относительным интенсивностям полос. Раствор 1 г кальция глюконата в 50 мл воды с 0,3 мл 3% раствора хлорида железа (III) даёт светло-зелёное окрашивание (глюконат-ион). Раствор 0,2 г кальция глюконата в 10 мл воды дает характерные реакции на кальций. Прозрачность раствора. 0,1 г вещества растворяют в 10 мл воды, нагревают на водяной бане до температуры 30°С в течение 30 минут, охлаждают. Полученный раствор должен выдерживать сравнение с эталонным раствором III. рН. От 6,0 до 7,2 (2% раствор в воде, потенциометрически). Галогены. 0,5 г вещества растворяют при нагревании в 25 мл воды. К 10 мл полученного раствора прибавляют 0,5 мл кислоты азотной, 0,5 мл раствора серебра нитрата, перемешивают и через 5 минут сравнивают с 10 мл эталонного раствора, к которому прибавлены те же количества реактивов. Опалесценция в испытуемом растворе не должна превышать опалесценцию эталонного раствора (не более 0,02%). Примечание. Приготовление эталонного раствора: 1,0293 г предварительно высушенного при 110°С в течение 4 часов натрия бромида растворяют в воде в мерной колбе вместимостью 1 л, доводят объём раствора водой до метки (раствор А). 5 мл раствора А доводят водой до метки в мерной колбе вместимостью 1 л (раствор Б). 1 мл раствора Б содержит 0,004 мг бром-иона. Срок годности эталонного раствора Б - 6 месяцев. Сульфаты. Раствор 0,2 г вещества в 10 мл должен выдерживать испытания на сульфаты (не более 0,01%). Потеря в массе при высушивании. Около 0,5 г вещества (точная масса) сушат при температуре от 100°С до 105°С до постоянной массы. Потеря в массе не должна превышать 1%. Тяжелые металлы. 0,5 г вещества растворяют при нагревании на водяной бане при температуре 30°С в смеси 2 мл кислоты хлористоводородной разведенной и 8 мл воды в течение 7 минут. 10 мл полученного раствора должны выдерживать испытание на тяжёлые металлы (не более 0,001%). Мышьяк. 0,25 г вещества должны выдерживать испытание на мышьяк (не более 0,0002%). Декстрин, сахароза. 0,5 г вещества растворяют при нагревании в смеси из 2 мл кислоты хлористоводородной разведенной и 10 мл воды. Нагревают на водяной бане при температуре 30°С в течение 2 мин. К охлажденному раствору постепенно приливают 8 мл раствора натрия карбоната и фильтруют через 5 мин. 5 мл фильтрата кипятят на водяной бане в течение 1 мин с реактивом Фелинга. Не должно образовываться красного осадка. Количественное определение. Около 0,4 г вещества (точная масса) растворяют в 20 мл воды при нагревании на водяной бане при температуре 30°С в течение 15 минут. После охлаждения прибавляют 10 мл аммиачного буферного раствора, около 0,1 г индикаторной смеси или 0,5 мл раствора кислотного хромового темно-синего и титруют 0,05 М раствором трилона Б до сине-фиолетового окрашивания. 1 мл 0,05 М раствора трилона Б соответствует 0,02242 г кальция глюконата, которого должно быть не менее 98,5% и не более 103,0%.
Глютаминовая кислота Acidum glutaminicum
C5H9NO4 М. м. 147,13 Описание. Белый кристаллический порошок с едва ощутимым запахом, кислого вкуса. Подлинность. 0,02г препарата растворяют при нагревании в 1 мл сежепрокипяченной воды, прибавляют 1 мл свежеприготовленного раствора нингидрина и нагревают; появляется сине-фиолетовое окрашивание. 2 мг препарата смешивают с 2 мг резорцина и 5 каплями концентрированной серной кислоты и нагревают до появления зелено-коричневого окрашивания. Охлаждают, прибавляют 5 л воды и 5 мл раствора аммиака; появляется красно-фиолетовое окрашивание с зеленой флюорисценцией. Удельное вращение от +300 до +340 (5% раствор в разведенной соляной кислоте) Кислотность. 1,5 г препарата растворяют в 30 мл горячей свежепрокипяченной воды и по охлаждении фильтруют; рН полученного фильтрата 3,1-3,7. Посторонние аминокислоты. К 5 мл того же фильтрата прибавляют 5 мл реактива Фелинга и кипятят на сетке 2 минуты; не должно появляться зеленое ил бурое окрашивание. Нерастворимые вещества. 1 г препарата растворяют в смеси 4 мл разведенной азотной кислоты и 11 мл воды; мутность не должна превышать эталон №4. Органические примеси. 0,2 г препарата растворяют в 5 мл концентрированной серной кислоты. Полученный раствор должен быть бесцветным в течение 15 минут. Хлориды. 0,1 г препарата взбалтывают с 25 мл воды в течение 5 минут и фильтруют. 10 мл фильтрата должны выдерживать испытание на хлориды (не более 0,05% в препарате) Потеря в массе при высушивании. Около 0,5 г препарата (точная навеска) сушат при 100-1050 до постоянного веса. Потеря в весе не должна превышать 0,5%. Сульфатная зола и тяжелые металлы. Сульфатная зола из 0,5 г препарата не должна превышать 0,1% и должна выдерживать испытание на тяжелые металлы (не более 0,001% в препарате). Количественное определение. Около 0,3 г препарата (точная навеска) помещают в коническую колбу емкостью 100 мл и при слабом нагревании растворяют в 50 мл свежепрокипяченной воды. К охлажденному раствору прибавляют 5 капель спиртового раствора бромтимолового синего и титруют 0,1 М раствором едкого натра до перехода желтой окраски в голубовато-зеленую. 1 мл 0,1 М. раствора едкого натра соответствует 0,01471 г кислоты глютаминовой, которой в препарате должно быть не менее 98,5% Контрольные вопросы и ситуационные задачи
1. Какими химическими реакциями можно доказать наличие в лекарственном веществе катионов калия, кальция, натрия? 2. Как обнаружить в молекуле лекарственного вещества ацетат-, лактат- глюконат-, цитрат-ионы? Напишите уравнения химических реакций, укажите аналитический эффект. 3. Как выполнить количественное определение калия ацетата методом неводного титрования? Какие химические реакции при этом происходят? 4. Какими методами по ФС проводится количественное определение кальция глюконата и кальция лактата? Напишите уравнения химических реакций. 5. При каких заболеваниях применяют препараты производных карбоновых кислот алифатического ряда? В виде каких лекарственных форм они выпускаются? 6. Будет ли подвергаться изменениям калия ацетат при хранении в неплотно укупоренной таре? Какие факторы внешней среды оказывают при этом влияние на качество препарата? 7. Как получают глютаминовую кислоту? 8. Какими химическими реакциями можно подтвердить подлинность кислоты глютаминовой? Напишите уравнения реакций. 9. Какие химические реакции используются для количественного анализа кислоты глютаминовой? 10.Какие условия необходимы для хранения глютаминовой кислоты? 11.Назовите вещества производные аминокислот алифатического ряда. Приведите их графические формулы, латинские и химические названия. 12.Напишите уравнения химических реакций, подтверждающие подлинность алифатических аминокислот. 13.Какие физические константы используются для идентификации лекарственных веществ производных алифатических аминокислот? 14.Приведите уравнения химических реакций, подтверждающих амфотерные свойства алифатических аминокислот. 15.Напишите уравнение химической реакции взаимодействия алифатических аминокислот с нингидрином. 16.Для количественного определения аминокислот используют метод Сёренсена. В чём суть этого метода? Приведите уравнения химических реакций. 17.На каком свойстве алифатических аминокислот основано использование поляриметрии? Приведите формулу расчёта. 18.Можно ли алифатические аминокислоты определять количественно методом Кьельдаля? Какие при этом происходят химические реакции? Приведите схему прибора. 19.Какие химические свойства алифатических аминокислот положены в основу кислотно-основного титрования в неводных средах? 20.Для анализа каких веществ производных алифатических аминокислот применяется иодиметрия? Приведите уравнения химических реакций. 21.Объясните условия хранения лекарственных веществ производных алифатических аминокислот, исходя из особенностей их химической структуры. 22.Величина угла вращения плоскости поляризованного света 5% раствором кислоты глютаминовой в разведенной кислоте хлористоводородной составила 3,30 (1 = 20 см). Рассчитайте удельное вращение. 23.Какую массу кальция глюконата (М. м. = 448,4) необходимо взять, чтобы на количественное определение было затрачено 25 мл 0,05 М раствора трилона Б? 24.Каково содержание (в %) кальция лактата в образце, если на титрование навески массой 0,2863 г было затрачено 19,6 мл 0,05 М раствора трилона Б (К = 1,01). Потеря в массе при высушивании была равна 25% (М. м. = 218,2, безводный). 25.Дайте заключение о качестве калия ацетата (М.м. = 98,15) по количественному определению с учетом требований ГФ, если при навеске 0,0824 г предварительно высушенного лекарственного средства на титрование израсходовалось 8,38 мл 0,1 моль/л раствора кислоты хлорной с К = 1,0034. на контрольный опыт пошло 0,09 мл титранта. 26.Рассчитайте интервал объемов 0,05 моль/л раствора трилона Б с К = 0,9985, который будет обеспечивать качество кальция глюконата (М.м. 1-водного = 448,40) по количественному определению при навеске 0,3946 г с учетом требований ГФ Х. 27.При определении количественного содержания кислоты глютаминовой по Сёренсену на титрование навески массой 0,1500 г затрачено 23,9 мл 0,1 М раствора гидроксида натрия, на контрольный опыт пошло 0,2 мл титранта. Рассчитайте содержание кислоты глютаминовой в веществе (М.м. = 147,13). 28.При определении количественного содержания кислоты глютаминовой методом нейтрализации на титрование навески массой 0,3017г затрачено 20,1 мл 0,1 М раствора гидроксида натрия. Рассчитайте содержание кислоты глютаминовой в веществе (М.м. = 147,13).. 29.Рассчитайте теоретический объем 0,1 М раствора гидроксида натрия, который пойдет на титрование 0,1495 г кислоты глютаминовой методом нейтрализации (М.м. = 147,13). 30.При количественном анализе кислоты глютаминовой методом Кьельдаля на титрование аммиака, выделившегося в процессе минерализации, затрачено 10,0 мл 0,1 М раствора кислоты хлористоводородной, на титрование контрольного опыта - 0,8 мл. Рассчитайте содержание азота в препарате (а = 0,1474 г). 31.При определении кислоты глютаминовой (М. м. = 147,13) в таблетках на титрование порошка одной растертой таблетки пошло 20,25 мл 0,1 М раствора натрия гидроксида (К = 0,98). Рассчитайте содержание действующего вещества в одной таблетке. Список литературы для подготовки. 1. Государственная Фармакопея. Издание XI, вып. 1,2. – Москва: Медицина, 1987. 2. Беликов, В.Г. Фармацевтическая химия: Учеб. Для вузов. – Пятигорск, 2007. 3. Фармацевтическая химия: Учеб. Пособие / Под ред. А.П. Арзамасцева. – 2-е изд., испр. – М.: ГОЭТАР-Медиа, 2005. 4. Химический анализ лекарственных веществ по функциональным группам. Учебно-методическое пособие для студентов фармацевтического факультета. – Нижний Новгород: Изд-во Нижегородской государственной медицинской академии, 2003. 5. Органические лекарственные препараты. Алифатические соединения. Краткий конспект лекций. – Нижний Новгород: Изд-во Нижегородской медицинской академи
|
||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 1419; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.156 (0.018 с.) |