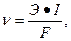Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Коррозия металлов и защита от коррозииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Коррозия – это разрушениеметалла в результате его физико-химического взаимодействия с окружающей средой. По механизму протекания коррозионного процесса различают химическую и электрохимическую коррозию. Химическая коррозия представляет собой самопроизвольное разрушение металлов в среде окислительного газа (например, кислорода, галогенов) при повышенных температурах или в жидких неэлектролитах. Уравнение реакции окисления металлов кислородом (пример газовой коррозии) можно записать в общем виде:
Электрохимическая коррозия протекает при контакте металла с растворами электролитов. Например, наиболее распространённая атмосферная коррозия протекает в тонких плёнках электролитов, которые возникают на поверхности металла в результате адсорбции, конденсации или прямого попадания воды и растворения в ней коррозионно-активных газов и солей (O2, SO2, CO2, NO2, NaCl и др.). Учитывая, что поверхность металла всегда энергетически неоднородна (из-за наличия примесей в металле, различий по химическому и фазовому составу сплава и др.), на участках металла, имеющих более отрицательное значение потенциала, пойдёт процесс окисления этого металла. Таким образом, при электрохимической коррозии разрушение металла происходит в результате работы огромного количества коррозионных микроэлементов. При этом на корродирующем металле протекает анодная реакция: АНОД M → Mn+ + ne-, а на участках металла с более положительным потенциалом – катодное восстановление окислителя (Ox): КАТОД Ox + ne- → Red. Наиболее распространёнными окислителями при электрохимической коррозии являются молекулы кислорода О2, воздуха и ионы водорода Н+ электролита. Коррозия с участием кислорода называется коррозией с поглощением кислорода (с кислородной деполяризацией). В зависимости от рН среды возможны два механизма ионизации (восстановления) кислорода: в щелочной или нейтральной среде O2 + 2H2O + 4e- → 4OH- (pH≥7), в кислой среде O2 + 4H+ + 4e- → 2H2O (pH<7). При коррозии с выделением водорода (с водородной деполяризацией) реакции выделения водорода имеют вид: в щелочной или нейтральной среде 2H2O + 2e- → H2 + 2OH- (pH≥7), в кислой среде 2H+ + 2e- → H2 (pH<7). Если в качестве окислителя одновременно выступают О2 и Н+, то такая коррозия называется коррозией со смешанной деполяризацией.
Возможность протекания электрохимической коррозии может быть определена по знаку ЭДС элемента: если ЭДС элемента имеет положительное значение, то коррозия возможна. Так как ЭДС равна разности потенциалов окислителя и восстановителя Еэ=Еок-Евосст или разности потенциалов катода и анода Еэ=Ек-Еа, то коррозия возможна при условии, что потенциал окислителя (или катода) положительнее потенциала металла: Еок > E(Mn+/M) или Ек > E(Mn+/M). Равновесный потенциал кислородного электрода при 298 К описывается уравнением: E (О2/ОН-) = 1.227 - 0.059●pH + 0.0147●lg p(О2), а потенциал водородного электрода - уравнением: E (H+/H2) = -0.0295●lg p(H2) - 0.059●pH.
Для оценки возможности или невозможности протекания электрохимических процессов обычно используют диаграммы Пурбэ. Анализ диаграмм Пурбэ для разных металлов показывает, что в водных средах, содержащих О2 и Н+, металлы корродируют по-разному, в зависимости от рН: а) если потенциал металла положительнее потенциала кислородного электрода (верхняя зона диаграммы), то коррозия металла невозможна (например потенциал золота); б) если потенциал металла положительнее потенциала водородного электрода и отрицательнее потенциала кислородного электрода (средняя зона диаграммы), коррозия возможна с поглощением кислорода и невозможна с выделением водорода; в) если потенциал металла отрицательнее потенциала водородного электрода (нижняя зона диаграммы), то возможна коррозия как с поглощением кислорода, так и с выделением водорода (щелочные и щелочно-земельные металлы, магний, алюминий, цинк и др.). Примеры решения задач Пример 1. Во сколько раз возрастает толщина плёнки при увеличении продолжительности равномерной газовой коррозии титана от 8 до 100 ч при 300 оС. Решение: На алюминии, хроме (при t<350 oC) и некоторых других металлах плёнка оксида растёт во времени τ по логарифмическому закону: δ = k lnτ, где δ – толщина плёнки. Соответственно δ1 = k ln8, δ2 = k ln100. Отсюда следует, что толщина плёнки (δ2/δ1) увеличится в 2.53 раза (ln(100/8)=2.53).
Пример 2. Определите скорость равномерной коррозии железа в (мм/год) и в [г/(м2●год)], если плотность коррозионного тока составляет 0.02 А/м2.
Решение: Скорость равномерной коррозии, выраженная в г/(м2●с), равна
где Э – молярная масса эквивалента металла (г/моль); I – плотность тока коррозии, А/м2; F – число Фарадея, F = 96500 Кл/моль. Умножая эту величину на число секунд в сутки (3600●24) и число дней в году (365), получим скорость коррозии в году ν = 170 г/(м2●год). Для перевода этой размерности в мм/год используем плотность железа ρ=7.87 г/см3. После преобразования единиц получим ν = 0.022 мм/год. Пример 3. Возможна ли электрохимическая коррозия олова (Sn) в водном растворе при рН=6 при контакте с воздухом, если относительные парциальные давления газов равны p(H2) = 1, p(O2) = 0.21? Напишите уравнения реакций анодного и катодного процессов. При каких значениях рН возможна коррозия с выделением кислорода? Решение: Найдём стандартный электродный потенциал олова (E0(Sn2+/Sn0=-0.136 В). По уравнению Нернста определим равновесные потенциалы вероятных окислителей (H+ и O2) при 25 оС, p(H2) = 1, p(O2) = 0.21 E (H+/H2) = -0.059●pH = -0.059●6 = -0.354 В, E (О2/ОН-) = 1.227 - 0.059●pH + 0.0147●lg0.21= 1.227 - 0.059●6 – 0.01 = 0.873 В. Рассчитаем ЭДС предполагаемых коррозионных микроэлементов: ε1 = Ек(Н2) – Еа = -0.354 В – (-0.136 В) = -0.218 В < 0 – коррозия с выделением водорода невозможна. ε2 = Ек(О2) – Еа = 0.873 В – (-0.136 В) = 1.009 В > 0 – коррозия с поглощением кислорода возможна. Таким образом, уравнения реакций анодного и катодного процессов выглядят следующим образом: (анод) Sn – 2e- → Sn2+ (катод) 1/2 O2 + 2H+ + 2e- → H2O. Для выяснения диапазона значений рН, при которых возможна коррозия с водородной деполяризацией, решим неравенство: ε1 = Ек(Н2) – Еа > 0. После подстановки значений электродных потенциалов получим -0.059●pH – (-0.136 В) > 0, Откуда следует, что при значениях рН < 0.136/0.059 = 2.26 идёт процесс с выделением водорода.
Пример 4. Определите, будет ли корродировать медь (Cu) в деаэрированном (без содержания кислорода) растворе CuSO4 в кислом растворе с рН=0 и выделением водорода при его относительном парциальном давлении p(H2) = 0.1. Решение: Стандартный потенциал меди составляет E0(Сu2+/Cu0)=+0.337 В, а потенциал водорода рассчитаем по уравнению Нернста: E (H+/H2) = -0.0295●lg p(H2) - 0.059●pH = -0.0295●lg0.1 - 0.059●0 = +0.0295 В. ЭДС коррозионного микроэлемента: ε = Ек(Н2) – Еа = +0.0295 В – 0.337 В < 0 – коррозия протекать не будет.
Пример 5. Определите возможность электрохимической коррозии с водородной деполяризацией гальванической пары Сu-Zn, погруженной в 0.01М раствор ZnSO4 при 25 oC. Как изменится ЭДС коррозионного элемента в результате концентрационной поляризации анода, если концентрация раствора возросла до 0.05 моль/л? Решение: С учётом гидролиза соли, образованной слабым основанием и сильной кислотой, рассчитываем рН раствора:
Равновесный потенциал водорода в предположении, что его относительное давление равно 1: E (H+/H2) = -0.059●pH = -0.230 В. Для выбора корродирующего металла воспользуемся их стандартными потенциалами (E0(Сu2+/Cu0=+0.337 В, E0(Zn2+/Zn0=-0.763 В). Потенциал меди значительно положительнее потенциала предполагаемого катода, и электрохимическая коррозия идёт с участием цинка. Запишем процессы в коррозионном элементе: (анод) Zn – 2e- → Zn2+ (катод) 2H+ + 2e- → H2. Для расчёта ЭДС указанного микроэлемента уточним равновесный потенциал цинка, используя уравнение Нернста для 25 oC: E1(Zn2+/Zn0) = -0.763 + (0.059/2)●lg10-2. При увеличении концентрации ZnSO4 его потенциал изменяется:
E2(Zn2+/Zn0) = -0.763 + (0.059/2)●lg(5●10-2) = E1(Zn2+/Zn0) + (0.059/2)●lg5. Таким образом, учитывая, что ε = Ек – Еа, значение ЭДС уменьшится на величину Δε = (0.059/2)●lg5 = 0.02 В.
Пример 6. Определите возможность электрохимической коррозии стального изделия (железа) в 0.1М растворе FeCl2, комнатной температуре (T=298 K) при следующих относительных парциальных давлениях водорода и кислорода: p(H2) = 0.1, p(O2) = 0.9. Решение: Указанная соль подвергается гидролизу. Учитывая первую ступень гидролиза: Fe2+ + H2O ↔ H+ + FeOH+, можно определить значение рН, величина которого, как видно из реакции меньше 7, т.е. коррозия идёт в подкисленной среде. Найдём рН раствора, принимая активность ионов равной их концентрации:
Теперь можно определить равновесные электродные потенциалы вероятных окислителей (H+ и O2): E (H+/H2) = -0.0295●lg p(H2) - 0.059●pH = -0.0295●lg0.1 - 0.059●5.56 = -0.3 В, E (О2/ОН-) = 1.227 - 0.059●pH + 0.0147●lg p(О2) = 0.9 В. Равновесный потенциал предполагаемого анода при 25 oC: E(Fe2+/Fe0) = E(Fe2+/Fe0) + (0.0592/2))●lg a(Fe2+) = -0.44 - (0.0592/2)●1 = -0.47 В. Учитывая, что ε1 = Ек(Н+) – Еа = -0.3 В – (-0.47 В) = +0.17 В > 0 – коррозия с выделением водорода возможна. ε2 = Ек(О2) – Еа = 0.9 В – (-0.47 В) = +1.37 В > 0 – коррозия с поглощением кислорода также возможна. Таким образом, возможна коррозия железа с протеканием на катоде двух реакций: 2H+ + 2e- → H2 1/2 O2 + 2H+ + 2e- → H2O.
Пример 7. Стальное изделие имеет цинковое покрытие. Какой из металлов будет окисляться при коррозии, если эта пара металлов попадёт в нейтральную среду с рН=7? Подсчитайте ЭДС коррозионного элемента для стандартных условий. При каких рН прекратится процесс выделения водорода? Решение: Стандартный потенциал цинка составляет E0(Zn2+/Zn0)= -0.763 В, а потенциал железа E0(Fe2+/Fe0)= -0.44 В. Учитывая, что потенциал цинка более отрицателен, цинк является анодным покрытием. При этом железо не будет принимать участие в анодном процессе, т.е. не будет корродировать. Равновесные потенциалы водорода и кислорода, при их парциальных давлениях, равных 1, определяем по уравнениям E (H+/H2) = - 0.059●pH = - 0.059●7 = -0.413 В, E (О2/ОН-) = 1.227 - 0.059●pH = +0.814 В. ЭДС коррозионных микроэлементов равны: ε1 = Ек(Н+) – Еа = -0.413 В – (-0.763 В) = +0.35 В > 0 – коррозия с выделением водорода возможна; ε2 = Ек(О2) – Еа = 0.814 В – (-0.763 В) = +1.577 В > 0 – коррозия с поглощением кислорода также возможна. Катодные процессы: 2H2O + 2e- → 2OH- + H2 1/2 O2 + H2O + 2e- → 2OH-. Процесс выделения водорода прекратится, если ε1<0,т.е. - 0.059●рН – (-0.763) <0, откуда следует, что рН<12.9 ε1<0, при этом процесс коррозии цинка с поглощением кислорода будет иметь место при любых значениях рН.
Контрольное задание Многовариантные задачи Задача 1. Гальваническая пара, состоящая из двух различных металлов, помещена в раствор электролита (см. таблицу). Какой металл и почему будет корродировать? Написать уравнения соответствующих электрохимических процессов (образование пассивирующих плёнок не учитывать).
Задача 2. Для пары металлов: 1) определите, возможна ли коррозия металла из данной пары в среде с заданным рН при контакте с воздухом; 2) напишите уравнения анодного и катодного процессов; 3) предложите для данной пары анодное и катодное покрытие. Изменятся ли и если изменятся, то как коррозионные процессы при нарушении сплошности покрытий. Запишите уравнения реакций.
Предлагаемые варианты заданий для индивидуальной работы Вариант №1 Задача 3. Определите скорость равномерной коррозии алюминия в (мм/год) и в [г/(м2●сут)], если плотность коррозионного тока составляет 0.062 А/м2. Задача 4. В чём сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворённый кислород. Составьте уравнения анодного и катодного процессов. Вариант №2 Задача 3. Магний равномерно корродирует в морской воде со скоростью 1,45 г/(м2●сут). Каково значение скорости коррозии, выраженное в мм/год? Если с такой же скоростью корродирует свинец, то каково соответствующее значение скорости коррозии в мм/год? Задача 4. Как проходит атмосферная коррозия луженого железа и луженой меди при нарушении покрытия? Составьте уравнения анодной и катодной реакций.
Вариант №3 Задача 3. Во сколько раз возрастает толщина плёнки при увеличении продолжительности равномерной газовой коррозии ванадия от 0 до 200 ч при 900 оС? Задача 4. Какой металл может служить протектором при защите железа от коррозии в одном растворе с рН = 10 в контакте с воздухом? Напишите уравнения протекающих реакций.
Вариант №4 Задача 3. Объясните, почему в атмосферных условиях цинк корродирует, а золото нет? Ответ подтвердите расчётами. Задача 4. Будет ли протекать электрохимическая коррозия изделия пары Ni-Cu в растворе NiSO4, имеющего концентрацию 0.03 моль/л при 35 оС? Как изменится ЭДС коррозионного элемента, если концентрация ионов Ni2+ возросла до 0.05 моль/л?
Вариант №5 Задача 3. Возможна ли коррозия олова в водном растворе с рН = 6 при контакте с воздухом? При каких значениях рН возможна коррозия с выделением водорода? Задача 4. Изделие из цинка погрузили в 0.04М раствор ZnSO4 при 60 оС. Будет ли цинк корродировать? Вариант №6 Задача 3. Возможна ли электрохимическая коррозия свинца (Pb) в водном растворе при рН = 6 при контакте с воздухом? Напишите уравнения реакций анодного и катодного процессов. При каких значениях рН возможна коррозия с выделением водорода? Задача 4. Определите возможность электрохимической коррозии изделия пары Fe-Cd, погруженной в 0.005М раствор FeCl2 при комнатной температуре, принимая коррозию избирательной. Как изменится ЭДС коррозионного элемента, если концентрация раствора возросла до 0.015 моль/л?
Вариант №7 Задача 3. Определите, будет ли корродировать медь (Cu) в деаэрированном (без содержания кислорода) растворе при рН = 0? Задача 4. Железное изделие покрыли свинцом. Какое это покрытие – анодное или катодное? Составьте уравнения анодного и катодного процессов коррозии этого изделия при нарушении цельности покрытий во волажном воздухе и в растворе соляной кислоты. Вариант №8 Задача 3. Магний (Mg) корродирует в морской воде (рН = 8) при контакте с воздухом. Напишите уравнения реакций анодного и катодного процессов. Задача 4. Как протекает атмосферная коррозия луженого железа и луженой меди, если покрытие нарушено? Составьте электродные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
Вариант №9 Задача 3. Изделие из цинка погрузили в 0.03М раствор ZnSO4 при 70 оС. Будет ли цинк корродировать? Задача 4. Если пластинку из чистого цинка опустить в разбавленную кислоту, то начинающееся выделение водорода вскоре почти прекратится. Однако при прикосновении к цинку медной палочкой на последней начинается бурное выделение водорода. Дайте этому объяснение, составив электродные уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции.
Вариант №10 Задача 3. Будет ли протекать электрохимическая коррозия изделия пары Ni-Cu в растворе NiSO4, имеющего концентрацию 0.04 моль/л при 25 оС? Как изменится ЭДС коррозионного элемента, если концентрация ионов Ni2+ возросла до 0.06 моль/л? Задача 4. Цинковую и железную пластины опустили в раствор сульфата меди (II). Составьте электродные и ионные уравнения реакций, происходящих на каждой из пластин. Какие процессы будут проходить на пластинах, если их наружные концы соединить проводником?
Вариант №11 Задача 3. Определите возможность электрохимической коррозии изделия пары Fe-Cd, погруженной в 0.01М раствор FeCl2 при комнатной температуре, принимая коррозию избирательной. Как изменится ЭДС коррозионного элемента, если концентрация раствора возросла до 0.02 моль/л? Задача 4. Железное изделие покрыли кадмием. Какое это покрытие – анодное или катодное? Составьте уравнения анодного и катодного процессов коррозии этого изделия при нарушении цельности покрытий во волажном воздухе и в растворе соляной кислоты.
Вариант №12 Задача 3. Изделие из железа с алюминиевым покрытием погрузили в 0.01М раствор AlCl3. Будет ли протекать коррозия этого изделия при комнатной температуре? Будет ли изменяться ЭДС и как, если концентрация раствора возрастёт до 0.03 моль/л? Задача 4. Магний равномерно корродирует в морской воде со скоростью 1,55 г/(м2●сут). Каково значение скорости коррозии, выраженное в мм/год? Если с такой же скоростью корродирует свинец, то каково соответствующее значение в мм/год?
Вариант №13 Задача 3. Олово спаяно с серебром. Какой из металлов будет окисляться при коррозии, если эта пара находится в щелочной среде? Подсчитайте ЭДС этого элемента для стандартных условий. Задача 4. Определите скорость равномерной коррозии алюминия в (мм/год) и в [г/(м2●сут)], если плотность коррозионного тока составляет 0.06 А/м2.
Вариант №14 Задача 3. Алюминий склёпан медью. Какой из металлов будет подвергаться коррозии, если эти металлы попадут в кислую среду? Составьте схему гальванического элемента, образующегося при этом. Подсчитаёте ЭДС этого элемента для стандартных условий. Задача 4. Будет ли протекать электрохимическая коррозия изделия пары Ni-Cu в растворе NiSO4, имеющего концентрацию 0.03 моль/л при 45 оС? Как изменится ЭДС коррозионного элемента, если концентрация ионов Ni2+ возросла до 0.07 моль/л?
Вариант №15 Задача 3. Железо покрыто хромом. Какой из металлов будет корродировать в случае нарушения поверхностного слоя покрытия в атмосфере промышленного района (влажный воздух содержит CO2, H2S, SO2 и др.)? Составьте схему процессов, происходящих на электродах образующегося гальванического элемента. Задача 4. Изделие из железа с алюминиевым покрытием погрузили в 0.005М раствор AlCl3. Будет ли протекать коррозия этого изделия при комнатной температуре? Будет ли изменяться ЭДС и как, если концентрация раствора возрастёт до 0.04 моль/л?
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-19; просмотров: 1468; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.27.144 (0.014 с.) |

 .
.