
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Жесткость воды. Методы умягчения ⇐ ПредыдущаяСтр 2 из 2
Природная вода содержит в растворенном или коллоидном состоянии различные неорганические и органические соединения. В наибольшем количестве в воде содержится катионы Са2+, Mg2+, Na+, K+ и анионы CO32-, HCO3-, SO42-, Cl-. Другие катионы (Fe3+, Mn2+) и анионы (HSiO3-, SO32-, S2O32-) встречаются значительно реже. В воде чаще всего растворены газы CO2, O2, N2, H2S, CH4 и др. Состав природных вод характеризуется некоторыми технологическими показателями, в том числе жёсткостью, реакцией среды, щелочностью, солесодержанием, окисляемостью. Жесткость воды отражает содержание в ней ионов кальция и магния. Она выражается в моль/л: Ж = ([Ca2+] + [Mg2+]). Различают карбонатную и некарбонатную жёсткость. Карбонатной называют жёсткость, обусловленную гидрокарбонатами кальция и магния Ca(HCO3)2 и Mg(HCO3)2, CaCO3, MgCO3 (растворимость CaCO3 в воде 13 мг/л, MgCO3 – 110 мг/л). Некарбонатная жёсткость представляет собой разность между общей и карбонатной жесткостью и обусловлена присутствием в воде солей сильных кислот CaCl2, MgCl2, CaSO4, MgSO4. Временная жесткость устраняется кипячением воды в течение 1 ч. Она обусловлена гидрокарбонатами. Ca(HCO3)2 = CaCO3 + СО2↑. При нагревании ионы HCO3- переходят в ионы CO32-. Образующийся карбонат кальция имеет малую растворимость (13 мг/л). Та часть карбонатной жесткости, которая остается после кипячения воды в течение часа, называется остаточной карбонатной жесткостью. Остаточная карбонатная жесткость с некарбонатной составляет постоянную жесткость т.е. можно сказать, что это разность между общей жесткостью и временной. Общую жёсткость Жо и карбонатную Жк воды можно определить методом титрования. Для определения Жо производится комплексометрическое титрование пробы анализируемой воды раствором двузамещённой натриевой соли этилендиаминтетрауксусной кислоты (трилон Б) в щелочной среде (рН=8) в присутствии индикатора хром тёмно-синий. Фиксируется переход окраски воды из розовой в голубую. Карбонатная жёсткость определяется кислотно-основным титрованием воды раствором соляной кислоты в присутствии индикатора метилового оранжевого, фиксируется переход желтой окраски в оранжевую. 1 мг/моль соответствует содержанию в 1 л воды 20.04 мг кальция или 12,16 мг магния. (За рубежом применяют разные условные единицы жесткости, называемые градусами жесткости, 1 градус соответствует 0,357 ммоль/л катионов двухзарядных металлов).
Щёлочность воды выражается суммой концентраций ионов гидроксида и анионов слабых кислот HCO3-, CO32-. Солесодержание – общая (суммарная) концентрация солей в воде. Окисляемость отражает содержание примесей, способных взаимодействовать с окислителями. Водоподготовка – комплекс технологических процессов по очистке воды для приведения её качества в соответствие с требованиями потребителя. Если ионные примеси могут образовывать малорастворимое соединение, то их можно перевести в это соединение, примеси-окислители можно устранить восстановлением, а примеси-восстановители – окислением. Для удаления примесей широко используется адсорбция, причём незаряженные примеси адсорбируются на активированном угле или других адсорбентах, а ионы – на ионообменных веществах. Методы осаждения Методы осаждения сводятся к переводу растворимых солей Ca2+ и Mg2+ в трудно растворимые соединения CaCO3 и MgCO3. Они делятся на термический и реагентные методы. Термический метод. При нагревании воды до 95 -980С гидрокарбонатные ионы НCO3- переходят в ионы CO32-. Так как растворимость газов (CO2) уменьшается с увеличением температуры, то при кипячении воды из нее выделяется CO2 Ca(HCO3)2 = CaCO3 + Н2О + СО2 Этот метод частично умягчает воду, снижает карбонатную жесткость, устраняет временную жесткость, а некарбонатная жесткость не изменяется. Реагентные или химические методы. При реагентных методах удаления ионов Ca2+ и Mg2+ достигается также в результате перевода их в малорастворимые соединения, но не нагреванием, а действием соответствующих химических реагентов. Известковый метод применяется для уменьшения карбонатной жесткости: Ca(HCO3)2 + Ca(OH)2 = Mg(HCO3)2 + 2Ca(OH)2 = С о довый метод используется для уменьшения некарбонатной жесткости: CaCl2 + Na2CO3 = CaSO4 + Na2CO3 = Для одновременного удаления карбонатной и некарбонатной жесткости применяется содово – известковый метод:
MgCl2 +Na2CO3 = MgCO3 + Ca(OH)2 = Метод добавления антинакипинов. Антинакипины – вещества добавляемые в воду с целью борьбы с образованием накипи. При добавлении антинакипинов ионы Ca2+ и Mg2+ переходят в осадок, который легко удаляется из воды (плотной накипи по стенкам не образуется). К антинакипинам относятся коллоиднодисперсный графит, фосфат натрия. Na3РO4 реагирует с солями Ca и Mg, образуя труднорастворимые соединения: 3CaSO4 + 2Na3РO4 = 3Ca(HCO3)2 + 2Na3РO4= Баритный метод применяется в том случае, если в воде содержится большая концентрация SO42-. CaSO4 + ВаСО3 = Методы ионного обмена Рассмотренные методы все же не дают степени умягчения, которая требуется для некоторых областей применения воды. Кроме того, они громоздки и связаны со значительным расходом реагентов. В последние годы широкое распространение получил метод ионного обмена. Применяемые в данном методе соединения называются ионитами – это твердые материалы, способные обменивать свои ионы на ионы, содержащиеся в воде. К ионитам относятся различные вещества – как неорганические, так и органические, природные и синтетические. Одним из простейших ионообменных материалов является сульфоуголь, получаемый обработкой бурых углей концентрированной Н2SO4 при нагревании. Неорганические иониты – пермутиты. Это искусственно приготовленные зернистые материалы, по своей природе являющиеся алюмосиликатами. Их получают сплавлением кварца (SiO2) с каолином (Al2O3) и содой (Na2CO3). Состав может быть условно обозначен [Na2П]. В настоящее время наибольшее значение приобрели различные ионообменные смолы, вырабатываемые на основе синтетических полимеров. В зависимости от того какие ионы в этих смолах обмениваются – катионы или анионы, различают катиониты и аниониты. Методы ионного обмена применяются как для умягчения воды, так и для ее обессоливания. По виду обмениваемых ионов катиониты подразделяют на Na – катиониты – Na2R (для умягчения воды), Н – катиониты (для обессоливания воды). При пропускании воды через колонку, заполненную Na – катионитом (зерна 0,2-0,3 мм), происходят обменные реакции: Ca(HCO3)2 + Na2R = 2NaНСО3 + CaR; CaCl2 + Na2R = 2NaCl + CaR; Mg(HCO3) + Na2R = 2NaНСО3 + MgR, где R – практически нерастворимый анион ионита. Вода полностью освобождается от Ca2+ и Mg2+. Когда весь Na+ в катионите заменится на Ca2+ и Mg2+, катион утрачивает способность смягчать воду, но он может быть легко восстановлен – регенерирован концентрированным раствором NaCl: CaR + 2NaCl = CaCl3 + Na2R; MgR + 2NaCl = MgCl2 + Na2R. Сущность Н – катионирования состоит в реакции обмена иона Н+ из катиона на ионы Ca2+,Mg2+, Na+ в воде. Ca(HCO3)2 + Н2R = CaR + 2Н2О + 2СО2; CaCl2 + Н2R = CaR + 2НCl; MgSO4 + Н2R = MgR + Н2SO4. В результате обработки в воде вместо солей появляется эквивалентное количество кислоты. Происходит обессоливание воды. Регенерация Н – катионов осуществляется раствором кислоты: CaR + Н2SO4 = CaSO4 + Н2R. Аниониты способны к обмену ионов только в кислой среде. С помощью анионитов осуществляется обмен всех кислотных анионов, содержащихся в воде, на ионы ОН-: SO42- + R(ОН)2 = RSO4 + 2ОН-, CO32- + R(ОН)2 = RCO3 + 2ОН-, Cl- + R(ОН)2 = RCl2 + 2ОН-. Аниониты регенерируются раствором NaОН: RSO4 + 2NaОН = Na2SO4 + R(ОН)2. Кроме перечисленных методов на практике применяются еще магнитные, ультразвуковые, электрохимические и другие методы обработки воды.
Частичное удаление солей из воды может быть осуществлено путем вымораживания. Этот способ применяется для опреснения морской воды. При замерзании воды основная масса солей остается в незамерзшей воде, а лед сравнительно мало содержит солей. Вода, используемая для питьевых нужд, подвергается очистке от взвесей (коагуляцией, осветлением) и обеззараживанию с помощью жидкого хлора, хлорной извести, озона. Примеры решения задач Пример 1. Определите общую Жо, карбонатную Жк и некарбонатную Жнк жесткость воды, если на титрование её 100 мл потребовалось 8 мл 0.1н. раствора трилона Б и 5 мл 0.1н. раствора соляной кислоты. Решение: Расчёт жёсткости воды ведётся по закону эквивалентов:
где VB – объём анализируемой пробы воды, мл; VT – объём титрующего раствора, мл; СН – нормальная (эквивалентная) концентрация титрующего раствора, моль/л. После подстановки заданных значений получим:
Жнк = Жо – Жк = 8 – 5 = 3 ммоль/л.
Пример 2. Анализ воды показал, что в ней содержится гидрокарбонат кальция Ca(HCO3)2 массой 1386 мг, хлорид кальция CaCl2 массой 610 мг, хлорид натрия NaCl массой 480 мг. Объём воды составил5 л. Определите общую жёсткость Жо, карбонатную Жк, некарбонатную Жнк жесткость, солесодержание, рН воды. Решение: Общая жесткость воды Жо – суммарная концентрация ионов Ca2+и Mg2+, выраженная в ммоль/л:
где m1, m2 – масса катионов Ca2+и Mg2+ в воде или соответствующих им солей, мг; Э1, Э2 – молярная масса эквивалентов (эквивалент) катионов Ca2+и Mg2+ или соответствующих им солей, г/моль; V – объём воды, л. Определим эквиваленты солей, характеризующих жёсткость воды: Э(Ca(HCO3)2) = М/2 = 81.05 г/моль, Э(CaCl2) = М/2 = 55.5 г/моль. Общую жёсткость воды можно рассчитать:
Поскольку карбонатная жёсткость Жк – это часть Жо, обусловленная содержание в воде гидрокарбонатов кальция и магния, то она равна:
Некарбонатная жесткость Жнк исследуемой воды обусловлена содержанием в ней соли хлорида кальция:
Солесодержание:
Расчёт рН воды. Соли NaCl, CaCl2 образованы сильными основаниями и сильными кислотами. Их растворы в воде имеют нейтральную реакцию среды, рН=7. Соль Ca(HCO3)2 образована сильным основанием Ca(OH)2 и слабой кислотой H2CO3, поэтому при растворении в воде подвергается гидролизу, и её раствор имеет основную реакцию среды: HCO3- + H2O ↔ H2CO3 + OH-.
Константа гидролиза соли вычисляется по формуле:
где Кώ = 10-14 – ионное произведение воды; Кд1(H2CO3) = 4.45●10-7 – константа диссоциации угольной кислоты по первой ступени. Уравнение диссоциации гидрокарбоната кальция: Ca(HCO3)2 ↔ Ca2+ + 2HCO3-, поэтому исходная концентрация гидрокарбонат-ионов: С0 = 2С(Ca(HCO3)2) = 3.3●10-3 моль/л. Определяем степень гидролиза гидрокарбоната кальция:
Находим концентрацию гидроксид-ионов и рН раствора соли:
Пример 3. Природная вода имеет следующие исходные показатели качества: общая жёсткость Жо = 5.15 ммоль/л, солесодержание Р = 0.47 г/л. Солевой состав воды: 1386 мг Ca(HCO3)2, 500 мг MgCl2, 480 мг NaCl. Объём воды V = 5 л. Определите жёсткость и солесодержание воды после Na – катионирования. Решение: При Na-катионировании исходная вода пропускается через слой Na-катионита. При этом ионы Ca2+и Mg2+ из природной воды обмениваются на ионы Na+ из катионита: 2R-Na+(И) + Ca2+(р-р) ↔ R-2Сa2+(И) + 2Na+(р-р) 2R-Na+(И) + Mg2+(р-р) ↔ R-2Mg2+(И) + 2Na+(р-р). Обмен происходит по закону эквивалентов, т.е. NЭ(Ca2+, Mg2+) = NЭ(Na+) или ЖоV = NЭ(Na+). Молярные массы эквивалентов солей жёсткости и солей натрия: Э(Ca(HCO3)2) = М/2 = 162.11/2 = 81.05 г/моль; Э(MgCl2) = М/2 = 95.21/2 = 47.62 г/моль; Э(NaHCO3) = М = 84 г/моль; Э(NaCl) = М = 58.5 г/моль. Тогда солесодержание Na-катионированной воды будет определяться содержанием в воде солей натрия:
Видно, после полного Na – катионирования воды её солесодержание осталось, примерно, как в исходной воде. Пример 4. Определите жёсткость, солесодержание и рН воды после её обработки методом Н – катионирования, если её природная вода имеет следующий солевой состав: 1386 мг Ca(HCO3)2, 500 мг MgCl2, 480 мг NaCl. Объём воды V = 5 л. Решение: При Н-катионировании исходная вода пропускается через слой Н-катионита. При этом катионы из обрабатываемой воды обмениваются на ионы водорода из катионита: 2R-Н+(И) + Ca2+(р-р) ↔ R-2Сa2+(И) + 2Н+(р-р) 2R-Н+(И) + Mg2+(р-р) ↔ R-2Mg2+(И) + 2Н+(р-р) R-Н+(И) + Na+(р-р) ↔ R-Na+(И) + Н+(р-р). Как видно, после Н-катионирования в обработанной воде практически не остаётся растворённых солей, т.е. солесодержание и жёсткость воды становятся близкими к нулю: Р=0; Жо=0. Однако обработанная вода в результате образования избытка ионов водорода становится более коррозионно-агрессивной, так как уменьшается рН среды. Обмен катионов происходит по закону эквивалентов:
поэтому концентрация ионов водорода в обработанной воде будет равна:
Определим рН обработанной воды: рН = -lg a(H+) ≈ -lg C(H+) = - lg(7.1●10-3) = 2.2 – среда кислая. Пример 5. Определите жёсткость, солесодержание и рН воды после параллельного Н-Na – катионирования. Природная вода имеет исходные показатели качества: жесткость карбонатная ЖК = 3.3 ммоль/л, жесткость некарбонатная ЖНК = 2.2 ммоль/л, солесодержание Р = 0.47 г/л. Солевой состав: 1386 мг Ca(HCO3)2, 500 мг MgCl2, 480 мг NaCl. Объём воды V = 5 л. Решение: В методе параллельного H-Na – катионирования весь объём воды делится на два потока, один из которых (эквивалентный некарбонатной жёсткости) направляется на Na – катионирования, а другой (эквивалентный карбонатной жёсткости) – на Н - катионирование:
После обработки потоки воды объединяются. Процессы в катионитах: 2R-Na+(И) + Mg2+(р-р) + 2Cl-(p-p) ↔ R-2Mg2+(И) + 2Na+(р-р) + 2Cl-(p-p), 2R-Н+(И) + Ca2+(р-р) + 2HCO3-(p-p) ↔ R-2Сa2+(И) + 2Н+(р-р) + 2HCO3-(p-p). Как видно из уравнений процессов H-Na – катионирования, при полном сдвиге равновесия вправо в воде не остаётся ионов Ca2+и Mg2+, следовательно, Жо=0. Солесодержание обработанной воды определяется растворённой в воде солью NaCl (исходная соль плюс продукт катионирования):
Как видно, солесодержание воды после параллельного Н-Na – катионирования стало меньше, чем в исходной воде, но не стало равным нулю, как при Н-катионировании. Водородные показатель среды после параллельного Н-Na – катионирования определяется наличием в обработанной воде избытка водородных ионов, концентрация которых эквивалентна ЖК исходной воды:
рН = -lg a(H+) ≈ -lg C(H+) = - lg(3.3●10-3) = 2.48 – среда кислая. Пример 6. Определите массы реагентов, требуемых для полного умягчения воды, если природная вода имеет следующие показатели жесткости (ммоль/л): ЖК = 3.3, ЖНК = 2.2. Объём воды V = 5 л. Солевой состав воды Ca(HCO3)2, MgCl2. Решение: Умягчение воды методом осаждения – это обработка воды химическими реагентами: содой и известью. В результате образуются труднорастворимые вещества CaCO3 и Mg(OH)2, выделяемые из воды фильтрованием: При добавлении в воду извести Ca(OH)2 снижается карбонатная жёсткость: Ca(HCO3)2 + Ca(OH)2 = При добавлении в воды соды Na2CO3 снижается некарбонатная жёсткость воды: MgCl2 +Na2CO3 = Массу используемых реагентов можно определить по закону эквивалентов:
Эквивалентные массы реагентов: Э(Ca(OH)2) = 37 г/моль, Э(Na2CO3) = 53 г/моль. Определим массы реагентов для умягчения воды:
Пример 7. Общая жёсткость воды Жо = 5.5 ммоль/л, карбонатная жёсткость ЖК = 3.3 ммоль/л. Объём воды V = 5 л. Определите массу осадка, выпавшего при термическом умягчении воды. Решение: При термическом умягчении воды происходит снижение карбонатной жёсткости в соответствии с реакцией Ca(HCO3)2 → CaCO3↓ + Н2О + СО2 Массу образовавшегося карбоната кальция (осадка) можно определить по закону эквивалентов:
Эквивалент карбоната кальция: Э(CaCO3) = M/2 = 50 г/моль, тогда масса образовавшегося карбоната кальция
Определим, сколько карбоната кальция растворится в 5 л воды. Согласно справочным данным произведение растворимости ПР(CaCO3) = 4.8●10-9. Предельная растворимость в воде карбоната кальция:
предельная масса растворённого в 5 л воды карбоната кальция:
Таким образом, в осадок при термическом умягчении воды выпадет:
Остаточная жёсткость воды после её термического умягчения будет практически равна некарбонатной жесткости 2.2 ммоль/л. Контрольное задание Многовариантная задача Задача 1. Считая, что в воде содержатся только соли Ca(HCO3)2 и CaCl2, рассчитайте: - солесодержание и рН исходной воды; - массу осадка после термического умягчения воды; - количество реагентов, необходимых для умягчения воды методом осаждения (расчёт вести на 100%-ные растворы умягчающих реагентов); - солесодержание и рН воды после Na-катионирования; - солесодержание и рН воды после Н-катионирования.
Предлагаемые варианты заданий для индивидуальной работы Вариант №1 Задача 2. Определите сколько мл 0.1н. раствора трилона Б и 0.1н. раствора HCl израсходовано при определении жёсткости воды методом комплексонометрии, если объём пробы воды равен 100 мл. Результаты анализа: общая жёсткость Жо=3 ммоль/л, карбонатная жёсткость ЖК=2.5 ммоль/л. Задача 3. Рассчитайте, как изменилась в воде концентрация ионов Ca2+, если в воду после фильтрования через Na-катионит перешло 23 мг/л Na+. Вариант №2 Задача 2. Какую массу и каких реагентов нужно затратить на умягчение 7 л воды, имеющей следующие величины жёсткости: Жо=5 ммоль/л, ЖК=4 ммоль/л. Составьте уравнения процессов умягчения. Задача 3. Рассчитайте изменение жёсткости воды в результате Na-катионирования, если концентрация ионов Na+ в воде увеличилась на 46 мг/л. Составьте уравнение процесса. Изменилось ли солесодержание воды?
Вариант №3 Задача 2. Определите сколько мл 0.1н. раствора трилона Б и 0.05н. раствора HCl израсходовано при определении жёсткости воды методом комплексонометрии, если объём пробы воды равен 100 мл. Результаты анализа: общая жёсткость Жо=2.5 ммоль/л, карбонатная жёсткость ЖК=2 ммоль/л. Задача 3. Общая жёсткость воды равна 4.5 ммоль/л. Через ионообменный фильтр пропущено 100 л воды. Сколько молей эквивалентов Ca2+ и Mg2+ задержано фильтром, если жёсткость воды при этом снизилась до 0.12 ммоль/л? Составьте уравнения процессов.
Вариант №4 Задача 2. Какую массу и каких реагентов нужно затратить на умягчение 30 л воды, имеющей следующие величины жёсткости: Жо=2.75 ммоль/л, ЖК=1.6 ммоль/л. Составьте уравнения процессов умягчения. Задача 3. Рассчитайте изменение жёсткости воды в результате Н-катионирования, если в воду перешло 12 мг/л ионов Н+. Составьте уравнение процесса. Изменилось ли солесодержание воды?
Вариант №5 Задача 2. На умягчение 10 л воды израсходовано Ca(OH)2 массой 3.7 г и Na2CO3 массой 1.06 г. Рассчитайте общую жёсткость Жо исходной воды. Составьте уравнения процессов умягчения. Задача 3. Общая жёсткость воды равна 5 ммоль/л. Через ионообменный фильтр пропущено 10 л воды. Сколько молей эквивалентов Ca2+ и Mg2+ задержано фильтром, если жёсткость воды при этом снизилась до 0.5 ммоль/л? Составьте уравнения процессов. Вариант №6 Задача 2. При термическом умягчении 10 л воды образовался осадок массой 2 г. Определите остаточную ЖНК, если исходная общая жёсткость воды Жо составляла 6.5 ммоль/л. Составьте уравнения процессов умягчения. Задача 3. Рассчитайте изменение жёсткости воды в результате Na-катионирования, если концентрация ионов Na+ в воде увеличилась на 23 мг/л. Составьте уравнение процесса. Изменилось ли солесодержание воды?
Вариант №7 Задача 2. На умягчение 150 л воды израсходовано Ca(OH)2 массой 5.57 г и Na2CO3 массой 26.6 г. Рассчитайте общую жёсткость Жо исходной воды. Составьте уравнения процессов умягчения. Задача 3. Общая жёсткость воды равна 3.8 ммоль/л. Через ионообменный фильтр пропущено 100 л воды. Сколько молей эквивалентов Ca2+ и Mg2+ задержано фильтром, если жёсткость воды при этом снизилась до 0.07 ммоль/л? Составьте уравнения процессов. Вариант №8 Задача 2. При термическом умягчении 20 л воды образовался осадок массой 2 г. Определите остаточную ЖНК, если исходная общая жёсткость воды Жо составляла 5 ммоль/л. Составьте уравнения процессов умягчения. Задача 3. Рассчитайте изменение жёсткости воды в результате Н-катионирования, если в воду перешло 8 мг/л ионов Н+. Составьте уравнение процесса. Изменилось ли солесодержание воды?
Вариант №9 Задача 2. В 4 м3 воды содержатся Ca(HCO3)2 массой 648 г и CaCl2 массой 1335 г. Определите жёсткость, солесодержание и рН воды. Задача 3. Общая жёсткость воды равна 7 ммоль/л. Через ионообменный фильтр пропущено 15 л воды. Сколько молей эквивалентов Ca2+ и Mg2+ задержано фильтром, если жёсткость воды при этом снизилась до 0.7 ммоль/л? Составьте уравнения процессов.
Вариант №10 Задача 2. Какую массу и каких реагентов нужно затратить на умягчение 12 л воды, имеющей следующие величины жёсткости: Жо=7.5 ммоль/л, ЖК=5 ммоль/л. Составьте уравнения процессов умягчения. Задача 3. Рассчитайте изменение жёсткости воды в результате Н-катионирования, если в воду перешло 10 мг/л ионов Н+. Составьте уравнение процесса. Изменилось ли солесодержание воды?
Вариант №11 Задача 2. В 10 м3 воды содержатся Ca(HCO3)2 массой 2430 г и CaCl2 массой 1110 г. Определите жёсткость, солесодержание и рН воды. Задача 3. Общая жёсткость воды равна 6 ммоль/л. Через ионообменный фильтр пропущено 10 л воды. Сколько молей эквивалентов Ca2+ и Mg2+ задержано фильтром, если жёсткость воды при этом снизилась до 0.5 ммоль/л? Составьте уравнения процессов.
Вариант №12 Задача 2. Определите сколько мл 0.05н. раствора трилона Б и 0.1н. раствора HCl израсходовано при определении жёсткости воды методом комплексонометрии, если объём пробы воды равен 150 мл. Результаты анализа: общая жёсткость Жо=4.5 ммоль/л, карбонатная жёсткость ЖК=3.5 ммоль/л. Задача 3. Рассчитайте изменение жёсткости воды в результате Na-катионирования, если концентрация ионов Na+ в воде увеличилась на 23 мг/л. Составьте уравнение процесса. Изменилось ли солесодержание воды?
Вариант №13 Задача 2. Какую массу и каких реагентов нужно затратить на умягчение 20 л воды, имеющей следующие величины жёсткости: Жо=5.5 ммоль/л, ЖК=3.5 ммоль/л. Составьте уравнения процессов умягчения. Задача 3. Общая жёсткость воды равна 4.1 ммоль/л. Через ионообменный фильтр пропущено 100 л воды. Сколько молей эквивалентов Ca2+ и Mg2+ задержано фильтром, если жёсткость воды при этом снизилась до 0.1 ммоль/л? Составьте уравнения процессов.
Вариант №14 Задача 2. При термическом умягчении 15 л воды образовался осадок массой 3 г. Определите остаточную ЖНК, если исходная общая жёсткость воды Жо составляла 7.5 ммоль/л. Составьте уравнения процессов умягчения. Задача 3. Рассчитайте изменение жёсткости воды в результате Na-катионирования, если концентрация ионов Na+ в воде увеличилась на 46 мг/л. Составьте уравнение процесса. Изменилось ли солесодержание воды?
Вариант №15 Задача 2. В 8 м3 воды содержатся Ca(HCO3)2 массой 1300 г и CaCl2 массой 690 г. Определите жёсткость, солесодержание и рН воды. Задача 3. Рассчитайте, как изменилась в воде концентрация ионов Ca2+, если в воду после фильтрования через Na-катионит перешло 23 мг/л Na+.
Приложение. Стандартные электродные потенциалы Е0 в водных растворах при 25 оС (298 К)
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-19; просмотров: 414; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.184.162 (0.14 с.) |
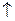 . Это приводит к смещению химического равновесия вправо и гидрокарбонаты переходят в трудно растворимые карбонаты, выпадающие в осадок:
. Это приводит к смещению химического равновесия вправо и гидрокарбонаты переходят в трудно растворимые карбонаты, выпадающие в осадок: 2CaCO3 + 2Н2О;
2CaCO3 + 2Н2О;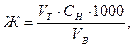 ммоль/л,
ммоль/л,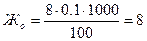 ммоль/л,
ммоль/л, ммоль/л,
ммоль/л,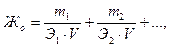
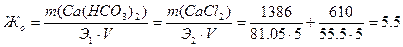 ммоль/л.
ммоль/л.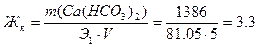 ммоль/л.
ммоль/л. ммоль/л.
ммоль/л.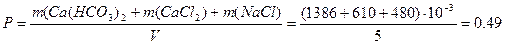 г/л.
г/л.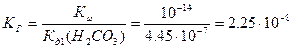 ,
,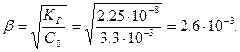
 моль/л,
моль/л,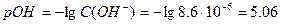 ,
, - основная реакция среды.
- основная реакция среды.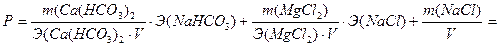
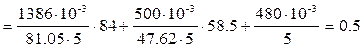 г/л.
г/л.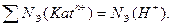

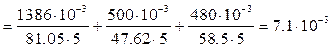 моль/л.
моль/л.
 г/л.
г/л. моль/л,
моль/л,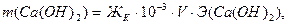
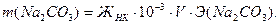
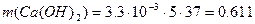 г или 611 мг,
г или 611 мг,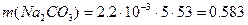 г или 583 мг.
г или 583 мг.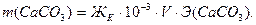
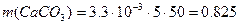 г.
г. моль/л,
моль/л,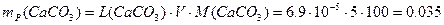 г.
г.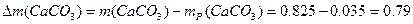 г.
г.


