
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Часть 1. Методы молекулярной биологииСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ Национальный исследовательский университет Новосибирский государственный университет Факультет естественных наук
Задания к семинарским занятиям по молекулярной биологии
Курс 2–й, IV семестр
Учебно - методическое пособие
Новосибирск 2012 Предлагаемое учебно-методическое пособие предназначено для студентов 2-го курса биологического отделения факультета естественных наук и медицинского факультета. Оно содержит: краткое описание базовых молекулярно-биологических методов, примеры решения задач и задачи для самостоятельного решения, справочные таблицы.
В данном пособии используются материалы из следующих источников: Уилсон Дж., Хант Т. Молекулярная биология клетки: Сборник задач: Пер. с англ. - М.: Мир, 1994 В. М. Глазер А. И. Ким, Н. Н. Орлова, И. Г. Удина, Ю. П. Алтухов. Задачи по современной генетике. Книжный дом "Университет". 2008 С. Примроуз, Р. Тваймен Геномика. Роль в медицине. Бином. Лаборатория знаний. 2008. М. Сингер, П. Берг Гены и геномы (в 2-х томах) М. Мир. 1998 Мусил Я., Новикова О., Кунц К. Современная биохимия в схемах - М.: Мир, 1984 Коничев А.С., Цветков И.Л., Попов А.П., и др.Практикум по молекулярной биологии. М.: КолосС, 2012 Wilson J, Hunt T. Molecular Biology of the Cell 5E - The Problems Book. NY. Garland Science - Taylor & Francis Group. 2008.
Составители: Доцент Колесникова Т.Д., ассистент Зайцева О.О.
Учебно-методическое пособие подготовлено в рамках реализации Программы развития НИУ-НГУ
© Новосибирский государственный университет, 2012
Часть 1. Методы молекулярной биологии Электрофоретическое разделение фрагментов ДНК Для визуализации результатов операций, проводимых с ДНК, таких как выделение, рестрикция, ПЦР, молекулярное клонирование, наиболее часто используют электрофорез. Электрофорез – метод разделения макромолекул (в том числе молекул и фрагментов ДНК) в геле по размеру и заряду в постоянном электрическом поле. Существует два вида электрофореза – горизонтальный и вертикальный.
Рис. 1. Горизонтальный электрофорез в агарозном геле. Для проведения горизонтального электрофореза используют пластину агарозного геля необходимой концентрации с добавлением специального красителя, например бромида этидия. Поскольку каждый из нуклеотидов молекулы ДНК несет остаток ортофосфорной кислоты со свободной гидроксильной группой, в нейтральной и особенно в слабощелочной среде молекула ДНК приобретает отрицательный заряд и способность перемещаться в электрическом поле в направлении от катода к аноду. На скорость движения ДНК в геле в процессе электрофореза влияют несколько факторов. Агарозный гель – пористая структура, и увеличение концентрации агарозы в геле приводит к уменьшению размеров его пор и, соответственно, к снижению скорости движения макромолекул сквозь гель. Увеличение напряженности электрического поля ускоряет движение молекул. Заряд молекулы увеличивается пропорционально ее длине, но при этом пропорционально длине увеличивается и ее масса. Поэтому ключевым фактором, определяющим скорость движения молекул в геле является способность молекул «протискиваться» через поры геля. Разделение молекул основано на том, что электрофоретическая подвижность молекулы ДНК снижается с увеличением ее длины. Линейные молекулы ДНК одного размера движутся в геле с одинаковой скоростью. Подвижность суперспирализованных и просто кольцевых молекул ДНК отличается от подвижности линейных молекул того же размера.
Рис. 2. Один из стандартных маркеров молекулярного веса (плазмида pR322, рестриктаза BsuR I). Рис. 3 Электрофоретический гель, окрашенный бромидом этидия. На левой дорожке нанесен маркер молекулярного веса
Для контроля скорости движения ДНК в геле, а также для определения времени окончания процесса электрофореза применяют краску-лидер (специальный краситель, например, бромфеноловый синий), которая перемещается в геле, немного опережая макромолекулы ДНК, двигающиеся в процессе электрофореза. Для визуализации результатов электрофореза используют краситель бромид этидия, который вносят в процессе приготовления геля. Данное вещество встраивается (интеркалирует) в двуцепочечные молекулы ДНК плоскими ароматическими группами. После окончания электрофореза гель помещают на светофильтр трансиллюминатора, пропускающего свет в диапазоне 254-400 нм. Краситель начинает флуоресцировать в оранжево-красной области видимого спектра, при этом становится видна ДНК. Для вертикального гель-электрофореза используют полиакриламидный гель (ПААГ). Электрофорез в ПААГ характеризуется высокой разрешающей способностью. Рестрикционный анализ Рестрикция – процесс расщепления чужеродной молекулы ДНК под действием специфических бактериальных ферментов – эндонуклеаз рестрикции или рестриктаз. Эндонуклеазы рестрикции - это бактериальные ферменты, которые расщепляют молекулы ДНК внутри участков с определенной последовательностью. Фермент расщепляет обе цепи ДНК, причем одноцепочечные разрывы могут располагаться точно друг против друга (образуются «тупые» концы) или с некоторым смещением друг относительно друг друга (образуются «липкие концы»).
Рис. 4. «липкие концы», образующиеся в результате гидролиза ДНК рестриктазами BamH I и Pst I. Эндонуклеазы рестрикции являются незаменимым инструментом молекулярного биолога, поскольку позволяют делить большие молекулы ДНК на заранее известные фрагменты Репортерные гены. Гены флюоресцентных белков. Продукт некоторых репортерных генов можно непосредственно наблюдать в клетках и по его наличию судить о присутствии в клетке рекомбинатного вектора. Такими репортерными генами могут быть гены флюоресцентных белков, излучающих свет при облучении ультрафиолетом. Гены устойчивости к антибиотикам. Во многих плазмидах, обнаруженных в природе, закодированы гены, позволяющие бактериям противостоять воздействию различных антибиотиков. Это свойство можно использовать для селекции трансформированных клонов. С помощью генов устойчивости к антибиотикам можно отобрать не только клоны, несущие вектор, но именно те колонии, которые содержат вектор со встройкой. Это очень полезный метод, так как эффективность лигирования вектора со встройкой не всегда стопроцентная, и часть клеток может получить плазмиду, которая зашилась сама на себя и не несет встройки. Для этого в векторе должно содежаться два гена устойчивости к разным антибиотикам, например к ампициллину и хлорамфениколу. Обычно такие гены обозначают Ampre и Chlore. В одном из этих генов должен находиться сайт рестрикции, по которому происходит встройка целевого фрагмента. Сначала бактерии необходимо высеять на среде, содержащей ампициллин. Выжить на ней смогут только те колонии, которые содержат вектор с геном Ampre. Затем, при помощи бархатной печатки отпечаток колоний переносят на среду с хлорамфениколом. Поскольку в плазмидах, несущих целевую встройку, ген Chlore нарушен, на этой среде они расти не смогут. Таким образом можно определить, какие колонии несут вектор со встройкой. Также часто пользуются удобной репортерной системой X-gal/LacZ (в частности, она реализована в популярной плазмиде pBluescript). В таких векторах присутствует ген LacZ, кодирующий фермент β-галактозидазу. Этот фермент взаимодействует с бесцветным полисахаридом X-gal с образованием продукта, окрашенного в ярко-синий цвет. Cайт для внедрения встройки располагают в гене LacZ. Следовательно, те колонии, которые при выращивании на среде, содержащей X-gal, окажутся неокрашеными, несут встройку, поскольку встройка сбивает рамку считывания гена β-галактозидазы. Однако, следует помнить, что длина встройки в парах нуклеотидов не должна быть кратна трем. Также наличие целевой встройки можно оценить при помощи ПЦР. Для этого необходимо иметь праймеры, располагающиеся по краям встройки. Плазмидную ДНК для анализа можно получить все лишь прикоснувшись носиком пипетки к колонии. Размер ПЦР-продуктов на электрофорезе говорит о длине встройки.
Рис. 7. Стандартный плазмидный вектор
Рис. 8. Типичный вектор, сконструированный на основе фага М13. Цифрами отмечены разные гены фага (гены 2 и 5 ответственны за репликацию, остальные детерминируют образование капсида и сборку). Светлый овал - область начала репликации; некодирующий участок выделен цветом. В некодирующую область фагового генома встроена часть lас -оперона E. coli. Затем в ген lac Z встроен сегмент длиной 42 п.н., содержащий несколько сайтов для эндонуклеаз рестрикции (полилинкер, или мультиклонирующий сайт). Прежде чем клонировать специфическую генную последовательность, ее необходимо выделить из природных источников. ДНК может быть выделена из различного материала: свежего, замороженного, сушенного, фиксированного и т.д. В каждом случае подбирается соответствующий метод. Методы выделения ДНК могут значительно отличатся деталями, однако любой из них включает три стадии: 1. Гомогенизация 2. Обработка детергентом (лизис клеточных мембран) 3. Очистка ДНК. Таким образом происходит выделение тотальной ДНК, то есть, интересующие исследователя индивидуальные последовательности ДНК (например, индивидуальные гены) «разбавлены» миллионами не относящихся к ним фрагментов ДНК. Одним из подходов к решению этой проблемы является первоначально тотальное клонирование всех выделенных фрагментов генома – создание библиотеки ДНК. Затем проводится скрининг библиотеки (то есть, поиск в ней колоний, соответствующих интереующим участкам генома). Такой скрининг можно осуществлять путем гибридизации с использованием меченого ДНК-зонда. Этот метод выявления нужного клона в библиотеке основан на способности зонда узнавать определенную комплементарную последовательность. Подходящие зонды или праймеры могут быть выбраны на основании данных о структуре частичных клонов данного гена, родственных генов из других организмов, консенсусных последовательностей, характерных для определенного семейства генов, или аминокислотных последовательностей белков. Полимеразная цепная реакция Полимеразная цепная реакция (ПЦР) – метод амплификации (умножения числа копий) фрагментов нуклеиновых кислот in vitro, с помощью которого можно быстро и избирательно получить миллионы копий определенных (целевых) нуклеотидных последовательностей. В ПЦР для амплификации фрагментов ДНК используют термоустойчивую ДНК-полимеразу из термофильной бактарии Thermus aquaticus (Taq-полимераза), которая в присутствии четырех видов дезоксирибонуклеозидтрифосфатов (дАТФ, дГТФ, дСТФ, дТТФ) и коротких 20-30членных затравок (праймеров) осуществляет синтез комплементарных последовательностей ДНК. В качестве матрицы для ПЦР можно использовать тотальную ДНК, полученную из исследуемого материала. В ходе ПЦР проводят термическую денатурацию двуцепочечной молекулы ДНК про 93-95 °С, после чего пробы охлаждают примерно до 60 °С, хотя оптимальная температура отжига (т. е. возникновения комплементарных взаимодействий между праймером и матрицей) различных праймеров отличается), что дает возможность праймерам связаться с одноцепочечной (в результате денатурации) ДНК. Праймеры подстраиваются по комплементарному принципу к гомологичным участкам «материнской» ДНК и служат для двух целей: запускают работу Taq-полимеразы и одновременно ограничивают участок синтеза ДНК. ПЦР имеет циклический характер. В первом и частично во втором цикле образуются копии (ампликоны), не соответствующие границам амплифицируемого гена. Начиная с третьего цикла длина большинства ампликонов становится стандартной, т.е. соответствует числу пар нуклеотидов ДНК-матрицы между 3’ концами праймеров. Ампликоны накапливаются в геометрической прогрессии, так как синтезированные ампликоны в дальнейшем сами служат матрицей, на которой идет синтез. Повторяя циклы амплификации 30-40 раз, можно за 1,5-3 ч получить миллионы копий гена (2n, где n – число циклов амплификации). Для проведения ПЦР в простейшем случае требуются следующие компоненты: · ДНК-матрица, содержащая тот участок ДНК, который требуется амплифицировать. · Два праймера, комплементарные концам требуемого фрагмента. · Термостабильная ДНК- · Дезоксинуклеотидтрифосфаты (dATP, dGTP, dCTP, dTTP). · Ионы Mg2+, необходимые для работы полимеразы. · Буферный раствор, обеспечивающий необходимые условия реакции — рН, ионную силу раствора. Содержит соли, бычий сывороточный альбумин Помимо простого увеличения числа копий ДНК (этот процесс называется амплификацией), ПЦР позволяет производить множество других манипуляций с генетическим материалом (введение мутаций, сращивание фрагментов ДНК) и широко используется в биологической и медицинской практике, например, для диагностики заболеваний (наследственных, инфекционных), для установления отцовства, для клонирования генов, выделения новых генов.
Рис. 9. Принцип полимеразной цепной реакции. Двухцепочечную ДНК-матрицу денатурируют (разделяют на отдельные цепи), и проводят отжиг с двумя праймерами. Праймеры присоединяются к противоположным цепям навстречу друг другу, определяя границы целевого амплифицируемого фрагмента. В процессе достройки праймеров происходит копирование участка ДНК, расположенного между двумя праймерами, и в результате количество матрицы удваивается. Цикл реакций денатурации матрицы, отжига и удлинения праймеров повторяется 25—30 раз. При избытке праймеров и других компонентов реакции после 25 циклов теоретически может получиться более 8 млн копий фрагмента.
ПЦР — очень быстрый, чувствительный и производительный метод. Его можно использовать для получения больших количеств специфических фрагментов ДНК, исходя из очень малых количеств исходного материала, причем не обязательно хорошо сохранившегося. Однако копирование с помощью ПЦР в целом менее точное, чем клонирование в клетках, потому что ДНК-полимеразы, используемые в этой процедуре, имеют склонность к ошибкам. Стандартный метод ПЦР пригоден для амплификации фрагментов длиной только до 5 тыс. п. н., в то время как специальные векторы для клонирования позволяют умножать фрагменты ДНК длиной несколько сотен тыс. п. н.
Рис. 10. Метод Саузерн-блоттинга. Сложную смесь молекул ДНК (кДНК, расщепленная геномная ДНК), содержащую интересующую последовательность, подвергают электрофоретическому разделению и переносят на мембрану капиллярным блоттингом. Для этого на поверхность геля помещают мембрану, затем сверху плотно прижимают несколько слоев фильтровальной бумаги, так что буфер, проходя через мембрану, одновременно переносит на нее ДНК. Обычно используют щелочной буфер, так что ДНК денатурирует на отдельные цепи. Иммобилизованную ДНК гибридизуют с меченым зондом, узнающим целевую последова-тельность. В результате детекции на мембране обнаруживают единственную полосу или набор полос, соответствующих только интересующим фрагментам ДНК. Гибридизация in situ позволяет определить, в каком сегменте хромосомы расположен соответствующий маркер. Флюоресцентная гибридизация in situ (FISH) позволяет одновременно картировать несколько различно окрашенных маркеров ДНК, а гибридизация в период интерфазы - определить порядок маркеров в отдельных участках хромосомы. С помощью этого метода удается надежно выявить хромосомные аномалии Препараты фиксированных хромосом гибридизуют (инкубируют при повышенной температуре с последующим охлаждением) с исследуемыми последовательностями нуклеотидов, меченными радиоактивной, флуоресцентной или иной меткой. После отмывания несвязавшейся метки оставшиеся меченые молекулы нуклеиновых кислот оказываются ассоциированными с участками хромосом, содержащими последовательности, комплементарные исследуемым меченым последовательностям нуклеотидов. Полученные гибриды анализируют с помощью микроскопа либо непосредственно, либо после авторадиографии. Для этой группы методов характерна более высокая разрешающая способность, чем для гибридизации соматических клеток, поскольку они позволяют локализовать изучаемые последовательности нуклеотидов на хромосомах.
Рис. 11
Обратная транскрипция Обратная транскрипция – процесс ферментативного синтеза ДНК на матрице РНК, который катализируется ферментом обратной транскриптазой (ревертаза, РНК-зависимая ДНК-полимераза). Обратная транскриптаза ретровирусов обладает тремя активностями: РНК-зависимая ДНК-полимеразная, ДНК-зависимая ДНК-полимеразная (обеспечивает синтез второй цепи ДНК), активность РНКазыН (гидролизует РНК в составе ДНК/РНК дуплексов). Реакцию обратной транскрипции применяют при создании кДНК библиотек – препаратов кДНК, полученных после обработки обратной транскриптазой тотальной РНК, выделенной из определенного организма, органа или ткани, с олиго(дТ) праймерами (комплементарны поли(А) хвосту мРНК). В результате получаются одноцепочечные ДНК-копии всех матричных РНК, по качественному составу и количеству которых можно судить об уровне экспрессии каких-либо генов. Кроме того, размер и первичная структура кДНК при сравнении с соответствующей последовательностью в геномной ДНК, позволяет выявить в ней некодирующие последовательности (интроны).
Полученную суммарную кДНК можно использовать в ПЦР со специфичными праймерами для получения целевого продукта, для получения библиотеки, клонирования-секвенирования и получения базы данных экспрессирующихся последовательностей – EST (expressed sequence tags), а также для исследования уровня экспрессии тех или иных генов. кДНК используется для техники микроэрреев или биочипов. Сравнение экспрессии генов в разных тканях (здоровых и раковых; на разных стадиях развития; и т.д.) позволяет выявлять различия в экспрессии тех или иных генов, проследить изменения профиля экспрессии генов на разных стадиях развития, выявить возможные мишени для дальнейшей разработки лекарств.
Рис. 14
Рис. 15. Электрофорез белков в полиакриамидном геле. Разделение по молекулярному весу. Изоэлектрическое фокусирование или изоэлектрофорез прменяется для разделения белков по их электрическому заряду. Аминокислоты содержат по меньшей мере две ионизируемые группы: карбоксильную группу с pK лежащим между 1,7 и 3, и α-аминогруппу с pK около 10. В растворе с pH между 4 и 9 аминокислоты существуют в виде цвиттер-иона, в котором и и амино- и карбоксильная группы ионизированы. Кроме этих двух групп в состав некоторых аминокислот входят и другие группы, способные к ионизации, как, например, еще одна NH2-, или еще одна COOH-, имидазол, ОН-, SH-группы и др. Например, при физиологическом значении pH ионизованы обе NH2- группы и COOH-группа лизина, что приводит к появлению небольшого положительного заряда молекулы. При том же pH аспарагиновая кислота имеет небольшой отрицательный заряд, вызванный диссоциацией двух карбоксильных групп. Как и аминокислоты, белковые молекулы в водных растворах заряжены, и величина заряда зависит от pH. Кислотность среды (pH), при которой определённая молекула или поверхность не несёт электрического заряда называется изоэлектрической точкой (pI). Растворимость амфотерных молекул, как правило, является минимальной при pH равной или близкой к изоэлектрической точке pI. Часто они в своей изоэлектрической точке выпадают в осадок. Этим свойством и пользуются при изоэлектрическом фокусировании. Изоэлектрофокусирование проводят в буфере, который содержит зоны с разным pH. Белок, который находится в рН-зоне ниже собственной изоэлектрической точки, будет положительно заряжен и будет перемещаться к катоду. Белок, находящийся выше своей изоэлектрической точки, будет заряжен отрицательно и будет двигаться к аноду. В результате перемещения заряд молекулы будет приближаться к нулю, а перемещение — замедляться. В конце концов белок войдет в зону рН равного его изоэлектрической точке и станет нейтральным, и больше двигаться в электрическом поле не будет. Таким образом, белки образуют четкие полосы, и каждый белок будет располагаться в градиенте значений рН в соответствии с изоэлетрической точкой. Изоэлектрическое фокусирование позволяет, в том числе, детектировать такие посттрансляционные изменения в структуре белка, которые изменяют заряд молекулы, такие как, например, фосфорилирование и гликозилирование. Возможно проведениедвумерного электрофореза,при котором белки сначала разделяют по изоэлектрическим точкам, а затем в перпендикулярном направлении по молекулярной массе с помощью электрофореза в акриламидном геле (Рис. 16).
Рис. 16. Изоэлектрическое фокусирование белков
Рис. 17. Двумерный электрофорез белков. Сначала проводится изоэлектрофокусирование, затем разделение по молекулярной массе в другом направлении.
Иммунодетекция белков Для детекции определенного белка в образце можно пользоваться методом, по своей логике аналогичным блоттингу нуклеиновых кислот — т. н. Вестерн-блоттингом. В основе этого метода лежит специфическое комплиментарное взаимодействие антиген-антитело.
Антитела (иммуноглобулины) — это особый класс гликопротеинов, присутствующих на поверхности В-клеток в виде мембраносвязанных рецепторов и всыворотке крови и тканевой жидкости в виде растворимых молекул. Они являются важнейшим фактором специфического гуморального иммунитета. Антитела используются иммунной системой для идентификации и нейтрализации чужеродных объектов — например, бактерий и вирусов.
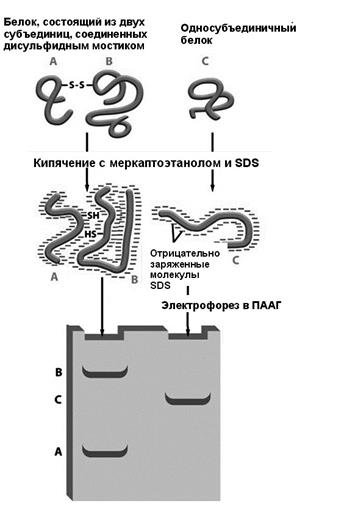
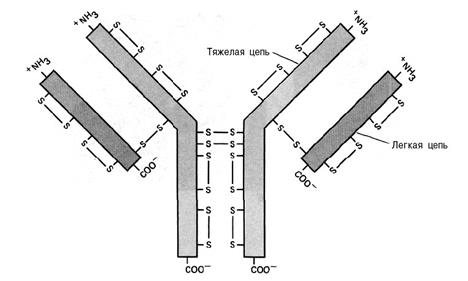
Рис. 18. Структура иммуноглобулина G. Иммуноглобулин состоит из четырех полипептидных цепей: двух идентичных легких и двух идентичных тяжелых. Структура стабилизируется с помощью дисульфидных связей, образующихся между двумя тяжелыми цепями и тяжелыми и легкими. В самих тяжелых и легких цепях также образуются дисульфидные связи.
Антитела синтезируются плазматическими клетками, которыми становятся В-лимфоциты в ответ на присутствие антигенов. Для каждого антигена формируются соответствующие ему специализировавшиеся плазматические клетки, вырабатывающие специфичные для этого антигена антитела. Антитела распознают антигены, связываясь с определённым эпитопом — характерным фрагментом поверхности или линейной аминокислотной цепи антигена. На первом этапе проведения Вестерн-блота белки разделяют электрофорезом в ПААГ. Затем переносят белки на нитроцеллюлозную мембрану, которая неспецифично связывает белки. Связывание белков основано как гидрофобных взаимодействиях, так и на электростатических взаимодействиях между мембраной и белком. Мембрана накладывается поверх геля, поверх мембраны кладут стопку фильтровальной бумаги. Всю стопку помещают в буфер для переноса, который продвигается верх по бумаге под действием капиллярных сил, уносит с собой белки. Другой метод переноса белков называется электроблоттингом и использует электрический ток, который переносит белки из геля на мембрану. Белки перемещаются из геля на мембрану с сохранением своего расположения. В результате этого «промакивания» (от. англ. blotting) белки удерживаются на тонком поверхностном слое мембраны для детекции. Затем нитроцеллюлозную мембрану обрабатывают раствором бычьего сывороточного альбумина или сухого молока. Белок из разбавленного раствора прикрепляется к мембране во всех местах, где не прикрепился целевой белок. Эта процедура исключает неспецифичное связывание антитела мембраной. Затем приливают раствор специфического антитела к целевому белку, после чего следует отмывка от несвязавшегося антитела. Специфические антитела получают иммунизацией животных очищенным целевым белком. Детекция возможна в одну или две стадии. Детекцию проводят в одну стадию, если антитело на целевой белок помечено каким-либо образом. Это может быть радиоактивная метка, или флюоресцентная метка, пришитая к антителу ковалентно. Существуют антитела, связанные с репортёрным ферментом, например, с щелочной фосфотазой или пероксидазой хрена. В этом случае блот выдерживается на подложке с соответствующим субстратом. Субстрат выбрают так, чтобы в результате взаимодействия с ферментом он изменял свой цвет. Как правило, однако, детекцию проводят в две стадии. В этом случае первичное антитело, специфически узнающее целевой белок, не детектируется. Меченым является вторичное антитело. Вторичное антитело представляет из себя антитело, распознающее видоспецифичные консервативные участки первичного антитела. Если, например, первичное антитело получали путем иммунизации мыши очищенным целевым белком, то вторичное антитело получают иммунизируя другое животное, например, козу, консервативным участком мышиного антитела. Такое антитело будет называться «anti-mouse” и будет специфически распознавать большинство любых мышиных антител. Двухступенчатая детекция позволяет иметь универсальные вторичные антитела для детекции любых первичных, полученных в данном животном, что удешевляет анализ. Кроме того, несколько вторичных антител могут связываться
Рис. 19. Общая схема Вестерн-блот анализа
Рис. 20. Общая схема метода секвенирования ДНК по методу Сэнгера. Исследуемая матрица амплифицируется отдельно в присутствии каждого из дидезоксинуклеотидтрифосфатов. В каждой пробирке образуется уникальный набор продуктов. Далее эти продукты разделяются электрофорезом с разрешением до одного нуклеотида. По длине фрагментов, образовавшихся в каждой пробирке, восстанавливают последовательность матрицы.
Микрочипы Одна из самых широко применяемых технологий, основанная на принципе гибридизации нуклеиновых кислот — использование ДНК-микрочипов. ДНК-микрочип (микроэррей) представляет из себя набор микроскопических фрагментов ДНК (зондов), иммобилизованных, как правило, ковалентно на твердой подложке. Это могут быть короткие участки ДНК как генов, так и любых других последовательностей ДНК, способные специфично гибридизоваться с исследуемой кДНК (мишенью). Степень гибридизации зонда с мишенью обычно оценивают по уровню флюоро- или хемилюминисценции метки, присоединенной к мишени. Сушествует два основных типа микрочипов: точечные микрочипы, получаемые нанесением фрагментов ДНК на покрытое гелем предметное стекло микроскопа, и олигонуклеотидные микрочипы высокой плотности, которые производят путем прямого синтеза олигонуклеотидов на стеклянной подложке. Поскольку на одном микрочипе обычно помещаются десятки тысяч зондов, можно одновременно оценивать экспрессию очень большого числа генов, что упрощает анализ.ДНК-микрочипы применяются для одновременного измерения уровня экспрессии большого числа генов, генотипирования, количественных оценок, детектирования ОНП, альтернативного сплайсинга и т.д. Предположим, перед нами стоит задача сравнить экспрессию генов в печени у здорового человека и больного. Для этого обычно применяют двухцветные (или двухканальные) микрочипы. Сначала необходимо выделить тотальную мРНК из печени здорового и больного. Затем по матрице этой РНК при помощи обратной транскриптазы получить кДНК, меченую флюорофорной меткой. Для это используют меченые аналоги нуклеозидтрифосфатов. Флюоресцентные краски, которые обычно применяют для мечения кДНК, имеют длину волны эмиссии флюоресценции в областях спектра, соответствующих красному или зеленому. Пометим кДНК, полученную от больного человека, например, красным флюорофором, а от здорового — зеленым. Полученную суммарную кДНК можно использовать в ПЦР со специфичными праймерами для получения целевого продукта, для получения библиотеки, клонирования-секвенирования и получения базы данных экспрессирующихся последовательностей – EST (expressed sequence tags), а также для исследования уровня экспрессии тех или иных генов. кДНК используется для техники микроэрреев или биочипов. Сравнение экспрессии генов в разных тканях (здоровых и раковых; на разных стадиях развития; и т.д.) позволяет выявлять различия в экспрессии тех или иных генов, проследить изменения профиля экспрессии генов на разных стадиях развития, выявить возможные мишени для дальнейшей разработки лекарств. Полученная смесь молекул кДНК отражает содержание транскриптов в исходной смеси мРНК: чем больше данной мРНК было в исходной смеси, тем больше ее кДНК-копий. На следующем этапе кДНК из двух образцов смешивают и гибридизуют с одним и тем же микрочипом. При этом индивидуальные олигонуклеотиды, закрепленные на подложке взаимодействуют со своими мишенями, находящимися в образце. После окончания процесса гибридизации чипы промываются для удаления остатков материала. В каждой ячейке микрочипа содержится примерно 106-107 копий фрагмента, что намного превышает число копий каждой специфической кДНК в исследуемом образце. В таких условиях происходит ненасыщающая гибридизация. Интенсивность сигнала в каждой ячейке пропорциональна содержанию данного типа кДНК. Микрочип сканируют на двух длинах волн эмиссии флюоресценции, соответствующих излучению каждого красителя. Затем с помощью компьютера результаты накладываются друг на друга и выводятся на экран в виде изображения микрочипа с окрашенными в разные цвета ячейками. Поскольку красным флюорофором мы метили кДНК больного человека, а зеленым — здорового, ячейки, которые окрашены только красным, соответсвуют РНК, присутствовавшей только у больного человека, те, которые окрашены только зеленым — только у здорового. В ячейках, где происходит наложение цветов (в нашем случае они будут желтого цвета), находятся зонды, соответствующие генам, которые экспрессируются и у здорового, и у больного человека. Темными остаются ячейки, с которыми не гибридизовалась никакая кДНК из исследуемых образцов. Можно проводить подобный анализ и на одноканальном микрочипе. Тогда оба набора кДНК метятся одним и тем же флюорофором, но гибридизуются с двумя копиями микрочипа отдельно. Плюс одноканального подхода в том, что каждый чип взаимодействует только с одним образцом. Это значит, что один плохо подготовленный образец не сможет повлиять на качество данных, полученных по другим образцам. Другой плюс одноканальной системы состоит в том, что данные, полученные с ее помощью в разных экспериментах, проще сравнивать между собой.
Рис. ДНК-микрочип. Сравнительный анализ уровней генной экспрессии. Сначала при помощи обратной транскрипции получают меченную флюорофорами кДНК. кДНК гибридизуют с микрочипом и отмывают от несвязавшихся молекул. Затем снимают флюоресценцию на соответсвующих длинах волн и обрабатывают полученные данные на компьютере. Объединенное изображение демонстрирует четыре типа сигналов: W - гены, экспрессирющиеся одинаково в двух образцах мРНК, X - гены, экспрессирующиеся сильнее в образце 1, Y - гены, экспрессирующиеся сильнее в образце 2, Z – гены, неэкспрессирующиеся ни в одном из образцов. Часть 2. Задачи
2. Что получится при электрофорезе смеси фрагментов ДНК: (T)150, (G≡C)150 и (T=A)150? 3. Будет ли этот фрагмент ДНК разрезаться рестриктазами EcoRI (5’-GAATCC), AluI (5’-AGCT), PstI (5’-CTGCAG)? Если да, то сколько фрагментов получится? Рис. 21
5. Линейный фрагмент ДНК обработали рестриктазами Hinс II, Ndel I и их смесью. Продукты реакции разделили в агарозном геле и окрасили бромистым этидием. Результаты электрофореза представлены на рис. 22. Цифры справа указывают на приблизительные размеры фрагментов в п.н. Постройте рестрикционную карту фрагмента.
Рис.22
6. На Рис. 23 представлены электрофореграммы исследования полиморфизма экзона 9 гена VDR-3 (ядерный рецептор витамина D) рестриктазой Taq I в контрольной выборке (дорожки 1-21) и у больных остеопорозом (22-42). Цифрами справа обозначены длины фрагментов ДНК в п.н. Составьте возможные варианты рестрикционной карты аллелей T (с одним сайтом рестрикции) и t (с двумя сайтами рестрикции), если исходная длина амплифицированного фрагмента экзона 9 составляет 745 п.н. и в нем есть два сайта для рестриктазы Taq I, один из которых полиморфный, а другой – нет. Определите частоту аллелей T и t в контрольной выборке и у больных.
Рис. 23 7. В кодирующей части гена CRR5 рецептора хемокинов встречается делеция 32 п. н. (CRR5de!32). Известно, что рецептор хемокинов CRR5 используется также вирусом иммунодефицита человека ВИЧ-1 для проникновения в клетки человека. Данная делеция приводит к дефекту рецептора, препятствует его взаимо-действию с вирусом и тем самым определяет устойчивость к ин-фекции ВИЧ-1 у гомозигот по присутствию делеции (CRR5del32/ CRR5del32). На электрофореграмме представлены результаты IIЦР-амплификации участка гена CRR5, затронутого этой делецией, у группы с высоким риском заражения ВИЧ-1. Определите дорож-ки, на которых представлены образцы людей, устойчивых к инфек-ции. Цифрами справа обозначены длины фрагментов ДНК в п. н.
8. В кодирующей части гена CRR5 рецептора хемокинов описаны две мутации, приводящие к дефекту рецептора CRR5: деления 32 п. н. (CRR5del32) и замена одного нуклеотида в положении 303 (CRR5m303), которая приводит к возникновению стоп-кодона и нарушению синтеза белка. Гомозиготы CRR5del32 / CRR5del32 и CRR5m303/C |
|||||||||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 2382; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.02 с.) |


 При постановке электрофореза можно определить размер (молекулярную массу) только линейной ДНК. Для этого в один из карманов геля наносят стандарт, в качестве которого используют специальные маркеры молекулярной массы (смесь фрагментов ДНК с известными значениями молекулярных масс – как правило, это ДНК известной плазмиды или фага, порезанная определенной рестриктазой, но это могут быть и искусственно синтезированные фрагменты).
При постановке электрофореза можно определить размер (молекулярную массу) только линейной ДНК. Для этого в один из карманов геля наносят стандарт, в качестве которого используют специальные маркеры молекулярной массы (смесь фрагментов ДНК с известными значениями молекулярных масс – как правило, это ДНК известной плазмиды или фага, порезанная определенной рестриктазой, но это могут быть и искусственно синтезированные фрагменты).




 Рис. 12
Рис. 12



 с одним первичным и усиливать сигнал.
с одним первичным и усиливать сигнал.
 1. Перед вами два примера мембранных липидов. Один характерен для бактерий и эукариот, другой – для архебактерий. Установите соответствие.
1. Перед вами два примера мембранных липидов. Один характерен для бактерий и эукариот, другой – для архебактерий. Установите соответствие.




