
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электрофоретическое разделение белков
Белки также можно разделять по их подвижности в электрическом поле. Однако, в отличие от молекул ДНК, полярность и величина заряда белковой молекулы при данном рН зависит от ее аминокислотного состава. Кроме того, электрофоретическая подвижность частицы определяется не только ее зарядом, но и ее размерами. Таким образом, скорость движения белка также зависит и от его пространственной укладки. В молекулярной биологии как правило используются две основных методики электрофореза белков: разделение по молекулярной массе и по изоэлектрической точке. Электрофорез белков проводится в полиакриламидном геле.
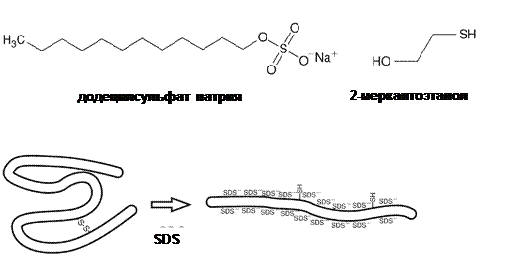
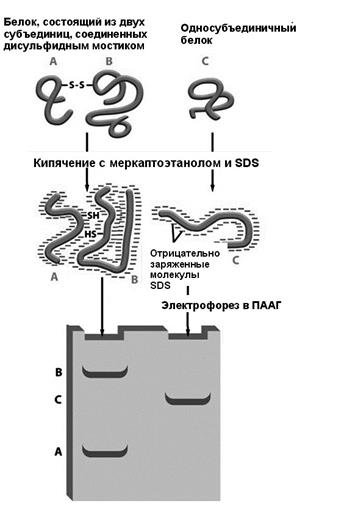
Разделение по молекулярной массе в полиакриламидном геле Для разделения белков по молекулярной массе необходимо денатурировать белок и сделать так, чтобы на каждое аминокислотное звено приходился одинаковый заряд. Для денатурауции перед нанесением на гель образцы белка кипятят в присутствии 2-меркаптоэтанола и додецилсульфата натрия (SDS). Под воздействием 2-меркаптоэтанола происходит восстановление дисульфидных связей. SDS является сильным детергентом, его молекула состоит из двенадцатичленной алифатической неразветвленной цепи и ковалентно связанного с ним сульфата, имеющего в растворе отрицательный заряд. Количество молекул SDS, связанных с полипептидом, пропорционально его длине, и, следовательно, молекулярной массе, собственный заряд полипептида несущественен в сравнении с зарядом связанного с ним SDS. В таких условиях, все полипептиды имеют одинаковый удельный заряд. Электрофоретическая подвижность белка в этом случае обратно пропорциональна его молекулярной массы. Для визуализации результатов электрофореза чаще всего используют окрашивание белков в гелях красителем Кумасси (Coomassie Blue) или серебросодержащие красители. Как и в случае электрофореза НК, молекулярную массу исследуемых белков можно примерно оценить по сравнению с электрофоретической подвижностью белка с заранее известной молекулярной массой, или маркера.
Рис. 14
Рис. 15. Электрофорез белков в полиакриамидном геле. Разделение по молекулярному весу. Изоэлектрическое фокусирование или изоэлектрофорез прменяется для разделения белков по их электрическому заряду.
Аминокислоты содержат по меньшей мере две ионизируемые группы: карбоксильную группу с pK лежащим между 1,7 и 3, и α-аминогруппу с pK около 10. В растворе с pH между 4 и 9 аминокислоты существуют в виде цвиттер-иона, в котором и и амино- и карбоксильная группы ионизированы. Кроме этих двух групп в состав некоторых аминокислот входят и другие группы, способные к ионизации, как, например, еще одна NH2-, или еще одна COOH-, имидазол, ОН-, SH-группы и др. Например, при физиологическом значении pH ионизованы обе NH2- группы и COOH-группа лизина, что приводит к появлению небольшого положительного заряда молекулы. При том же pH аспарагиновая кислота имеет небольшой отрицательный заряд, вызванный диссоциацией двух карбоксильных групп. Как и аминокислоты, белковые молекулы в водных растворах заряжены, и величина заряда зависит от pH. Кислотность среды (pH), при которой определённая молекула или поверхность не несёт электрического заряда называется изоэлектрической точкой (pI). Растворимость амфотерных молекул, как правило, является минимальной при pH равной или близкой к изоэлектрической точке pI. Часто они в своей изоэлектрической точке выпадают в осадок. Этим свойством и пользуются при изоэлектрическом фокусировании. Изоэлектрофокусирование проводят в буфере, который содержит зоны с разным pH. Белок, который находится в рН-зоне ниже собственной изоэлектрической точки, будет положительно заряжен и будет перемещаться к катоду. Белок, находящийся выше своей изоэлектрической точки, будет заряжен отрицательно и будет двигаться к аноду. В результате перемещения заряд молекулы будет приближаться к нулю, а перемещение — замедляться. В конце концов белок войдет в зону рН равного его изоэлектрической точке и станет нейтральным, и больше двигаться в электрическом поле не будет. Таким образом, белки образуют четкие полосы, и каждый белок будет располагаться в градиенте значений рН в соответствии с изоэлетрической точкой. Изоэлектрическое фокусирование позволяет, в том числе, детектировать такие посттрансляционные изменения в структуре белка, которые изменяют заряд молекулы, такие как, например, фосфорилирование и гликозилирование.
Возможно проведениедвумерного электрофореза,при котором белки сначала разделяют по изоэлектрическим точкам, а затем в перпендикулярном направлении по молекулярной массе с помощью электрофореза в акриламидном геле (Рис. 16).
Рис. 16. Изоэлектрическое фокусирование белков
Рис. 17. Двумерный электрофорез белков. Сначала проводится изоэлектрофокусирование, затем разделение по молекулярной массе в другом направлении.
Иммунодетекция белков Для детекции определенного белка в образце можно пользоваться методом, по своей логике аналогичным блоттингу нуклеиновых кислот — т. н. Вестерн-блоттингом. В основе этого метода лежит специфическое комплиментарное взаимодействие антиген-антитело.
Антитела (иммуноглобулины) — это особый класс гликопротеинов, присутствующих на поверхности В-клеток в виде мембраносвязанных рецепторов и всыворотке крови и тканевой жидкости в виде растворимых молекул. Они являются важнейшим фактором специфического гуморального иммунитета. Антитела используются иммунной системой для идентификации и нейтрализации чужеродных объектов — например, бактерий и вирусов.
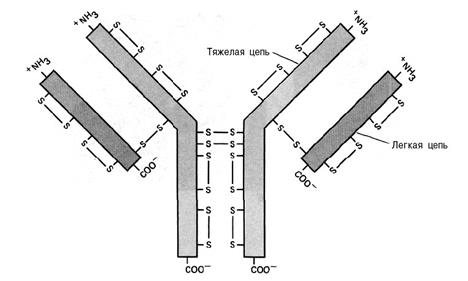
Рис. 18. Структура иммуноглобулина G. Иммуноглобулин состоит из четырех полипептидных цепей: двух идентичных легких и двух идентичных тяжелых. Структура стабилизируется с помощью дисульфидных связей, образующихся между двумя тяжелыми цепями и тяжелыми и легкими. В самих тяжелых и легких цепях также образуются дисульфидные связи.
Антитела синтезируются плазматическими клетками, которыми становятся В-лимфоциты в ответ на присутствие антигенов. Для каждого антигена формируются соответствующие ему специализировавшиеся плазматические клетки, вырабатывающие специфичные для этого антигена антитела. Антитела распознают антигены, связываясь с определённым эпитопом — характерным фрагментом поверхности или линейной аминокислотной цепи антигена. На первом этапе проведения Вестерн-блота белки разделяют электрофорезом в ПААГ. Затем переносят белки на нитроцеллюлозную мембрану, которая неспецифично связывает белки. Связывание белков основано как гидрофобных взаимодействиях, так и на электростатических взаимодействиях между мембраной и белком. Мембрана накладывается поверх геля, поверх мембраны кладут стопку фильтровальной бумаги. Всю стопку помещают в буфер для переноса, который продвигается верх по бумаге под действием капиллярных сил, уносит с собой белки. Другой метод переноса белков называется электроблоттингом и использует электрический ток, который переносит белки из геля на мембрану. Белки перемещаются из геля на мембрану с сохранением своего расположения. В результате этого «промакивания» (от. англ. blotting) белки удерживаются на тонком поверхностном слое мембраны для детекции. Затем нитроцеллюлозную мембрану обрабатывают раствором бычьего сывороточного альбумина или сухого молока. Белок из разбавленного раствора прикрепляется к мембране во всех местах, где не прикрепился целевой белок. Эта процедура исключает неспецифичное связывание антитела мембраной. Затем приливают раствор специфического антитела к целевому белку, после чего следует отмывка от несвязавшегося антитела. Специфические антитела получают иммунизацией животных очищенным целевым белком.
Детекция возможна в одну или две стадии. Детекцию проводят в одну стадию, если антитело на целевой белок помечено каким-либо образом. Это может быть радиоактивная метка, или флюоресцентная метка, пришитая к антителу ковалентно. Существуют антитела, связанные с репортёрным ферментом, например, с щелочной фосфотазой или пероксидазой хрена. В этом случае блот выдерживается на подложке с соответствующим субстратом. Субстрат выбрают так, чтобы в результате взаимодействия с ферментом он изменял свой цвет. Как правило, однако, детекцию проводят в две стадии. В этом случае первичное антитело, специфически узнающее целевой белок, не детектируется. Меченым является вторичное антитело. Вторичное антитело представляет из себя антитело, распознающее видоспецифичные консервативные участки первичного антитела. Если, например, первичное антитело получали путем иммунизации мыши очищенным целевым белком, то вторичное антитело получают иммунизируя другое животное, например, козу, консервативным участком мышиного антитела. Такое антитело будет называться «anti-mouse” и будет специфически распознавать большинство любых мышиных антител. Двухступенчатая детекция позволяет иметь универсальные вторичные антитела для детекции любых первичных, полученных в данном животном, что удешевляет анализ. Кроме того, несколько вторичных антител могут связываться
Рис. 19. Общая схема Вестерн-блот анализа
|
|||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 2367; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.141.202 (0.01 с.) |



 с одним первичным и усиливать сигнал.
с одним первичным и усиливать сигнал.


