Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Листья дурмана - Folia Stramonii
Дурман обыкновенный - Datura stramonium L. Семейство пасленовые – Solanaceae Химический состав. Алкалоиды - гиосциамин и скополамин. По ГФ XI требуется содержание их не менее 0,25%, а в плодах и семенах у дурмана индейского их содержится 0,2-0,5%. При содержании алкалоидов в листьях дурмана обыкновенного более 0,25% листья отпускают для приготовления препаратов соответственно в меньшем количестве. ЛС. Сигареты "Астматин". Масло дурманное. Применение. Противоспазматическое средство. Листья дурмана - основное сырье для препарата "Астматин", используются для курения при астме. Масло дурманное (0leum Stramonii). Прозрачная маслянистая жидкость от желтого до желто-зеленого цвета, своеобразного запаха. Применяется наружно для растираний при невралгиях, ревматизме. Входит в состав линиментов для растираний. Дурман обыкновенный. Однолетнее травянистое растение высотой до 1 (в некоторых источниках — до 1,5) м. Корень стержневой, ветвистый. Стебель толстый прямостоячий, гладкий вильчато-ветвистый, полый. Листья очередные, крупные, яйцевидные, длинночерешковые, выемчато-зубчатые, с заостренной вершиной, темно-зеленые. Цветки одиночные, верхушечные или пазушные, крупные, белые, пахучие, на коротких цветоножках. Цветет в июне — августе. Плод — крупная яйцевидная коробочка, густо покрытая неравными шипчиками, при созревании раскрывается на четыре створки. Семена матово-черные, сплюснуто-почковидные. Растение ядовито. Его запах слабый, наркотический, вкус солоновато-горький. Лекарственным сырьем служат листья, трава (верхушки) и семена. Листья и траву собирают во время цветения растения в перчатках. Листья этого растения содержат такие тропановые алкалоиды, как гиосциамин, скополамин и атропин. Их содержание должно составлять не менее 0,25 % от массы сухого лекарственного сырья. Для дурмана обыкновенного характерны общие фармакологические свойства атропиноподобных соединений, которые определяются в основном как м-холинолитические средства, блокирующие функциональную активность м-холинореактивных систем организма. В нативном виде дурман обыкновенный используют для приготовления комплексных растительных препаратов. Кроме более сильного, чем у атропина, холинолитического эффекта, гиосциамин оказывает выраженное бронхорасширяющее действие, тонизирует и возбуждает дыхательный центр.
Определение как у красавки: Количественное определение. Аналитическую пробу сырья измельчают до размера частиц, проходящих сквозь сито с отверстиями диаметром 1 мм. Около 10 г измельченного сырья помещают в колбу вместимостью 250 мл, приливают 150 мл эфира, 7 мл раствора аммиака и взбалтывают смесь в течение 1 ч. Эфирное извлечение быстро фильтруют через вату в колбу вместимостью 200 мл, прикрывая воронку часовым стеклом. К фильтрату приливают 5 мл воды, энергично взбалтывают и оставляют до просветления эфирного слоя, после чего отмеривают с помощью мерного цилиндра 90 мл эфирного извлечения в делительную воронку вместимостью 200 мл. Цилиндр дважды ополаскивают эфиром порциями по 10 мл, которые присоединяют к отмеренному эфирному извлечению. Из эфирного извлечения алкалоиды максимально извлекают 1% раствором хлористоводородной кислоты порциями по 20, 15, 10 мл (проба с реактивом Майера), каждый раз фильтруя через смоченный водой бумажный фильтр диаметром 5 см во вторую делительную воронку такой же вместимости. Фильтр промывают дважды 1% раствором хлористоводородной кислоты по 5 мл, присоединяя промывную жидкость к общему кислотному извлечению. Кислотное извлечение подщелачивают раствором аммиака до щелочной реакции по фенолфталеину и алкалоиды извлекают последовательно 20, 15, 10 мл хлороформа, взбалтывая по 3 мин. Хлороформные извлечения фильтруют в колбу для отгонки вместимостью 100 мл через бумажный фильтр, на который предварительно помещают 4-5 г свежепрокаленного безводного натрия сульфата, смоченного хлороформом. Фильтр дважды промывают хлороформом по 5 мл. Хлороформ отгоняют на водяной бане до объема 1-2 мл, остаток хлороформа в колбе удаляют продуванием воздуха до полного исчезновения запаха растворителя. Сухой остаток растворяют в 15 мл раствора хлористоводородной кислоты (0,02 моль/л) при подогревании на водяной бане, прибавляют 2 капли спиртового раствора метилового красного и 1 каплю раствора метиленового синего и избыток хлористоводородной кислоты оттитровывают раствором натра едкого (0,02 моль/л) до появления зеленой окраски.
Содержание суммы алкалоидов в пересчете на гиосциамин в абсолютно сухом сырье в процентах (X) вычисляют по формуле:
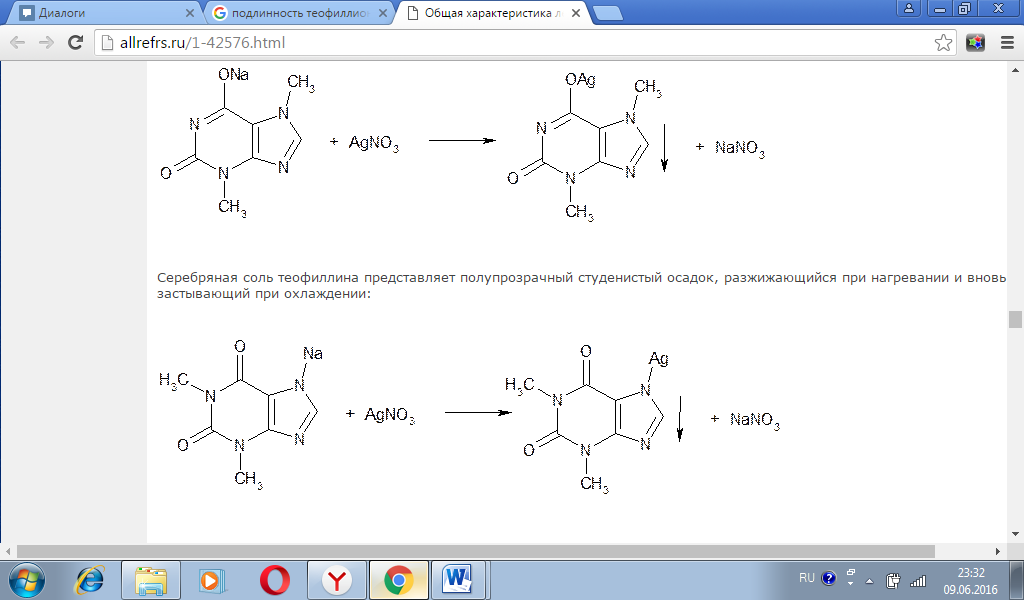
Билет 37. 1. Хранение ведется в соответствии с Приказом МЗСР РФ от 23.08.2010 №706н «Об утверждении правил хранения ЛС». Дибазол и теобромин должны храниться в металлических шкафах с замками(сейфы),т.к. относятся к сильнодействующим ЛВ. Камфора должна хранится в металлическом шкафу, т.к. относится к летучим ЛВ Ступку затереть дибазолом, т.к. инертное вещество и больше всего. В последнюю очередь добавляем камфору – как пахучее вещество. Свободная поверхностная энергия - это сумма неуравновешенных молекулярных сил, находящихся на поверхности данного вещества. Согласно 2-му закону термодинамики, всякое тело стремится к уменьшению свободной поверхностной энергии, поэтому тонко измельченные лекарственные вещества быстрее всасываются, растворяются, адсорбируют выделения кожи и т.д. Всасываемость порошка зависит от измельченности его частиц. Проверка доз Дибазол РД 0,03 ВРД 0,05 СД0,06 ВСД 0,15 Теобромин РД 0,15 ВРД 1,0 СД 0,3 ВСД 3,0 Дозы не завышены ППК обр ст Камфоры 0,05 *12=0,6 Бидазола 0,03*12=0,36 Теобромина 0,15 *12=1,8 M=0,6+0,36+1,8=2,76 0,23 №12 Лицевая сторона ППК – после изготовления. ППК Лицевая сторона Рецепт №37 Theobromini 1,8 Dibazoli 0,36 Camphorae 0.6 Mобщ2,76 M1 0,23 N12 Camphorae 0,6 Spiritus aethylici VI gtts Dibazoli 0,36 Theobromini 1,8 Масса общая 2,76 Приготовил Проверил Пергаментная бумага рекомендована для упаковки порошков с летучими и пахучими веществами Вопрос 2. Подлинность теофиллина, теобромина можно также установить по образованию из растворов их натриевых солей характерных осадков солей серебра. Кофеин, не обладающий кислотными свойствами, не дает положительных реакций ни с ионом кобальта, ни с ионом серебра. Соль теобромината серебра при нагревании на водяной бане до 60°C образует коричневую желатинообразную массу.
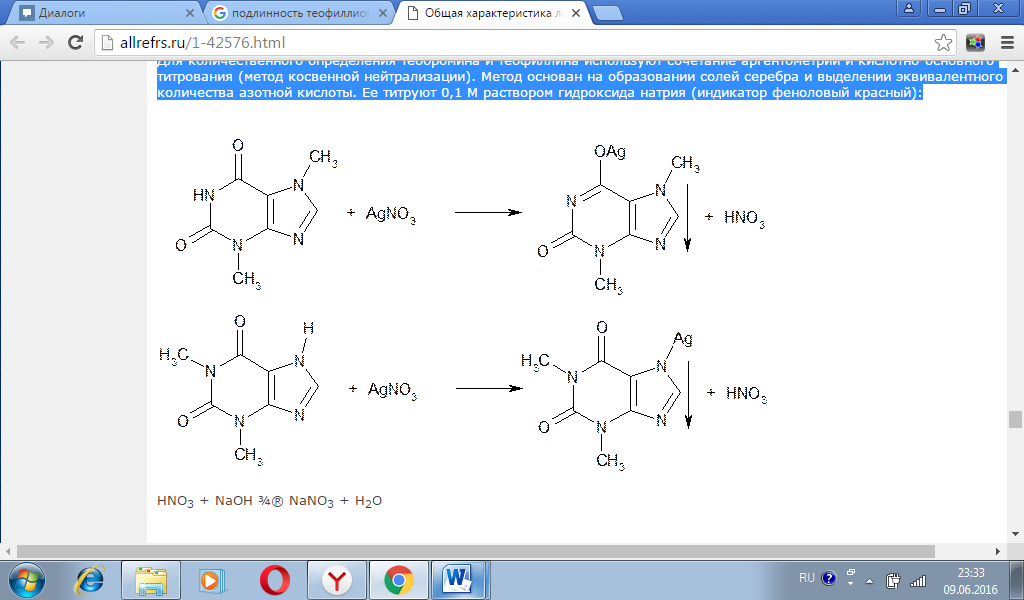
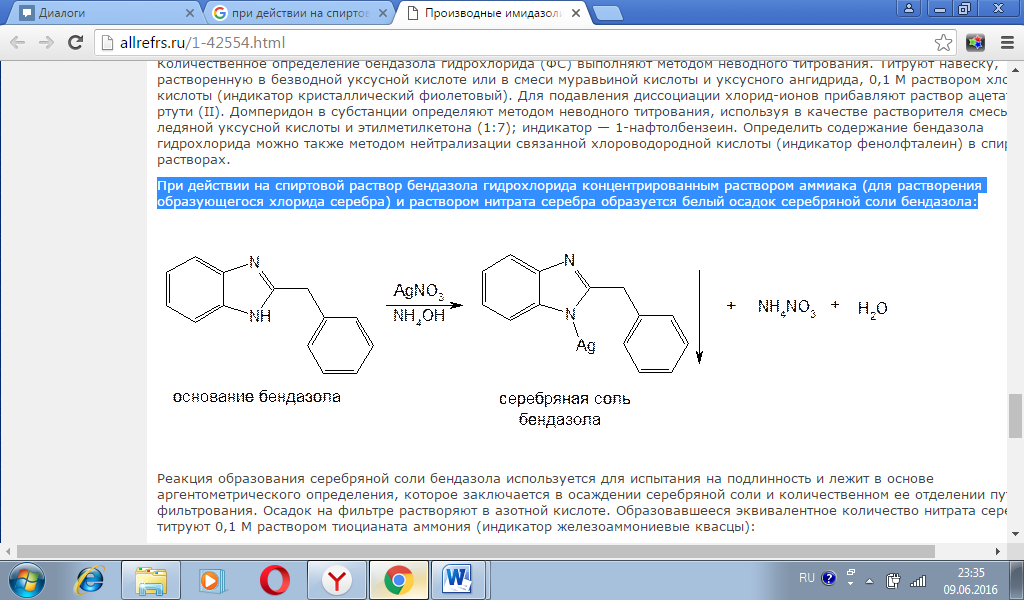
Для количественного определения теобромина и теофиллина используют сочетание аргентометрии и кислотно-основного титрования (метод косвенной нейтрализации). Метод основан на образовании солей серебра и выделении эквивалентного количества азотной кислоты. Ее титруют 0,1 М раствором гидроксида натрия (индикатор феноловый красный): Известны различные варианты такого определения. Один из них (прямой) основан на потенциометрическом титровании выделившейся кислоты, другой (обратный) — на определении избытка титрованного раствора нитрата серебра по Фольгарду. При действии на спиртовой раствор бендазола гидрохлорида концентрированным раствором аммиака (для растворения образующегося хлорида серебра) и раствором нитрата серебра образуется белый осадок серебряной соли бендазола:
Вопрос 3.
Раздел I. Характеристика готового продукта Таблетки белого или слегла желтоватого цвета, горьковатого вкуса. Применяются как болеутоляющее, жаропонижающее и противовоспалительное средство. Состав на таблетку: Анальгина 0,5 Крахмала 0,088 Талька 0,012 Средняя масса 0,6 Рабочая пропись производства 500 тыс. таблеток: Анальгина 250 кг Крахмала 44 кг Талька 6 кг Раздел II. Характеристика исходного сырья
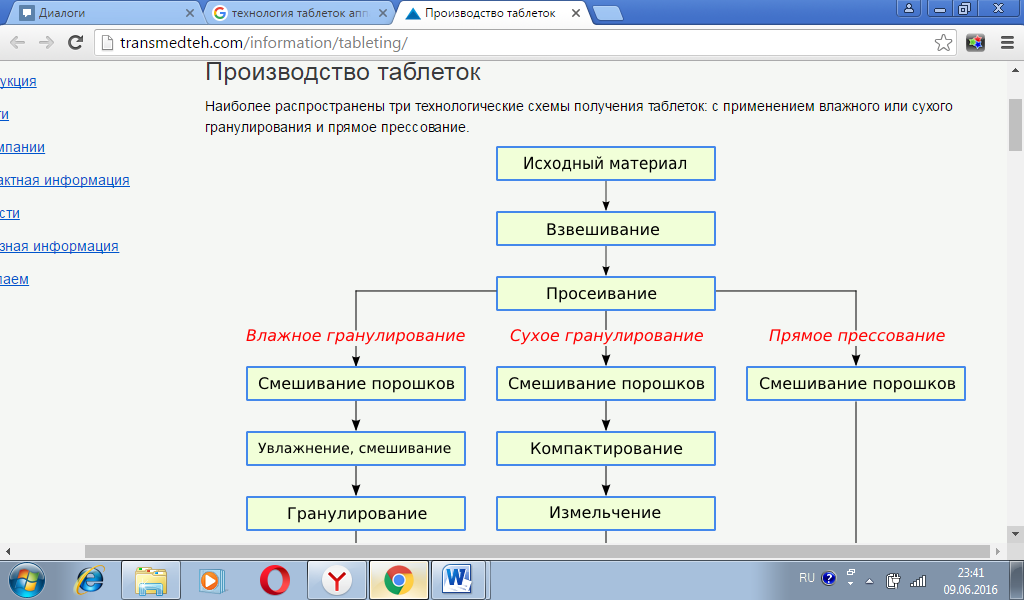
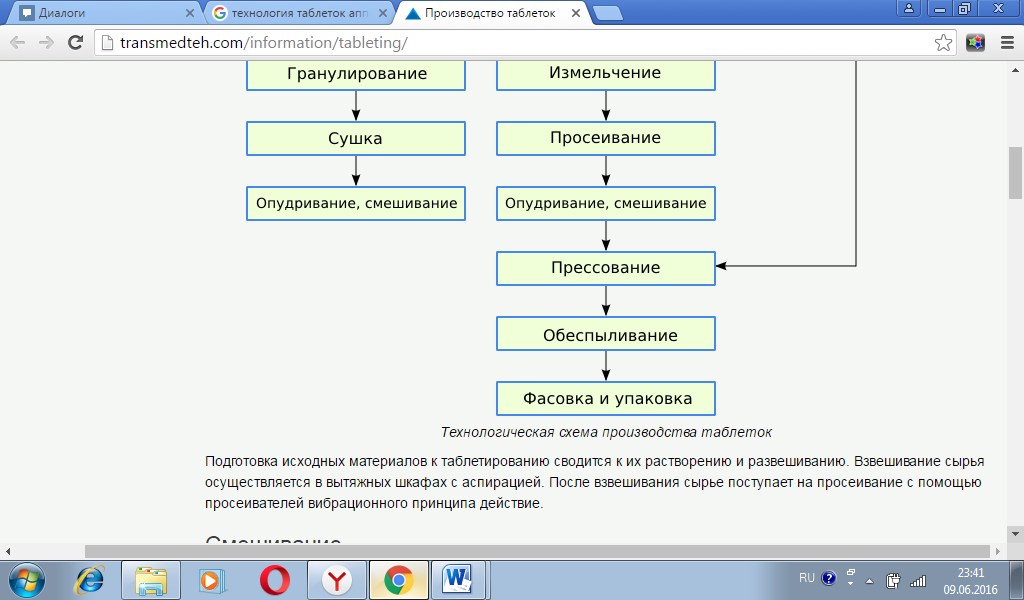
Анальгин – белый, крупноигольчатый кристаллический порошок без запаха, горьковатого вкуса. Крахмал – белый матовый, тонкий порошок, без запаха и вкуса. Тальк – белый аморфный порошок, без запаха и вкуса. Раздел III. Технологическая схема производства ТС-I Подготовка персонала ТО-1 Мед.осмотр ТО-2 Спец. одежда ТО-3 Дезинфекция рук ТС-II Подготовка помещения и оборудования ТО-1 Мойка технического инвентаря ТО-2 Уборка помещений ТС-III Подготовка исходного сырья ТО-1 Отвешивание ТО-2 Измельчение ТО-3 Просеивание ТС-IV Смешивание ТС-V Получение гранулята ТО-1 Гранулирование ТО-2 Сушка гранул ТО-3 Опудривание ТС-VI Прессование ТС-VII Контроль качества ТС-VIII Фасовка, упаковка
Раздел V. Спецификация аппаратуры и оборудования
Раздел VI. Описание стадий технологического процесса 1) Подготовка персонала. К работе допускаются только специально подготовленные люди, с фармацевтическим образованием. Перед входом в производственную зону персонал проходит ряд процедур. Во-первых, верхнюю одежду оставляет в гардеробной и одевает проходную спецодежду, во-вторых, проходит через санпропускник, где надевает другую одежду и обувь, предназначенную для работы в чистом производственной зоне, моет руки. После поведения технологического процесса все элементы одежды направляются на обработку (одноразовые элементы на утилизацию). Производственному персоналу запрещается принимать пищу, курить, а также хранить еду, курительные материалы и личные лекарственные средства в производственных помещениях завода и впомещениях хранения готовой продукции. В карманах халатов не должны находиться предметы личного пользования, кроме носового платка. Вход и выход в чистых помещениях, 2) Подготовка помещения и оборудования. Помещения должно быть оснащены всем необходимым оборудованием, машинами и аппаратами, которые находится в исправном состоянии. Подготовка воздуха и воды с использованием систем очистки и кондиционирования и средств их доставки к производственным участкам. Влажная уборка помещений с использованием специального оборудования и средств. После каждой смены производства таблеток необходимо проводить чистку технического инвентаря и уборку помещений цеха. После проведения технологического процесса все оборудование, производственная тара, помещения очищают от загрязнений, моют, дезинфицирую. 3) Подготовка исходного сырья. Исходное сырье распаковывают, просеивают и отвешивают необходимое количество. Затем сырье в специальной таре поступает на измельчение в шаровых мельницах, а затем просеивание на вращательно-вибрационном сите модели ВС-2. 4) Смешивание ингредиентов. Смешивание всех компонентов таблеток происходит в червячно-лопастном смесителе. 5) Получение гранулята. Из готовой смеси компонентов получают гранулы с помощью гранулятора модели 3027. После этого гранулы опудривают и высушивают одновременно в сушилке типа СП - 30. 6) Прессование, упаковка. Таблетирование происходит на роторно-таблеточной машине РТМ – 41. Таблетки анальгина покрывать оболочкой не требуется, поэтому готовые таблетки подаются на автомат для упаковки А1-АУ-4-Т. 7) Контроль качества. В процессе производства в обязательном порядке проводят забор проб гранулята, таблеток без оболочек, готовых таблеток. Упакованный готовый продукт отправляют на склад в зону карантина. Раздел VII. Отходы производства Отходов нет, но могут быть потери лекарственных и вспомогательных веществ в виде пыли при взвешивании, измельчении, просеивании и других технологических операциях.
Могут быть отходные ненужные материалы в виде упаковочной бумаги или фольги, которая направляется в цех утилизации отходов. Раздел VIII. Техника безопасности производства Таблетки готовят в специальных цехах при соблюдении инструкции по техническом безопасности, охране груда и противопожарным мероприятиям. Раздел IX. Общая схема контроля (методы анализа и контроль производства) Готовый продукт и исходное сырье анализируют: Анальгин по ГФ X стр. 94 Крахмал по ГФ X стр. 823 Таблетки анальгина по ГФ X стр. 95 Раздел X. Материальный баланс Вопрос 4. HERBA SERPYLLI ТРАВА ЧАБРЕЦАHERBA THYMI SERPYLL Собранная в фазу цветения, высушенная и обмолоченная трава тимьяна ползучего (чабреца) - Thymus serpyllum L., сем. яснотковых - Lamiaceae Внешние признаки. Смесь цельных или частично измельченных тонких веточек, листьев, кусочков стеблей толщиной до 0,5 см и цветков. Листья короткочерешковые, ланцетные, эллиптические или продолговато-эллиптические, цельнокрайние, длиной до 15 мм, голые или слабоопушенные с резко выступающими жилками на нижней стороне листа. Под лупой (10Х) по всей поверхности листа видны многочисленные буроватые точки (железки), у основания листа - длинные редкие щетинистые волоски. Кусочки веточек тонкие, четырехгранные, опушенные, зеленовато-коричневого или желтовато-бурого цвета, часто с фиолетовым оттенком. Химический состав. Трава содержит до до 1% эфирного масла, основным компонентом которого является тимол (до 30%). Кроме того, эфирное масло содержит карвакрол, n-цимол, y-терпинен, a-терпинеол, борнеол. В траве обнаружены также дубильные вещества, горечи, камедь, тритерпеновые соединения - урсоловая и олеаноловая кислоты, флавоноиды, большое количество минеральных солей. Стандартизация.ГФ ХI, вып. 2, ст. 60, Изменение № 1 от 16.06.1999 г. или ГОСТ 21816-89 (сырье используется и в пищевой промышленности). Вопрос 5. ТК РФ Приказ МЗиСР РФ от 12 апреля 2011 года № 302н «Об утверждении Перечней вредных и (или) опасных производственных факторов и работ, при выполнении которых проводятся предварительные и периодические медицинские осмотры (обследования), и Порядка проведения предварительных и периодических медицинских осмотров (обследований) работников, занятых на тяжёлых работах и работах с вредными и (или) опасными условиями труда». Федеральный закон от 28.12.2013 г. № 426-ФЗ «О специальной оценке условий труда» Федеральный закон Российской Федерации от 28 декабря 2013 г. N 421-ФЗ "О внесении изменений в отдельные законодательные акты Российской Федерации в связи с принятием Федерального закона "О специальной оценке условий труда" Федеральный закон от 17.07.1999 г №181-ФЗ "Об основах охраны труда в Российской Федерации" (с изменениями от 20.05.2002 г., 10.01.2003 г., 9.05. и 26.12.2005 г.) Охрана труда - система сохранения жизни и здоровья работников в процессе трудовой деятельности, включающая в себя правовые, социально-экономические, организационно-технические, санитарно-гигиенические, лечебно-профилактические, реабилитационные и иные мероприятия. Условия труда - совокупность факторов производственной среды и трудового процесса, оказывающих влияние на работоспособность и здоровье работника. Безопасные условия труда – условия труда, при которых воздействие на работающих вредных и опасных производственных факторов исключено либо уровни их воздействия не превышают установленных нормативов. (аттестация рабочих мест, ежегодные замеры различных факторов) Рабочее место – место, где работник должен находиться или куда ему необходимо прибыть в связи с его работой и которое прямо или косвенно находится под контролем работодателя. Приказом Министерства здравоохранения и социального развития Российской федерации от 16.08.2004 года №83 утверждён Перечень вредных и опасных производственных факторов и работ, при выполнении которых проводятся предварительные и периодические медицинские осмотры, и порядок проведения этих осмотров. Предварительные медицинские осмотры (при поступлении на работу) проводятся с целью определения соответствия состояния здоровья работника поручаемой ему работе. Периодические медицинские осмотры проводятся с целью • динамического наблюдения за состоянием здоровья работников, своевременного выявления начальных форм профзаболеваний, ранних признаков воздействия вредных и опасных производственных факторов на состояние здоровья работников • выявления общих заболеваний, являющихся медицинскими противопоказаниями для продолжения работы, связанной с воздействием вредных и опасных производственных факторов • своевременного проведения профилактических и реабилитационных мероприятий, направленных на сохранение здоровья и восстановление трудоспособности работников. Частота проведения периодических медосмотров определяется территориальными органами Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека совместно с работодателем, исходя из конкретной санитарно-гигиенической и эпидемиологической ситуации, но периодические медосмотры должны проводиться не реже, чем один раз в два года. Лица, не достигшие 21 года, проходят периодические медосмотры ежегодно! Предварительные и периодические медосмотры проводятся медицинскими организациями, имеющими лицензию на данный вид деятельности. Работникам, занятым на вредных работах и на работах с вредными и опасными производственными факторами в течение 5-ти и более лет,периодические медицинские осмотры проводятся в центрах профпатологии и других медицинских организациях, имеющих лицензию на экспертизу профпригодности и экспертизу связи заболевания с профессией один раз в пять лет. Работодатель определяет контингент и составляет поимённый список лиц, подлежащим периодическим медосмотрам с указанием вредных работ и опасных производственных факторов. И после согласования с территориальными органами Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека направляет его за два месяца до начала осмотра в медицинскую организацию, с которой заключён договор на проведение медосмотров. Медицинская организация на основании полученного от работодателя поимённого списка работников, утверждает совместно с работодателем календарный план проведения медосмотров. Медицинская организация совместно с территориальными органами Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека и представителем работодателя обобщает результаты медосмотра и составляет заключительный акт в 4-ёх экземплярах. Акт в течение 30-ти дней должен быть представлен медицинской организацией работодателю, территориальному органу Роспотребнадзора и центру профпатологии. Центр профпатологии при установлении связи заболевания с профессией составляет медицинское заключение и в 3-хдневный срок направляет его в территориальный орган Роспотребнадзора, работодателю, страховщику и в медицинскую организацию, направившую работника. Работник, у которого установлен диагноз профзаболевания, центром профпатологии направляется в медицинскую организацию по месту жительства, которая оформляет документы для представления на медико-социальную экспертизу. Вопрос 6. ПРИКАЗ Минздрава РФ от 21.10.97 г №309 Об утверждении инструкции по санитарному режиму аптечных организаций (аптек) Генеральная уборка производственных помещений должна проводиться не реже одного раза в неделю. Моют стены, двери, оборудование, полы. Потолки очищают от пыли влажными тряпками 1 раз в месяц. Оконные стекла, рамы и пространство между ними моют горячей водой с мылом или другими моющими средствами не реже одного раза в месяц. Уборочный инвентарь должен быть промаркирован и использован строго по назначению. Хранение его осуществляют в специально выделенном месте (комната, шкафы) раздельно. Ветошь, предназначенная для уборки производственного оборудования, после дезинфекции и сушки хранят в чистой, промаркированной, плотно закрытой таре (банка, кастрюля и др.). Уборочный инвентарь для асептического блока хранят отдельно. Отходы производства и мусор должны собираться в специальные контейнеры с приводной крышкой с удалением из помещения не реже 1 раза в смену. Раковины для мытья рук, санитарные узлы и контейнеры для мусора моют, чистят и дезинфицируют ежедневно. Санитарный день в аптеках проводят 1 раз в месяц (одновременно, кроме тщательной уборки, можно проводить мелкий текущий ремонт). Перед началом работы необходимо провести влажную уборку помещений (полов и оборудования) с применением дезсредств. ЗАПРЕЩАЕТСЯ сухая уборка помещений.
БИЛЕТ №38 1. Плазмозамещающие и дезинтоксикационные растворы Плазмозамещающие и дезинтоксикационные растворы применяют для восстановления объема циркулирующей крови при острой кровопотере, шоке различной этиологии, нарушении микроциркуляции, интоксикациях и т.д.Следует отметить, что их можно использовать как кровезаменители, но функциями крови они не обладают, так как не содержат ее форменных элементов. Классификация Эту группу ЛС можно подразделить: на гемодинамические растворы, т.е. средства, предназначенные для лечения и профилактики шока, нормализации ypoвня артериального давления ит.д.; регуляторы водно-солевого баланса (кристаллоиды), т.е. ЛС, предназначенные для нормализации электролитного баланса и устранения дегидратации (от лат. de - удаление, устранение; греч.hydos - вода; син.: обезвоживание); дезинтоксикационные растворы, т.е. средства, предназначенные для лечения различных интоксикаций, например, при ожоговой болезни или тяжелой интоксикации, вызванной патогенными микроорганизмами. Производство должно вестись в асептических условиях, класс чистоты А Хранение в соответствии с Приказом МЗРФ № 706н Приказ №706н вводит понятие «карантинной зоны» Ст.12. При выявлении лекарственных средств с истекшим сроком годности они должны храниться отдельно от других групп лекарственных средств в специально выделенной и обозначенной (карантинной) зоне. Ст. 11. В организациях и у индивидуальных предпринимателей необходимо вести учет лекарственных средств с ограниченным сроком годности на бумажном носителе или в электронном виде с архивацией. Контроль за своевременной реализацией лекарственных средств с ограниченным сроком годности должен осуществляться с использованием компьютерных технологий, стеллажных карт с указанием наименования лекарственного средства, серии, срока годности либо журналов учета сроков годности. Порядок ведения учета указанных лекарственных средств устанавливается руководителем организации или индивидуальным предпринимателем. Уничтожение лекарственных средств (Федеральный закон от 12.04.2010 N 61-ФЗ (ред. от 12.03.2014) "Об обращении лекарственных средств") Статья 59. Основания и порядок уничтожения лекарственных средств
1. Недоброкачественные лекарственные средства, фальсифицированные лекарственные средства подлежат изъятию из гражданского оборота и уничтожению в порядке, установленном Правительством Российской Федерации. Основанием для уничтожения лекарственных средств является решение владельца лекарственных средств, решение соответствующего уполномоченного федерального органа исполнительной власти или решение суда.
2. Контрафактные лекарственные средства подлежат изъятию из гражданского оборота и уничтожению по решению суда. Порядок уничтожения контрафактных лекарственных средств устанавливается Правительством Российской Федерации.
3. Расходы, связанные с уничтожением контрафактных лекарственных средств, недоброкачественных лекарственных средств, фальсифицированных лекарственных средств, возмещаются их владельцем.
4. Владелец лекарственных средств должен представить в уполномоченный федеральный орган исполнительной власти документ или заверенную в установленном порядке его копию, подтверждающие факт уничтожения лекарственных средств.
5. Соответствующий уполномоченный федеральный орган исполнительной власти, принявший решение об уничтожении лекарственных средств, осуществляет контроль за их уничтожением.
6. Уничтожение лекарственных средств производится организациями, имеющими соответствующую лицензию, на специально оборудованных площадках, полигонах и в специально оборудованных помещениях с соблюдением требований в области охраны окружающей среды в соответствии с законодательством Российской Федерации.
7. Наркотические лекарственные средства, психотропные лекарственные средства, радиофармацевтические лекарственные средства уничтожаются в соответствии с законодательством Российской Федерации. Отпуск ЛФ в ЛПУ регламентируется Приказ Минздравсоцразвития России от 12.02.2007 N 110 (ред. от 26.02.2013) "О порядке назначения и выписывания лекарственных препаратов, изделий медицинского назначения и специализированных продуктов лечебного питания" Для обеспечения лечебно-диагностического процесса медицинские организации получают лекарственные препараты из аптечной организации по требованиям-накладным, утвержденным в установленном порядке. (в ред. Приказа Минздравсоцразвития России от 20.01.2011 N 13н) (см. текст в предыдущей редакции) Требование-накладная на получение из аптечных организаций лекарственных препаратов должна иметь штамп, круглую печать медицинской организации, подпись ее руководителя или его заместителя по лечебной части. (в ред. Приказа Минздравсоцразвития России от 20.01.2011 N 13н) (см. текст в предыдущей редакции) В требовании-накладной указывается номер, дата составления документа, отправитель и получатель лекарственного препарата, наименование лекарственного препарата (с указанием дозировки, формы выпуска (таблетки, ампулы, мази, суппозитории и т.п.), вид упаковки (коробки, флаконы, тубы и т.п.), способ применения (для инъекций, для наружного применения, приема внутрь, глазные капли и т.п.), количество затребованных лекарственных препаратов, количество и стоимость отпущенных лекарственных препаратов. (в ред. Приказа Минздравсоцразвития России от 20.01.2011 N 13н) (см. текст в предыдущей редакции) Наименования лекарственных препаратов пишутся на латинском языке. (в ред. Приказа Минздравсоцразвития России от 20.01.2011 N 13н) (см. текст в предыдущей редакции) Требования-накладные на лекарственные средства, подлежащие предметно-количественному учету, выписываются на отдельных бланках требований-накладных для каждой группы препаратов. Медицинские организации при составлении заявок на наркотические средства и психотропные вещества списков II и III должны руководствоваться расчетными нормативами, утвержденными в установленном порядке. (в ред. Приказа Минздравсоцразвития России от 20.01.2011 N 13н) 2-3Приготовление инфузионного раствора Рингера- Локка 10л. Приготовление начинается с подготовки воды и ЛП. После приготовления 2х растворов должен производится химический контроль, затем стерилизация. После стерилизации осуществляют контроль на механические включения и химический контроль. Согласно приказу № 214 при внутриаптечном контроле стерильные растворы считаются забракованными, если их качество не соответствует требованиям действующих нормативных документов по показателям: Внешний вид,Прозрачность,Цветность,Величина pH,Подлинность Количественное содержание входящих в-в Наличие видимых механических включений Недопустимым отклонениям от номинального объема раствора Нарушению фиксированности укупорки, нарушению действующих требований к оформлению ЛС, предназначенных к отпуску. Лицевая сторона ППК Дата рецепт Aq. Pro injectionibus ad 5000 ml Aq. Pro injectionibus ad 5000 ml Natrii chloridi 90,0 Natrii hydrocarbonati 2,0 Kalii chloridi 2,0 V= 5000 ml Calcii chloridi 2,0 приготовил Glucosi 11,0 проверил V=5000 ml отпустил Приготовил Проверил Требования, предъявляемые к инъекционным лекарственным формам. 1. Стерильность - отсутствие жизнеспособных микроорганизмов и их спор. 2. Апирогенность - отсутствие продуктов жизнедеятельности и распада микроорганизмов. 3. Стабильность - неизменяемость по составу и количеству находящихся в растворе ЛВ в течение установленных сроков хранения 4. Отсутствие механических включении - прозрачность инъекционного раствора (или отсутствие каких-либо взвешенных частиц) Обеспечить эти требования должен весь технологический процесс (помещения, технологическое оборудование, упаковка, система вентиляции, транспортные системы ввода сырья и вывода готового продукта, обслуживающий персонал). Выработаны специальные условия выполнения стадий и операций технологического процесса для соответствия готового раствора требуемым стандартам. Повышенные требования предъявляются к следующим объектам: 1) производственным помещениям; 2) технологическому оборудованию; 3) системам подготовки основных и вспомогательных материалов; 4) вентиляции; 5) обслуживающему персоналу. GMP (правила надлежащего производства) - это единая система требований по организации производства и контролю качества ЛС от начала переработки сырья до производства готовых продуктов, включая общие требования к помещениям, оборудования и персоналу. Согласно данному документу все помещения для производства лекарств в асептических условиях делятся на 4 класса в зависимости от чистоты воздуха. 1-й класс чистоты достигается установкой в помещении 2-го класса "чистых" камер с подачей ламинарного потока чистого стерильного воздуха. В помещениях 1-го класса выполняются наиболее ответственные технологические операции: выгрузка стерильных флаконов, пробок, колпачков, разлив стерильного раствора, фасовка стерильных порошков, предукупорка и укупорка флаконов пробками, сборка стерилизующих фильтров, отбор проб. 2-й и 3-й классы чистоты обеспечиваются за счет технологических и санитарных мероприятий, стерильной приточной вентиляции, рециркуляционных очистителей воздуха, увеличением кратности воздухообмена, специальной подготовки помещений и персонала. В помещениях 2-го касса чистоты производится изготовление растворов, фильтрование, мойка ампул и флаконов, их сушка и стерилизация. Помещения 3-го класса используются для мойки и стерилизации вспомогательного материала. В помещениях 4-го класса осуществляется мойка дрота, выделка ампул и т.д. Производство ЛП регламентировано ФЗ от 12.04.2010 № 61-ФЗ «Об обращении ЛС» Основные требования GMP к производству инъекционных лекарственных форм заключаются в следующем: ♦ в работе участвуют минимальное количество людей ♦ активность человека должна быть сведена к минимуму, чтобы избежать изменения перемещения частиц и микроорганизмов; ♦ одежда должна соответствовать процессу и рабочему месту и предохранять продукт от загрязнения; ♦ исходный материал не должен быть обсеменен микроорганизмами и пирогенными веществами; ♦ хранение воды, используемой для изготовления инъекционных растворов, осуществляется при постоянной циркуляции и температуре выше 80 °С; ♦ предохранение лекарственной формы перед стерилизацией для предупреждения кантаминации (повторного обсеменения) микроорганизмами; ♦ интервал между изготовлением и стерилизацией должен быть минимальным; ♦ каждый цикл стерилизации контролируется биологическими и химическими способами; ♦ пробы раствора, взятые на анализ для определения стерильности, должны включать пробы в начале и в конце работы, пробы после значительного перерыва в работе и пробы из потенциально наиболее холодной части загрузки автоклава, ♦ на пирогенность контролируется вода, промежуточные и конечные продукты, ♦ помещения должны иметь многоступенчатую систему приточно-вытяжной вентиляции, ♦ между помещениями различных классов чистоты должна поддерживаться разность давления, причем давление в помещениях более высокого класса чистоты должно быть выше; ♦ ответственные операции должны быть защищены установками ламинарного потока стерильного воздуха (движение параллельных потоков стерильного воздуха внутри ограниченного пространства); ♦ санитарно-бытовые помещения должны примыкать к производственным; ♦ вход персонала и передача материала в производственные помещения должны осуществляться через воздухошлюзы ♦ для облегчения уборки и обработки дез. растворами сопряжения между стенами, полом и потолком должны быть закругленной формы; ♦ между помещениями различных классов чистота должны быть переговорные устройства; ♦ запрещается применение фильтров, выделяющих волокна и др. GMP ВОЗ «чистые» зоны для производства стерильной продукции классифицирует в соответствии с требуемыми характеристиками воздуха на классы чистоты А, В, С и D. Система классификации воздуха при производстве стерильной продукции (GMP ВОЗ)
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-08; просмотров: 1211; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.216.229 (0.198 с.) |