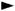Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Метод стационарных концентраций
Стационарным считается такой режим, при котором параметры в каждой точке системы в заданный промежуток времени сохраняются постоянными. Так как скорость химического процесса существенно зависит от концентраций промежуточных веществ, то при стационарном режиме ее протекания концентрации промежуточных соединений должны оста-ваться постоянными. Таким образом, стационарность протекания хими-ческой реакции означает стационарность концентраций промежуточных соединений, которые должны успевать многократно возникнуть и раз-ложиться в ходе химической реакции, уступая место другим промежу-точным соединениям. Тогда условие стационарности можно выразить следующим образом [23]: dqi =0.
dt
Выполнение условия стационарности означает, что алгебраическая сумма скоростей образования и расходования каждого из промежуточ-ных соединений равна нулю. Для реализации стационарного режима необходимо сохранение постоянства внешних параметров режима, а для гетерогенных каталитических реакций – и постоянство каталитической активности катализатора. Сформулируем алгоритм построения кинетической модели гетеро-генной химической реакции методом стационарных концентраций:
1. Записывается механизм гетерогенной химической реакции в виде совокупности элементарных стадий. 2. Записываются выражения скоростей реакций элементарных стадий на основании закона действующих поверхностей. 3. Записывается условие стационарности по промежуточным соеди-нениям.
4. Решается полученная система алгебраических уравнений и опреде-ляются выражения для концентраций промежуточных соединений. 5. Записывается выражение скорости гетерогенной химической реак-ции по любой стадии.
Пример. Составить выражение скорости для гетерогенной химиче- ской реакции. Механизм химической реакции:
А =В
Скорости элементарных реакций:
W 1= r 1- r -1;
W 2= r 2- r -2.
Запишем выражения для скоростей элементарных стадий по закону действующих поверхностей:
r 1= k 1× CA ×× qz, r 2= k 2× qzA;
r -1= k -1× qzA, r -2= k -2× CB × qz.
Условие стационарности:
Используя уравнение нормировки
qz + qzA = 1,
преобразуем систему уравнений (2.80) к следующему виду:
- k 1 C Aqz + k -1 q zA + k 2 q zA - k -2 CBqz =0;
q zA (k -1+ k 2)= qz (k 1 C A + k -2 CB);
Так как реакция обратимая, находим выражение скорости r –2:
В результате преобразований получим
Подставим полученное выражение в r–2:
Если в механизме есть хоть одна необратимая стадия, то весь про-цесс становится необратимым.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-08; просмотров: 507; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.240.21 (0.011 с.) |