
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расчет константы гидролиза, степени гидролиза и рН растворов гидролизующихся солейСодержание книги
Поиск на нашем сайте Динамическое равновесие в водных растворах гидролизующихся солей подчиняется закону действующих масс и может быть охарактеризовано константой гидролиза (Кгидр). Константой гидролиза называется отношение произведения концентраций продуктов гидролиза к концентрации непрогидролизовавшихся ионов соли. Другой количественной характеристикой процесса гидролиза соли является степень гидролиза (hгидр). Степень гидролиза показывает, какая часть от общего количества соли прогидролизована:
Для каждого из трех случаев гидролиза выведем уравнения, позволяющие вычислить константу гидролиза – Кгидр, степень гидролиза - hгидр, концентрацию ионов водорода – [Н+], водородный показатель – рН. Для вывода формул в общем виде будем считать, что KtAn – соль, подвергающаяся гидролизу, бинарный электролит, Ссоли (моль/л) – ее концентрация, KtOH – основание, образующееся в результате гидролиза, КKtOH – константа ионизации этого основания, HАn – кислота, образующаяся при гидролизе, КHАn – константа ионизации этой кислоты, hгидр – степень гидролиза, рК - силовой показатель (рК = - lgК), Кгидр – константа гидролиза. а) Гидролиз по катиону Пусть KtAn – соль, гидролизующаяся по катиону, Ссоли (моль/л) – ее концентрация, КKtOH – константа диссоциации образующегося при гидролизе слабого электролита. 1. Константа гидролиза – Кгидр. Запишем в общем виде ионное уравнение обратимой реакции гидролиза: Kt+ + H2O Û KtOH + H+, константа равновесия этой реакции:
Образующийся при гидролизе слабый электролит KtOH ионизирует по уравнению: KtOH Û Kt+ + OH- и константа его ионизации запишется: Выразим константу гидролиза через константу ионизации КKtOH. Для этого можно использовать искусственный прием, числитель и знаменатель выражения (IV.1) умножим на величину [ОН-]:
а затем полученное выражение (IV.3) преобразуем, подставив в него значение константы ионизации (IV.2) и ионное произведение воды Кw = [Н+]·[ОН-]:
Константа гидролиза соли, образованной катионом слабого основания и анионом сильной кислоты, равна отношению ионного произведения воды к константе ионизации слабого основания, образующегося в процессе гидролиза. 2. Степень гидролиза - hгидр.
где Сгидр – концентрация прогидролизовавшейся соли, Ссоли – исходная концентрация соли (моль/л). Чтобы вычислить степень гидролиза, подставим в уравнение константы гидролиза (IV.1) значения [KtOH], [Н+] и [Kt+]. Концентрация образующегося основания [KtOH] равна концентрации ионов водорода [Н+] и концентрации прогидролизовавшейся части соли, т.е. [KtOH] = [Н+] = Сгидр = h·Ссоли, тогда концентрация непрогидролизовавшейся соли равна разности Ссоли - Ссоли·h = Ссоли(1- h). Подставляя полученные значения в уравнение константы гидролиза (IV.1) и преобразуя его, получим:
или, если пренебречь величиной в знаменателе, т.к. h << 1, то можно записать:
Степень гидролиза солей по катиону равно корню квадратному из отношения ионного произведения воды к константе ионизации основания, образующегося при гидролизе, и концентрации соли. Пользоваться приближенной формулой (IV.7) для вычисления степени гидролиза можно только для сравнительно слабо гидролизующихся соединений. Для всех остальных необходимо вести расчеты по формуле (IV.6). 3. Концентрация ионов водорода [Н+], рН раствора. Для обратимой реакции гидролиза по катиону: Kt+ + H2O Û KtOH + H+ запишем уравнение константы гидролиза:
Из уравнения реакции видно, что [KtOH] = [H+], а равновесная концентрация непрогидролизовавшихся катионов равна разности исходной концентрации соли (Ссоли) и ее прогидролизовавшейся части (Ссоли·h), т.е. [Kt+] = Ссоли - Ссоли·h = Ссоли, т.к. h << 1 для сравнительно слабо гидролизующихся солей. Подставив найденные значения в выражение для Кгидр, получим:
или подставив значение Кгидр для солей этого типа, получим выражение для вычисления концентрации ионов водорода:
Концентрация ионов водорода в растворах солей, гидролизующихся по катиону, равна корню квадратному из отношения произведения концентрации соли и ионного произведения воды к константе ионизации слабого основания, образующегося при гидролизе. По формуле (IV.10) можно проводить вычисления концентрации ионов водорода для солей, гидролизующихся по катиону. Для вычисления рН полученное выражение (IV.10) прологарифмируем и поменяем знаки на противоположные, т.к. рН = - lg[Н+]:
т.к. при 25оС Kw = 10-14, то
Зная рН и [Н+], при необходимости можно вычислить рОН и [ОН-] из соотношений: рОН = рКw – рН; рОН = 14 – рН, а Примеры расчетов даны в §10. Решение типовых задач.
б) Гидролиз по аниону Вывод формул для вычисления константы гидролиза - Кгидр, степени гидролиза - hгидр, концентрации ионов гидроксила - [ОН-], концентрации ионов водорода - [Н+] и рН можно осуществить аналогично случаю гидролиза по катиону, рассмотренному выше: An- + H2O Û HAn + OH-
1. Константа гидролиза по аниону - Кгидр:
НAn Û H+ + An-;
Константа гидролиза соли, образованной катионом сильного основания и анионом слабой кислоты (гидролиз по аниону), равна отношению ионного произведения воды к константе ионизации слабой кислоты, образующейся в результате гидролиза. 2. Концентрация ионов водорода [Н+] и рН. Для вычисления концентрации ионов водорода из выражения для константы гидролиза выведем формулу для расчета концентрации ионов гидроксила [ОН-] и подставим ее в выражение:
Запишем константу гидролиза соли KtAn по аниону:
Равновесная концентрация образующегося электролита [НAn] и концентрация прогидролизовавшейся части соли равны концентрации ионов гидроксила: [НAn] = Сгидр = [ОН-], а равновесная концентрация анионов соли, оставшихся непрогидролизовавшимися, равна: [An-] = Ссоли - Сгидр = Ссоли - [ОН-]. Подставив значение [НAn] и [An-] в выражение константы гидролиза (IV.13), получаем:
Для слабогидролизующихся солей с достаточной для практических расчетов степенью точности можно пренебречь значением концентрации ионов гидроксила [ОН-] в знаменателе, и тогда выражение (IV.16) запишется:
Более общепринято выражать реакцию среды через концентрацию ионов водорода и рН, поэтому, подставив в формулу (IV.13) значение [ОН-] и Кгидр, после соответствующих преобразований, получим:
Формулу для расчета рН выведем, прологарифмировав выражение (IV.18) и изменив знаки на противоположные:
Формулу (IV.19) и (IV.20) можно вывести иначе. Сначала прологарифмировать выражение (IV.17), получить рОН, а затем вычесть рОН из pKw: рН = 14 – рОН. 3. Степень гидролиза - hгидр Формулу для вычисления степени гидролиза соли по аниону выводим, действуя аналогично тому, как и в случае гидролиза по катиону. Можно воспользоваться формулой:
Т.к. концентрация прогидролизовавшейся части соли равна концентрации ионов гидроксила (уравнение реакции гидролиза), то, подставляя (IV.17) в (IV.5) и проведя ряд преобразований, получим:
Степень гидролиза по аниону равна корню квадратному из отношения ионного произведения воды к произведению концентрации соли на константу ионизации образующейся при гидролизе кислоты.
в) Гидролиз по катиону и аниону Бинарные соли, образованные катионом слабого основания и анионом слабой кислоты, гидролизуются и по катиону и по аниону. Уравнение обратимой реакции гидролиза в ионном виде запишется: Kt+ + An- + H2O Û KtOH + HАn Константа гидролиза этого процесса равна:
Вывод формул для вычисления Кгидр, hгидр, [Н+], рН осуществляется аналогично ранее рассмотренным случаям. 1. Константа гидролиза - Кгидр Для вывода формулы Кгидр преобразуем выражение (IV.22), введя в него табличные величины констант ионизации электролитов, образующихся при гидролизе. Для процессов ионизации слабых электролитов KtOH и HАn: KtOН Û Kt+ + OH- HАn Û Н+ + Аn- Константы ионизации соответственно равны:
Проведя преобразования как и в предыдущих случаях, получим:
Подставив в выражение (IV.25) уравнения (IV.23) и (IV.24), записываем формулу, позволяющую вычислить константы гидролиза, используя табличные значения констант ионизации слабых электролитов, образующихся при гидролизе.
Т.е. константа гидролиза солей, образованных катионом слабого основания и анионом слабой кислоты, равна отношению ионного произведения воды к произведению констант ионизации образующихся при гидролизе слабых электролитов. 2. Степень гидролиза - hгидр Как и в предыдущих случаях, подставим в уравнение для константы гидролиза (IV.22) концентрации прогидролизовавшейся части соли и той ее части, которая осталась непрогидролизованной, т.е.: [KtOH] = [HАn] = Сгидр = Ссоли × hгидр; [Kt+] = [Аn-] = Ссоли - Сгидр. = Ссоли - Ссоли · hгидр = Ссоли (1 - hгидр),
или после сокращения получим:
По катиону и аниону соли гидролизуются в значительной степени и значением hгидр в знаменателе пренебречь нельзя. 3. Концентрация ионов водорода [Н+] и рН растворов. В результате реакции гидролиза рассматриваемого типа образуются слабое основание и слабая кислота: Kt+ +An- + Н2O Û KtOH +HАn Реакция среды в данном случае обусловлена сравнительной силой образующихся при гидролизе электролитов. Формулу для вычисления концентрации ионов водорода с точностью, достаточной для практических целей, можно вывести из уравнения для константы гидролиза (IV.22):
т.к. [KtOH] = [HАn], а [Kt+] = [An-] = Ссоли – [HАn] ≈ Ссоли, то после подстановки этих величин в формулу (IV.22) и некоторых преобразований получим:
Из уравнения для константы ионизации слабой кислоты HАn выразим равновесную концентрацию кислоты:
т.к. концентрация анионов в растворе приблизительно равна концентрации соли [An-] ≈ Ссоли, то Подставив значение (IV.29) в выражение для константы гидролиза (IV.22), запишем уравнение:
Сокращаем дробь и получаем величину концентрации ионов водорода:
Из полученной формулы видно, что концентрация ионов водорода в растворах солей, гидролизующихся по катиону и аниону, не зависит от концентрации соли, а зависит от соотношения констант ионизации кислоты и основания, образующихся при гидролизе, т.е. от их сравнительной силы. Для того чтобы получить выражение для вычисления рН растворов, прологарифмируем уравнение (IV.30) и поменяем знаки на противоположные:
Выводы: Формулы для расчета констант гидролиза бинарных солей:
Формулы для расчета степени гидролиза - hгидр:
Формулы для расчета концентрации ионов водорода [Н+] и рН:
|
||
|
Последнее изменение этой страницы: 2017-02-08; просмотров: 14007; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.008 с.) |


 , т.к. [Н2О] велика и может считаться постоянной, то Кравн × [Н2О] = Кгидр и тогда:
, т.к. [Н2О] велика и может считаться постоянной, то Кравн × [Н2О] = Кгидр и тогда: (IV.1)
(IV.1) (IV.2)
(IV.2) (IV.3)
(IV.3) (IV.4)
(IV.4) (IV.5)
(IV.5) ;
;  ;
;  ;
; (IV.6)
(IV.6)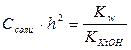 ;
;  (IV.7)
(IV.7) (IV.8)
(IV.8)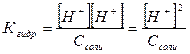 , отсюда
, отсюда  (IV.9)
(IV.9) (IV.10)
(IV.10)
 (IV.11)
(IV.11) , а
, а  , следовательно, подставив эти значения в выражение (IV.11), получим:
, следовательно, подставив эти значения в выражение (IV.11), получим: (IV.12)
(IV.12) , при 25оС
, при 25оС .
. ;
;  ;
; (IV.13)
(IV.13)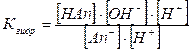 ;
; ;
; (IV.14)
(IV.14)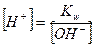 (IV.15)
(IV.15) .
. (IV.16)
(IV.16) , отсюда получаем формулу для расчета [ОН-]:
, отсюда получаем формулу для расчета [ОН-]: , или т.к.
, или т.к.  , то
, то (IV.17)
(IV.17) ;
; (IV.18)
(IV.18) ;
; ;
; (IV.19)
(IV.19)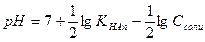 (IV.20)
(IV.20) (IV.5)
(IV.5) ;
; (IV.21)
(IV.21) (IV.22)
(IV.22) (IV.23)
(IV.23) (IV.24)
(IV.24) (IV.25)
(IV.25) (IV.26)
(IV.26)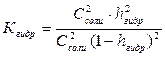 ,
, , откуда
, откуда (IV.27)
(IV.27)
 (IV.28)
(IV.28) ;
;  ,
, (IV.29)
(IV.29) .
. ;
; 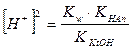 ;
; (IV.30)
(IV.30) ;
;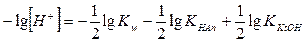 ;
; (IV.31)
(IV.31) (по Kt+);
(по Kt+);  (по Аn-),
(по Аn-),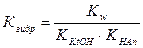 (по Kt+ и Аn-)
(по Kt+ и Аn-) (по Kt+);
(по Kt+);  (по Аn-)
(по Аn-) (по Kt+ и Аn-) или
(по Kt+ и Аn-) или 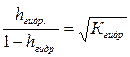 (по Kt+ и Аn-)
(по Kt+ и Аn-) (по Kt+)
(по Kt+) 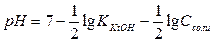 (по Kt+);
(по Kt+); (по Аn-)
(по Аn-) 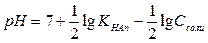 (по Аn-);
(по Аn-);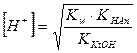 (по Kt+ и Аn-)
(по Kt+ и Аn-) 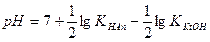 (по Kt+ и Аn-)
(по Kt+ и Аn-)


