
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
По произведению растворимости (ПР)
Величины произведений растворимости для малорастворимых соединений приведены в таблице II (приложение) и справочниках, указанных в списке литературы. Задача 1. Вычислить растворимость хлорида серебра в моль/л и г/л, если произведение растворимости его равно 1,78·10-10. Решение. Составляем уравнение, отражающее равновесие в системе осадок Û насыщенный раствор: AgCl↓ Û Ag+ + Cl- (насыщенный раствор) Так как произведение растворимости хлорида серебра 1,78·10-10 < 1·10-8, то вычисления можно проводить без учета ионной силы раствора, которая в данном случае очень мала и коэффициенты активности ионов близки к 1 (f i ≈ 1). Запишем общую формулу произведения растворимости AgCl: ПРAgCl = [Ag+][Cl-] Растворимость данного соединения Р моль/л следовательно, [Ag+] = [Cl-] = Р моль/л и ПРAgCl = Р·Р = Р2, отсюда РAgCl = М(AgCl) = 108 + 35,5 = 143,5 (г/моль) Р = 1,33·10-5 · 143,5 = 190,86·10-5 = 1,91·10-3 (г/л). Задача 2. Вычислите концентрацию ионов свинца (в моль/л) в насыщенном растворе иодида свинца PbJ2, ПР Решение. Составим уравнение, отражающее равновесие в системе осадок Û насыщенный раствор: PbJ2↓ Û Pb2+ + 2J- (нас. раствор) Расчет будем проводить без учета коэффициента активности по общей формуле: ПР Пусть [Pb2+] = х моль/л, тогда, так как в насыщенном растворе данной соли концентрация ионов иода вдвое больше концентрации ионов свинца, то [J-] = 2[Pb2+] = 2х моль/л. Подставляем х в выражение для ПР х (2х)2 = 8,7·10-9; 4х3 = 8,7·10-9;
Следовательно, в 1 литре насыщенного раствора PbJ2 содержится 1,28·10-3 моль ионов Pb2+. Задача 3. Вычислить растворимость фосфора бария, если ПР Решение. Составим уравнение, отражающее равновесие в системе осадок Û насыщенный раствор: Ba3(PO4)2↓ Û 3Ba2+ + 2PO43- (нас. раствор) При диссоциации Р моль/л соли в растворе образуется 3Р моль/л ионов бария и 2Р моль/л ионов PO43-. Запишем выражение для произведения растворимости данной соли, проведем соответствующие преобразования и выразим Р через ПР: ПР ПР
Примечание. Если в условии задачи растворимость дана в других единицах (г/л или г на 100 мл), обязательно необходимо пересчитать на моль/л. Для среднерастворимых соединений даже в отсутствии других сильных электролитов при вычислениях необходимо учитывать ионную силу раствора.
Задача 4. Вычислите растворимость хромата кальция CaCrO4 моль/л, если ПР = 7,1·10-4: а) без учета коэффициентов активности; б) с учетом коэффициентов активности. Решение. CaCrO4 Û Ca2+ + CrO42- (нас. р-р); а) без учета коэффициентов активности:
[Ca2+] = [CrO42-] = Р моль/л;
б) с учетом коэффициентов активности:
Вычисляем ионную силу раствора:
Растворимость соли равна концентрации ионов Ca2+ или концентрации CrO42- в насыщенном растворе: [Ca2+] = [CrO42-] = Р моль/л;
|
|||||
|
Последнее изменение этой страницы: 2017-02-08; просмотров: 1583; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.185.180 (0.006 с.) |
 =
=  = 1,33·10-5 (моль/л).
= 1,33·10-5 (моль/л). = 8,7·10-9.
= 8,7·10-9. = [Pb2+] · [J-]2;
= [Pb2+] · [J-]2; = 1,28·10-3 (моль/л).
= 1,28·10-3 (моль/л). =6,0·10-39.
=6,0·10-39. =
=  = 0,89 ·10-8 = 8,9 · 10-9 (моль/л).
= 0,89 ·10-8 = 8,9 · 10-9 (моль/л).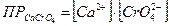 ;
; ;
; 
 (моль/л)
(моль/л)

 По таблице V находим коэффициенты активности для двухзарядных ионов при µ = 0,1: f
По таблице V находим коэффициенты активности для двухзарядных ионов при µ = 0,1: f  = f
= f 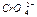 = 0,37.
= 0,37.

 (моль/л).
(моль/л).


