
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расход воздуха на сжигание 1 кг топливаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Объем воздуха, необходимый для сжигания 1 кг твердого или жидкого топлива, определяется на основе расчета стехиометрических уравнений реакции горения. Ниже приведены реакции полного горения топлива:
Относя эти уравнения к 1 кг топлива и выражая расход кислорода в объемных единицах, получим необходимый объем (м3) кислорода на 1 кг каждой составляющей горючей массы топлива: – для углерода
12,01 кг С+32 кг О2=44,01 кг СО2;
– для дожигания 1 кг углерода до СО2 требуется кислорода
1 кг С+1,866 м3 О2=1,866 м3 СО2.
Аналогично ведется расчет для водорода:
4 кг Н2+32 кг О2=36 кг Н2О;
1 кг Н2+5,56 м3 О2=11,12 м3 Н2О.
Для серы:
32 кг Sор+к+32 кг О2=64 кг SO2;
1 кг Sор+к+0,7 м3 О2=0,7 м3 SO2.
Суммируя затраты кислорода на сжигание горючих элементов, содержащихся в 1 кг топлива и вычитая кислород топлива, получим теоретически необходимый объем кислорода для сжигания 1 кг твердого или жидкого топлива
где Ср, Нр, Sр, Ор – массовое содержание горючих элементов в топливе, %, которое берут на основании лабораторных анализов или из таблиц топлив;
Для сгорания 1 м3 газового топлива теоретически необходимый объем кислорода
В атмосферном воздухе содержится 21% кислорода по объему, поэтому теоретический его расход на горение составляет
Объем теоретически необходимого воздуха для сжигания 1 кг твердого или жидкого топлива
При сжигании сухого газового топлива расчет ведется по формуле:
В практических условиях работы топочных устройств не удается осуществить полное горение топлива с теоретическим количеством воздуха. Причинами этого могут быть неравномерная подача воздуха, плохое перемешивание воздуха с топливом, несовершенства топочных устройств и др. Для достижения полноты горения топлива воздух в топочную камеру подают с некоторым избытком Vд>V0. Отношение действительного объема воздуха Vд, м3/м3, к теоретически необходимому называется коэффициентом избытка воздуха:
откуда действительный объем воздуха
Избыточный объем воздуха Vизб, м3/м3
Коэффициент избытка воздуха в зависимости от вида топлива и способа его сжигания колеблется в пределах 1,01…1,5 и выше. Чем благоприятнее условия для смешивания воздуха с топливом, тем избыток воздуха может быть меньшим. Задание на самостоятельную работу: 1. Вывод уравнения состояния идеального газа. 2. Состав и объем продуктов сгорания 1 кг топлива. 3. Энтальпия продуктов сгорания.
Вопросы для самопроверки. 1. Каков физический смысл газовой постоянной и универсальной газовой постоянной? 2. Как записать закон Гей-Люссака и Бойля-Мариотта? 3. Какие свойства имеет 1 кмоль любого идеального газа? 4. Почему газовая постоянная киломоля газа называется универсальной? 5. Что называют рабочим топливом? 6. Какая связь между высшей и низшей теплотой горения топлива? 7. Что такое условное топливо? 8. Напишите реакции полного горения топлива? 9. Как определить теоретически необходимый объем кислорода для сжигания 1 кг твердого или жидкого топлива 10. Как определить теоретически необходимый объем кислорода 11. Каков состав продуктов сгорания топлива? 12. Как определить полный объем топочных газов? 13. Как определить объем продуктов сгорания газового топлива? 14. Как определить коэффициент избытка воздуха при полном сгорании a. топлива? 15. Как определить энтальпию продуктов сгорания топлива? Лекция 2 Тема. Смеси идеальных газов
План лекции
2.1. Закон Дальтона 2.2. Закон Бойля–Мариотта для смеси газов 2.3. Уравнение состояния смеси газов 2.4. Формулы для расчета газовых смесей.
Закон Дальтона.
Для исследования свойств смесей газов большое значение имеет закон, открытый Дальтоном. Закон формулируется следующим образом: если смесь состоит из газов, которые не вступают между собой в химические реакции, то каждый газ ведет себя так, как будто он один занимает весь объем, в котором находится смесь. Из этого закона следует, что каждый газ, находящийся в смеси, оказывает на стенки сосуда, в котором заключена смесь, такое давление, какое он оказывал бы, занимая сам весь объем сосуда. Такое давление называют парциальным. Давление смеси Рсм, Па, равно сумме парциальных давлений компонентов:
где рi, – парциальные давления отдельных компонентов смеси, Па. Состав смеси может быть задан массовыми g или объемными r долями, а также числом молей каждого компонента. Массовую долю i-того компонента gi определяют по отношению
где mi – масса i-того компонента, кг; mсм – масса смеси газов, кг; Объемную долю i-того компонента ri определяют по отношению
где vi – парциальный объем i-того компонента газа, входящего в смесь, м3; Vсм – объем смеси газов м3.
|
||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 2519; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.20.205 (0.008 с.) |

 .
. , м3/кг при нормальных условиях:
, м3/кг при нормальных условиях: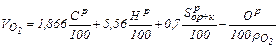 , (1.22)
, (1.22) – плотность кислорода при нормальных физических условиях, равная 1,428 кг/м3.
– плотность кислорода при нормальных физических условиях, равная 1,428 кг/м3. , м3/м3, рассчитывается аналогично:
, м3/м3, рассчитывается аналогично: . (1.23)
. (1.23) , м3/м3:
, м3/м3: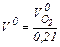 . (1.24)
. (1.24) . (1.25)
. (1.25)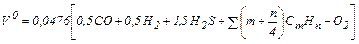 (1.26)
(1.26) , (1.27)
, (1.27) . (1.28)
. (1.28)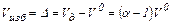 . (1.29)
. (1.29) (2.1)
(2.1) (2.2)
(2.2) (2.3)
(2.3)


