
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Энтропия как характеристика процессов в изолированной системе
4.11. Влияние необратимости процессов на работоспособность изолированной системы
Внутренняя энергия, теплота, работа
Внутренняя энергия представляет собой полный запас энергии, заключенный в теле. Эту энергию можно представить в виде суммы отдельных ее составляющих: - энергии поступательного движения молекул; - энергии вращательного движения молекулы; - энергии внутримолекулярных колебаний атомов; - энергии взаимодействия электронов с ядром; - энергии внутриядерной; - энергии взаимодействия молекул (потенциальная энергия). В технической термодинамике необходимо знать только изменение внутренней энергии при протекании термодинамического процесса. Внутреннюю энергию обычно отсчитывают от нуля при нормальных условиях (Р=760 мм рт. ст. и t=0ºС; 273 К). Для идеального газа изменение внутренней энергии будет зависеть от изменения температуры (т.к. нет взаимодействия между молекулами). Передача внутренней энергии в термодинамическом процессе может происходить в форме теплоты или в форме работы Работа отличается от теплоты тем, что связана с видимым, направленным движением тел. Если энергия в форме работы отводится от тела, то тело совершает работу. В противном случае работа отрицательная. Теплота и работа измеряются в Дж.
Теплоемкость
Одним из основных параметров термодинамического процесса является теплоемкость, которая представляет собой количество теплоты, которое необходимо подвести к единице количества тела, чтобы оно нагрелось на 1º. Единица измерения теплоемкости зависит от единицы измерения количества вещества, кг, кмоль, веса 1 м3 вещества. Теплоемкость зависит от температуры. По определению
Первый закон (начало) термодинамики
Первый закон термодинамики является частным случаем закона сохранения энергии: при тепловых процессах невозможно возникновение или уничтожение энергии. Если бы удалось создать двигатель, который производил бы работу не используя для этого энергию, то это был бы вечный двигатель первого рода. Вторая формулировка первого закона термодинамики – вечный двигатель первого рода невозможен. Аналитическое выражение первого закона термодинамики для 1 кг газа
Энтальпия
Для удобства многих термодинамических расчетов удобно использовать величину, которая является суммой внутренней энергии и произведения Р v
где i – энтальпия, Дж/кг (или теплосодержание). u – внутренняя энергия тела, Дж/кг. Учитывая уравнение (3.3) можно записать другую форму первого закона термодинамики
Термодинамические процессы
Термодинамическим процессом называется последовательное изменение состояния тела или группы тел при переходе из одного равновесного состояния в другое. При этом некоторые параметры тела могут оставаться постоянными. Только в результате совершения процесса может быть осуществлено превращение теплоты в работу. Термодинамические процессы разделяют на обратимые и необратимые. В обратимом процессе тело из конечного состояния возвращается в начальное через туже последовательность изменения параметров, что из начального в конечное. В необратимом процессе тело из конечного состояния не возвращается в начальное через туже последовательность параметров, что из начального в конечное или вообще не возвращается в начальное состояние. Все реальные процессы необратимые. Рассмотрим идеальные обратимые процессы с идеальным газом (основные обратимые процессы). К основным процессам относят процесс при постоянном объеме (v=const) – изохорный; процесс при постоянном давлении (P=const) - изобарный; процесс при постоянной температуре (T=const); адиабатный процесс, т.е. процесс, протекающий без теплообмена между рабочим телом и источниками теплоты.
Изохорный процесс
Уравнение первого закона термодинамики для бесконечно малого участка процесса:
Так как v=const то dv=0, тогда
Вся подводимая к рабочему телу теплота идет на изменение его внутренней энергии:
Изобарный процесс
Из уравнения первого закона термодинамики
Напишем уравнение первого закона термодинамики через энтальпию
т.к. P=const; dP=0, то вся подводимая к рабочему телу теплота затрачивается на изменение его энтальпии:
Изотермический процесс
P v=const (4.11)
или
|
||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 183; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.199.243 (0.009 с.) |
 (4.1)
(4.1)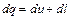 (4.2)
(4.2) (4.3)
(4.3) (4.4)
(4.4) (4.5)
(4.5)
 (4.6)
(4.6) (4.7)
(4.7)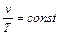 (4.8)
(4.8)
 (4.9)
(4.9)
 (4.10)
(4.10)


