Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химическую природу, физико-химические свойства и биологическая роль ферментов.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Химическую природу, физико-химические свойства и биологическая роль ферментов. Практически все реакции, избранные природой для осуществления онтогенеза, протекают в организме с участием белков-ферментов. Информация о первичной структуре белка закодирована в соответствующем ему структурном гене. Выполняется закон: Ген -> белок-фермент – > одна биохимическая реакция. Биологическая роль ферментов заключается в том, что они катализируют контролируемое протекание всех метаболических процессов в организме. Являясь веществами белкой природы, ферменты обладают всеми свойствами белков: 1.являются амфотерными соединениями; 2.вступают в те же качественные реакции, что и белки (биуретовую, ксантопротеиновую, фолина и др.); 3.подобно белкам растворяются в воде с образованием коллоидных растворов; 4.обладают электрофоретической активностью; 5.гидролизуются до аминокислот; 6.склонны к денатурации под влиянием тех же факторов: температуры, изменениях рН, действием солей тяжелых металлов, действием физических факторов (ультразвук, ионизирующее излучение и др.); 7.имеют несколько уровней организации макромолекул, что подтверждено данными рентгеноструктурного анализа, ЯМР, ЭПР. 3. Особенности ферментативного катализа. Сравнение каталитического действия ферментов и неорганических катализаторов
Кинетика ферментативных реакций. Зависимость скорости ферментативных реакций от температуры, рН среды, концентраций фермента, субстрата. Понятие об оптимумах рН и температуры, физиологическое и клинико-диагностическое значение. Определение константы Михаэлиса и ее клинико-диагностическое значение.
Кинетикаферментативной реакции (т. е. зависимость скорости реакции от ее условий) определяется в первую очередь свойствами катализатора. Ферментативная кинетика занимается исследованием закономерностей влияния химической природы реагирующих веществ (ферментов, субстратов) и условий их взаимодействия (концентрация, рН среды, температуры, присутствие активаторов или ингибиторов) на скорость ферментативной реакции. Главной целью изучения кинетики ферментативных реакцийявляется получение информации, которая может способствовать выяснению молекулярного механизма действия фермента. Зависимость скорости ферментативной реакции от количества ферментов: При проведении ферментативной реакции в условиях избытка субстрата скорость реакции будет зависеть от концентрации фермента. Графическая зависимость такой реакции имеет вид прямой линии.Однако количество фермента часто невозможно определить в абсолютных величинах, поэтому на практике пользуются условными величинами, характеризующими активность фермента: одна международная единица активности (ME) соответствует такому количеству фермента, которое катализирует превращение 1 мкмоль субстрата за 1 мин при оптимальных условиях проведения ферментативной реакции. Оптимальные условия индивидуальны для каждого фермента и зависят от температуры среды, рН раствора, при отсутствии активаторов и ингибиторов.
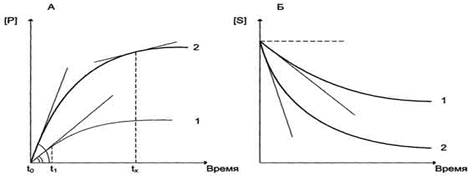
Рис. Зависимость накопления продукта (А) и убыли субстрата (Б) от времени (продолжительности) протекания реакции. Скорость ферментативной реакции определяется изменением концентрации продукта или субстрата за единицу времени.
Период ферментативной реакции [t1 - tx] характеризуется нелинейным накоплением продукта (или убылью субстрата) в зависимости от времени реакции.
единица активности ферментов: 1 катал (кат), соответствующий такому количеству катализатора, которое превращает 1 моль субстрата за 1 с. Количество каталов определяют по формуле:
n катал = Международная единица ферментативной активности ME связана с каталом следующими равенствами: 1 кат = 1 моль S/c = 60 моль S/мин = 60х106мкмоль/мин = 6х107ME, 1 ME = 1 мкмоль/мин = 1/60 мкмоль/с = 1/60 мккат = 16,67 нкат. В медицинской практике для оценки активности ферментов часто используют международные единицы активности - ME. Для оценки количества молекул фермента среди других белков данной ткани определяют удельную активность (уд. ак.) фермента, численно равную количеству единиц активности фермента (пМЕ) в образце ткани, делённому на массу (мг) белка в этой ткани: Уд. ак. =
По удельной активности судят об очистке фермента: чем меньше посторонних белков, тем выше удельная активность.
Зависимость скорости ферментативной реакции от температуры среды Повышение температуры до определённых пределов оказывает влияние на скорость ферментативной реакции, подобно влиянию температуры на любую химическую реакцию. С повышением температуры ускоряется движение молекул, что приводит к повышению вероятности взаимодействия реагирующих веществ. Кроме того, температура может повышать энергию реагирующих молекул, что также приводит к ускорению реакции. Однако скорость химической реакции, катализируемая ферментами, имеет свой температурный оптимум, превышение которого сопровождается понижением ферментативной активности, возникающим из-за термической денатурации белковой молекулы. Для большинства ферментов человека оптимальна температура 37-38 °С. Однако в природе существуют и термостабильные ферменты. Например, Taq-полимераза, выделенная из микроорганизмов, живущих в горячих источниках, не инактивируется при повышении температуры до 95 °С. Этот фермент используют в научно-практической медицине для молекулярной диагностики заболеваний с использованием метода полимеразной цепной реакции (ПЦР).
Рис. Зависимость скорости ферментативной реакции (V) от температуры. Зависимость скорости ферментативной реакции от рН среды Для каждого фермента существует значение рН, при котором наблюдается его максимальная активность. Отклонение от оптимального значения рН приводит к понижению ферментативной активности. Влияние рН на активность ферментов связано с ионизацией функциональных групп аминокислотных остатков данного белка, обеспечивающих оптимальную конформацию активного центра фермента. При изменении рН от оптимальных значений происходит изменение ионизации функциональных групп молекулы белка. Например, при закислении среды происходит протонирование свободных аминогрупп (NH3+), а при защелачивании происходит отщепление протона от карбоксильных групп (СОО-). Это приводит к изменению конформации молекулы фермента и конформации активного центра; следовательно, нарушается присоединение субстрата, кофакторов и коферментов к активному центру. Кроме того, рН среды может влиять на степень ионизации или пространственную организацию субстрата, что также влияет на сродство субстрата к активному центру. При значительном отклонении от оптимального значения рН может происходить денатурация белковой молекулы с полной потерей ферментативной активности.
Оптимум значения рН у разных ферментов различный. Ферменты, работающие в кислых условиях среды (например, пепсин в желудке или лизосомальные ферменты), приобретают конформацию, обеспечивающую работу фермента при кислых значениях рН. Однако большая часть ферментов организма человека имеет оптимум рН, близкий к нейтральному, совпадающий с физиологическим значением рН. Зависимость скорости ферментативной реакции от количества субстрата Если концентрацию ферментов оставить постоянной, изменяя только количество субстрата, то график скорости ферментативной реакции описывают гиперболой. При увеличении количества субстрата начальная скорость возрастает. Когда фермент становится полностью насыщенным субстратом, т.е. происходит максимально возможное при данной концентрации фермента формирование фермент-субстратного комплекса, наблюдают наибольшую скорость образования продукта. Дальнейшее повышение концентрации субстрата не приводит к увеличению образования продукта, т.е. скорость реакции не возрастает. Данное состояние соответствует максимальной скорости реакции Vmax. Таким образом, концентрация фермента - лимитирующий фактор в образовании продукта. Это наблюдение легло в основу ферментативной кинетики, разработанной учёными Л. Михаэлисом и М. Ментен в 1913 г. Ферментативный процесс можно выразить следующим уравнением:
где k1 - константа скорости образования фермент-субстратного комплекса; k-1 - константа скорости обратной реакции, распада фермент-субстратного комплекса; k2 - константа скорости образования продукта реакции. Следующее соотношение констант скоростей (k-1 + k2)/k1 называют константой Михаэлиса и обозначают Кm. Скорость реакции пропорциональна концентрации фермент-субстратного комплекса ES, a скорость образования ES зависит от концентрации субстрата и концентрации свободного фермента. На концентрацию ES влияет скорость формирования и распада ES. Наибольшая скорость реакции наблюдается в том случае, когда все молекулы фермента находятся в комплексе с субстратом, т.е. в фермент-субстратном комплексе ES, т.е. [Е] = [ES].
Зависимость скорости ферментативной реакции от концентрации субстрата выражается следующим уравнением
V =
Это уравнение получило название уравнения Михаэлиса-Ментен. В случае, когда скорость реакции равна половине максимальной, Km = [S] Таким образом, константа Михаэлиса численно равна концентрации субстрата, при которой достигается половина максимальной скорости. Уравнение Михаэлиса-Ментен - основное уравнение ферментативной кинетики, описывающее зависимость скорости ферментативной реакции от концентрации субстрата. Если концентрация субстрата значительно больше Km (S >> Km), to увеличение концентрации субстрата на величину Кm практически не влияет на сумму (Km + S) и её можно считать равной концентрации субстрата. Следовательно, скорость реакции становится равной максимальной скорости: V = Vmax. В этих условиях реакция имеет нулевой порядок, т.е. не зависит от концентрации субстрата. Можно сделать вывод, что Vmax - величина постоянная для данной концентрации фермента, не зависящая от концентрации субстрата. Если концентрация субстрата значительно меньше Km(S << Km), то сумма (Km + S) примерно равна Кm, следовательно, V = Vmax[S]/Km, т.е. в данном случае скорость реакции прямо пропорциональна концентрации субстрата (реакция имеет первый порядок).
Рис. Зависимость скорости реакции (V) от концентрации субстрата S. Vmах и Km - кинетические характеристики эффективности фермента. · Vmax дает характеристику каталитической активности фермента и имеет размерность скорости ферментативной реакции моль/л, т.е. определяет максимальную возможность образования продукта при данной концентрации фермента и в условиях избытка субстрата. Кm характеризует сродство данного фермента к данному субстрату и является величиной постоянной, не зависящей от концентрации фермента. Чем меньше · Кm, тем больше сродство фермента к данному субстрату, тем выше начальная скорость реакции и наоборот, чем больше Кm, тем меньше начальная скорость реакции, тем меньше сродство фермента к субстрату. А. Обратимое ингибирование Обратимые ингибиторы связываются с ферментом слабыми нековалентными связями и при определённых условиях легко отделяются от фермента. Обратимые ингибиторы бывают конкурентными и неконкурентными. 1. Конкурентное ингибирование К конкурентному ингибированию относят обратимое снижение скорости ферментативной реакции, вызванное ингибитором, связывающимся с активным центром фермента и препятствующим образованию фермент-субстратного комплекса. Такой тип ингибирования наблюдают, когда ингибитор - структурный аналог субстрата, в результате возникает конкуренция молекул субстрата и ингибитора за место в активном центре фермента. В этом случае с ферментом взаимодействует либо субстрат, либо ингибитор, образуя комплексы фермент-субстрат (ES) или фермент-ингибитор (EI). При формировании комплекса фермента и ингибитора (EI) продукт реакции не образуется.
Кинетические зависимости Конкурентные ингибиторы уменьшают скорость химической реакции. Конкурентный ингибитор повышает Кm для данного субстрата (уменьшает сродство субстрата к ферменту). Это означает, что в присутствии конкурентного ингибитора необходима большая концентрация субстрата для достижения 1/2 Vmax. Увеличение соотношения концентрации субстрата и ингибитора снижает степень ингибирования. При значительно более высоких концентрациях субстрата ингибирование полностью исчезает, потому что активные центры всех молекул фермента будут находиться преимущественно в комплексе с субстратом. Кинетические зависимости Этот тип ингибирования характеризуется снижением Vmax ферментативной реакции и уменьшением сродства субстрата к ферменту, т.е. увеличением Кm. Оксидоредуктазы Катализируют окислительно-восстановительные реакции. В реакцию вступают 2 вещества и 2 образуются, одно окисляется, другое восстанавливается: Sвост + S’окисл ↔ S’вост + Sокисл Оксидоредуктазы делятся на: дегидрогеназы (отщепляют Н от субстратов), оксидазы (переносят Н с субстрата на кислород), оксигеназы (включают кислород в молекулу субстрата), гидроксипероксидазы (разрушают перекиси водорода и органические перекиси). Систематическое название включает в себя название донора е и Н+ через двоеточие название акцептора через тире – название класса: донор: акцептор (косубстрат) оксидоредуктаза R-CH2-OH + НАД+ ↔ R-CH=О + НАДН2 Систематическое название: Алкоголь: НАД+ оксидоредуктаза Тривиальное название: алкогольдегидрогеназа. Шифр: КФ 1.1.1.1 Пируват + НАДН2 ↔ лактат + НАД+ Систематическое название: Лактат: НАД+ оксидоредуктаза Тривиальное название: ЛДГ. Шифр: КФ 1.1.2.7 Трансферазы Ферменты этого класса принимают участие в переносе атомных групп, молекулярных остатков от одного соединения к другому. В реакцию вступают 2 вещества и 2 образуются: S-G + S’ ↔ S + S’-G. В зависимости от переносимых групп трансферазы делятся на: 1). фосфотрансферазы (киназы); 2). аминотрансферазы; 3). гликозилтрансферазы; 4). метилтрансферазы; 5). ацилтрансферазы. Систематическое название: откуда: куда в какое положение –что–трансфераза или донор: акцептор–транспортируемая группа– трансфераза АТФ + D-гексоза ↔ АДФ + D- гексоза-6ф Систематическое название: АТФ: D-гексоза-6-фосфотрансфераза Тривиальное название: гексокиназа ФЕП + АДФ → ПВК + АТФ Систематическое название: АТФ: ПВК-2-фосфотрансфераза Тривиальное название: пируваткиназа 3. Гидролазы. Расщепляют ковалентную связь с присоединением молекулы воды. В реакцию вступают 2 вещества и 2 образуются: S-G + Н2О ↔ S-ОН + G-Н. В зависимости от характера гидролизуемой связи, различают подклассы: 1). гликозидазы – гидролиз гликозидов (лактоза – лактаза, мальтоза – мальтаза, сахароза – сахараза); 2). пептидазы – гидролиз пептидных связей; 3). эстеразы – разрыв связи в сложных эфирах. Систематическое название субстрат–что отщепляется–гидролаза или субстрат–гидролаза Ацетилхолин + Н2О ↔ Ацетат + Холин Систематическое название: Ацетилхолин-ацилгидролаза (Ацетилхолин-гидролаза) Тривиальное название: Ацетилхолинэстераза
Глюкозо-6ф + Н2О → глюкоза + Н3РО4 Систематическое название: Глюкозо-6ф-фосфогидролаза Тривиальное название: Глюкозо-6ф-фосфотаза Лиазы Отщепление групп от субстратов по негидролитическому механизму с образованием двойных связей (или наоборот, присоединение по двойной связи). Реакции обратимы, за исключением отщепления СО2. В реакцию вступает 1 вещество и 2 образуются (или наоборот): -SХ-SY- ↔ XY + -S=S- Систематическое название с убстрат: что отщепляется–лиаза L-малат ↔ фумарат + Н2О Систематическое название: L-малат: гидро – лиаза Тривиальное название: фумараза Изомеразы Взаимопревращения оптических, геометрических, позиционных изомеров. В реакцию вступает 1 вещество и 1 образуется. Исходя из типа катализируемой реакции изомеризации выделяется несколько подклассов: 1) рацемазы; 2) эпимеразы; 3) таутамеразы; 4) цис,- трансизомеразы; 5) мутазы (при внутримолекулярном переносе группы); 6) цикло-, оксоизомеразы. Систематическое название субстрат – вид изомеризации – изомераза или субстрат – продукт – изомераза Фумаровая к-та ↔ малеиновая к-та Систематическое название: фумарат – цис,транс – изомераза гл-6ф ↔ фр-6ф Систематическое название: гл-6ф – фр-6ф – изомераза Лигазы (синтетазы) Соединение 2 молекул с использованием энергии макроэргических соединений (АТФ и др). В реакцию вступают 3 вещества, образуется 3 вещества. Систематическое название субстрат: субстрат – лигаза (источник энергии) АТФ + L-глутамат + NH4+ → АДФ + Фн + L-глутамин Систематическое название: L-глутамат: аммиак – лигаза (АТФ → АДФ + Фн) Тривиальное название: глутаминсинтетаза АТФ + ПВК + СО2 → АДФ + Фн + ЩУК Систематическое название: ПВК: СО2 – лигаза (АТФ → АДФ + Фн) Тривиальное название: пируваткарбокилаза I. Энзимопатология Энзимопатология – это наука, которая изучает энзимопатии. Энзимопатии – это группа заболеваний, которые вызваны различными дефектами ферментов. Энзимопатий делятся на: наследственные (первичные) и приобретенные (вторичные).
Наследственные энзимопатии Наследственные энзимопатии – это заболевания, вызванные наследственными нарушениями биосинтеза ферментов или их структуры и функции. В норме:
Полное или частичное нарушения биосинтеза ферментов вызывают дефекты генов регуляторных белков, которые контролируют синтез ферментов:
Нарушение структуры и функции ферментов вызывают дефекты генов этих ферментов:
У образовавшегося фермента наблюдаются структурные изменения, которые проявляются в изменении его каталитической активности (как правило, она исчезает), чувствительности к активаторам и ингибиторам, сродству к субстратам, оптимумам рН, температуры. В связи с этим изучением констант фермента является решающим в постановке диагноза врожденных энзимопатий. Наследственные энзимопатии по типу нарушений метаболизма делят на: 1. нарушения обмена аминокислот: фенилкетонурия, альбинизм, алкаптонурия и др.; 2. нарушения углеводного обмена: галактоземия, наследственная непереносимость фруктозы, гликогенозы; 3. нарушения липидного обмена: липидозы; 4. нарушения обмена нуклеиновых оснований: подагры, синдрома Леш-Нихана и др.; 5. нарушение обмена в соединительной ткани: мукополисахаридозы, хондродистрофия и др.; 6. дефекты ферментов в ЖКТ: муковисцидоз, целиакия, непереносимость лактозы и др. 7. нарушения обмена стероидов и т.д.
В норме метаболический путь протекает следующим образом:
Из-за дефекта в метаболическом пути (цикле, шунте) одного из ферментов в организме происходит накопление промежуточных продуктов (часто токсичных в высоких концентрациях) и дефицит жизненно необходимых конечных продуктов, что приводит к клиническим проявлениям:
Пример: фенилпировиноградная олигофрения – наследственное заболевание, приводящее в раннем детстве к гибели ребенка или к развитию у него тяжелой умственной отсталости. Причиной заболевания является отсутствие в печени фермента фен-4-монооксигеназы, которая обеспечивает превращение незаменимой аминокислоты Фен в Тир:
Эта реакция необходима для катаболизма Фен, т.е. удаления его излишков. При отсутствии фен-4-монооксигеназы в организме происходит накопление Фен и превращение его в различные производные: фенилпировиноградную, фенилмолочную и фенилуксусную кислоты. Фен и его производные в высоких концентрациях токсичны, накапливаясь в тканях, они оказывают на них повреждающее действие. Самой чувствительной к Фен и его производным оказывается нервная ткань детей, она поражается в первую очередь. Диагноз фенилкетонурия ставят на основании обнаружения Фен в крови или фенилпировиноградной кислоты на пеленках детей. Лечение в основном сводится к исключению из питания ребенка Фен. Для такого ребенка Тир оказывается незаменимой аминокислотой. Другое тяжелое наследственное заболевание – галактеземия (непереносимость молочного сахара), связано с отсутствием синтеза в печени ферментов, катализирующих превращение галактозы в глюкозу. В результате в раннем возврате происходит накопление в тканях галактозы, приводящее к развитию катаракты, поражению печени, мозга, нередко вызывающее гибель ребенка. Лечение в данном случае сводиться к исключению из диеты молочного сахара. Приобретенные энзимопатии Приобретенные энзимопатии делятся на: алиментарные, токсические и вызванные различными патологическими состояниями организма. А). Алиментарные энзимопатии – это заболевания, вызванные изменением количества и активности ферментов вследствие нарушения характера питания. Алиментарные энзимопатии вызываются дефицитом или дисбалансом в пище: ü витаминов (гипо-, авитаминозы); ü макро- и микроэлементов; ü аминокислот; ü жирных кислот; ü других БАВ Например, алиментарная энзимопатия, вызванная недостаточностью витамина А, проявляется нарушением сумеречного зрения (куриная слепота), воспалением слизистых глаз, ЖКТ, кожи. Б). Токсические энзимопатии – это заболевания, вызванные нарушением активности ферментов вследствие действия токсических веществ. Токсическим веществами являются многие ксенобиотики (соли тяжелых металлов, пестициды, гербециды и т.д.), а также некоторые метаболиты в высоких концентрациях (алкоголь). Токсические вещества могут либо избирательно угнетать активность (через денатурацию или ингибирование) или синтез отдельных ферментов, либо угнетать весь биосинтез белка (и соответственно всех ферментов). Примеры: ü Цианиды и СО прочно связываются с геминовым Fe активного центра цитохромов, что угнетает их активность; ü Фториды угнетают активность ферментов, содержащих в активном центре Mg2+; ü Ингибиторы, содержащиеся в соевых продуктах, яйцах домашней птицы угнетают активность протеаз ЖКТ - трипсина, химотрипсина, эластазы; ü Антивитамины, присутствующие в некоторых пищевых продуктах, или разрушают витамины или конкурентно замещают их в молекулах ферментов, что приводит к угнетению активности этих ферментов.
В). Энзимопатии, вызванные различными патологическими состояниями организма. Так как ферменты имеют оптимумы t, рН и давления, практически любое заболевание, вызывающее нарушения КОС, изменение температуры тела, концентрации активаторов и ингибиторов, меняет активность ферментов организма. Например, при ацидозе и повышении температуры возрастает активность катаболических (лизосом) и падает активность анаболических ферментов. Ферменты в медицинской практике находят применение в качестве диагностических (энзимодиагностика) и терапевтических (энзимотерапия) средств. 14.Принципы, направления и объекты энзимодиагностики: а) энзимологическое определение количества метаболитов, б) определение активности ферментов. Причины и механизмы развития ферментемий. Энзимодиагностика (энзим[ы] + греч. diagnostikos способный распознавать) – методы диагностики болезней, патологических состояний и процессов, основанные на определении активности ферментов в биологических жидкостях. Направления энзимодиагностики: Дыхательный контроль В норме субстраты тканевого дыхания и О2 находятся в достаточном количестве и не лимитируют окислительное фосфорилирование. Активность окислительного фосфорилирования ограничивает только концентрация АДФ, которая обратно пропорциональна концентрации АТФ. При нагрузке концентрация АТФ снижается, а АДФ увеличивается, что ускоряет дыхание и фосфорилирование. В состоянии покоя количество АТФ увеличивается, а АДФ снижается, что тормозит дыхание и фосфорилирование. Зависимость интенсивности дыхания митохондрий от концентрации АДФ называют дыхательным контролем. В результате дыхательного контроля скорость синтеза АТФ соответствует потребностям клетки в энергии. Общее содержание АТФ в организме 30—50 г, но каждая молекула АТФ в клетке «живёт» меньше минуты. В сутки у человека синтезируется 40—60 кг АТФ и столько же распадается. Коэффициент окислительного фосфорилирования Для оценки эффективности окислительного фосфорилирования используют коэффициент окислительного фосфорилирования (Р/О).Коэффициентом окислительного фосфорилирования называют отношение количества фосфорной кислоты (Р), использованной на фосфорилирование АДФ, к атому кислорода (О), поглощённого в процессе дыхания. При окисление молекулы НАДН2, е- по дыхательной цепи проходят 3 пункта сопряжения, что обеспечивает синтез 3 АТФ при затрате 3 Н3РО4 и 3 АДФ на 1 атом кислорода. Соответственно для НАДН2 Р/О=3. При окисление молекулы ФАДН2, е- по дыхательной цепи проходят только 2 пункта сопряжения, что обеспечивает синтез 2 АТФ при затрате 2 Н3РО4 и 2 АДФ на 1 атом кислорода. Соответственно для ФАДН2 Р/О=2. Эти величины Р/О отражают теоретический максимум синтеза АТФ, фактически эта величина меньше из-за затрат на транспорт. 23. Микросомальное окисление (МСО) –моно - и диоксигеназные пути использования кислорода в клетке: локализация редокс-цепи в эндоплазматическом ретикулуме(ЭПР), биологическое значение. Особенности строения и функции цитохром-p450-оксидазы и цитохром-b5-оксидазы, возрастные особенности и факторы индукции синтеза ферментов. Цитохром р450 в клинической практике. Монооксигеназные реакции Монооксигеназы это ферменты, которые включают в субстрат только один атом молекулы кислорода. Другой атом кислорода восстанавливается до воды с участием электронов и протонов НАДФН2, НАДН2, реже витамин С: S-Н + О2 + RH2 → S-ОН + Н2О + R (где R = НАДФН2, НАДН2, витамин С) Монооксигеназные реакции протекают на цитоплазматической поверхности гладкого ЭПР, их называют микросомальным окислением, и на внутренней поверхности внутренней мембраны митохондрии. Катализируют низкоспецифичные реакции. Диоксигеназные реакции Диоксигеназы это ферменты, которые включают в субстрат оба атома молекулы кислорода: S + О2 → SО2 Таким путем окисляются циклические трудноокисляемые структуры, реакции идут с разрывом цикла. Диоксигеназные реакции протекают на цитоплазматической поверхности гладкого ЭПР. Гомогентизатдиоксигеназа печени, содержит Fe2+, участвует в катаболизме тирозина Цитохром Р450 – интегральный гемопротеин, содержит простетическую группу гем, имеет участки связывания для О2 и субстрата. Открыто 150 генов, кодирующих различные изоформы цитохрома Р450. Каждая из изоформ Р450 имеет много субстратов и отличается от других изоформ Р450 только белковой частью. Цитохром Р450 передает 2 электрона на 1 атом молекулы кислорода, который превращается в О2-, при взаимодействии с 2 протонами О2- дает воду. Второй атом молекулы кислорода включается в субстрат RH, образуя ROH. Цитохром b5. Цитозольный домен содержит гем, гидрофобный домен фиксирует фермент в мембране. Цитохром b5 может передавать свои электроны на различные ферменты (цитохромР450, Стеароил-КоА-десатуразу и т.д.), образуя различные ЦПЭ, при этом он участвует в десатурации и элонгации жирных кислот, в синтезе холестерина, плазминогенов и церамида. 24. Свободно-радикальное окисление (СРО): стадии и реакции образования активных форм О2 (супероксид, пероксид, гидроксид - радикал), факторы инициации. Значение в физиологии и патологии клетки пероксидазного и радикального пути использования кислорода. Образование активных форм кислорода АФК во многих клетках образуются в основном в ферментативных и неферментативных реакциях в результате последовательного присоединения е- к кислороду: 1) О2 + 1е- → О ∙ 2 супероксидный анион-радикал (˙О::О:). 2) О ∙ 2 +1е- → О2-2 пероксидный анион (:О::О:), он быстро протонируется с образованием перекиси водорода О2-2 + 2Н+ → Н2О2 (Н:О::О:Н) 3) Н2О2 + 1е- → НО ∙ + ОН- гидроксильный радикал, ОН- протонируется с образованием воды ОН- + Н+ → Н2О 4) ОН ∙ + 1е- → Н2О (Н:О:Н) Ферментативные реакции образования АФК Электроны, необходимые для образования АФК могут давать ЦПЭ. Утечка е- из ЦПЭ на кислород является основным путем образования АФК в большинстве клеток: 1.В цепи окислительного фосфорилирования Q принимая 1 е- превращается в свободный радикал семихинон НQ ∙, который при реоксигенации ишемических тканей может непосредственно взаимодействовать с кислородом, образуя супероксидный анион-радикал: HQ· + O2 → Q+ О ∙ 2 + H+; 2.в монооксигеназных реакциях е- с цитохрома Р450 переходит на кислород с образованием супероксидного анион-радикала, который иногда теряется с активного центра. 3.Аэробные дегидрогеназы (ФАД-зависимые оксидазы) переносят е- и Н+ с субстрата на кислород с образованием перекиси водорода. Примеры таких оксидаз — оксидазы аминокислот, супероксид дисмутаза, оксидазы, локализованные в пероксисомах. Неферментативные реакции образования АФК Электроны, необходимые для образования АФК могут давать: 1).Металлы переменной валентности. Наличие в клетках Fe2+ или ионов других переходных металлов катализирует образования АФК. Например, в эритроцитах окисление иона железа гемоглобина способствует образованию супероксидного анион-радикала. Hb(Fe2+) + O2 → MetHb(Fe3+) + О ∙ 2 2). Радикалы. АФК, обмениваясь электроном, легко переходят друг в друга: О ∙ 2 + Н2О2 → О2 + НО ∙ + ОН- АФК также могут образовываться в организме неферметативно при гомолитическом разрыве связей под действием ионизирующего излучения. Ионизирующее излучение вызывает например, радиолиз воды с образованием Н2; Н2О2 и свободных радикалов: Н·, НО ∙, О·.(фотостарение) Кислородные радикалы, обладая высокой активностью, разрушают органические молекулы в реакциях свободно-радикального окисления (СРО). Большая часть этих реакций протекает с полиненасыщенными жирными кислотами липидов, и называется перекисным окислением липидов (ПОЛ). Значение в клетке: Химическую природу, физико-химические свойства и биологическая роль ферментов. Практически все реакции, избранные природой для осуществления онтогенеза, протекают в организме с участием белков-ферментов. Информация о первичной структуре белка закодирована в соответствующем ему структурном гене. Выполняется закон: Ген -> белок-фермент – > одна биохимическая реакция. Биологическая роль ферментов заключается в том, что они катализируют контролируемое протекание всех метаболических процессов в организме. Являясь веществами белкой природы, ферменты обладают всеми свойствами белков: 1.являются амфотерными соединениями; 2.вступают в те же качественные реакции, что и белки (биуретовую, ксантопротеиновую, фолина и др.); 3.подобно белкам растворяются в воде с образованием коллоидных растворов; 4.обладают электрофоретической активностью; 5.гидролизуются до аминокислот; 6.склонны к денатурации под влиянием тех же факторов: температуры, изменениях рН, действием солей тяжелых металлов, действием физических факторов (ультразвук, ионизирующее излучение и др.); 7.имеют несколько уровней организации макромолекул, что подтверждено данными рентгеноструктурного анализа, ЯМР, ЭПР. 3. Особенности ферментативного катализа. Сравнение каталитического действия ферментов и неорганических катализаторов
Познавательные статьи:
|
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 678; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.105.222 (0.019 с.) |