Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Декарбоксилирование аминокислот
В тканях млекопитающих декарбоксилированию может подвергаться целый ряд аминокислот. Продуктами этих реакций являются СО2 и биогенные амины. Последние оказывают сильное фармакологическое действие на множество физиологических функций в организме человека. Как и всякие сигнальные молекулы, они существуют короткое время и должны быстро разрушаться. Реакции декарбоксилирования в отличие от других процессов промежуточного обмена аминокислот необратимы. Они катализируются ферментами – пиридоксальфосфатзависимыми декарбоксилазами. Степень субстратной специфичности декарбоксилаз очень различна. К наиболее избирательным относятся глутаматдекарбоксилаза и гистидиндекарбоксилаза. Реакции декарбоксилирования аминокислот представлены общей схемой:
R - CH - COOH декарбоксилаза CO2 + R - CH2 | NH2 пиридоксальфосфат аминокислота
биогенный амин
Декарбоксилирование лизина. Диамины кадаверин (и путресцин) впервые были обнаружены среди продуктов гниения белков, потому их отнесли поначалу к так называемым «трупным ядам», хотя позже выяснилось, что в действительности их токсичность невелика, а кадаверин образуют только бактерии. Декарбоксилирование орнитина. Орнитин – небелковая аминокислота, источниками которой является гидролиз аргинина и синтез из глутамата. Помимо его роли в биосинтезе мочевины, орнитин (вместе с метионином) служит предшественником полиаминов – спермина и спермидина – продуктов декарбоксилирования и полимеризации орнитина, участвующих в стимуляции деления клеток. Декарбоксилирование цистеина. В организме человека и многих животных цистеин является единственным источником неорганического сульфата. Лишь небольшая часть его выводится с мочой сразу. Цистеин окисляется до цистеината, а затем декарбоксилируется в таурин. Таурин в печени вступает в реакцию конъюгации с первичными желчными кислотами, усиливая амфифильность этих молекул. Таурин – ингибиторный нейротрансмиттер головного мозга. У детей часто не хватает таурина. В сетчатке глаза таурин задерживает развитие катаракты, участвует также в защите и развитии головного мозга. Д екарбоксилирование R – пантотенатцистеина. Приводит к синтезу кофермента А (КоА) R - пантотенаттиоэтаноламина – переносчика ацилов. Тиоловая группа цистеина в КоА играет роль акцептора ацилов в HSKоА.
Декарбоксилирование серина. Серин – заменимая аминокислота, синтезируется из промежуточного продукта гликолиза – 3 - фосфглицерата, а аминогруппу получает от глутамата. В составе глицерофосфолипида – фосфотидилсерина, серин декарбоксилируется, превращаясь в фосфотидилэтаноламин, который в свою очередь метилируется активной формой метионина (SAM) и превращается в фосфотидилхолин. Все эти фосфатиды необходимы для построения клеточных мембран. Фосфатидилинозитол в клеточных мембранах выполняет регуляторную функцию (из него синтезируются вторые посредники для гормонов). Холин в холинэргических нервных окончаниях участвует в синтезе ацетилхолина.Ацетилхолин – один из возбуждающих нейротрансмиттеров в: · головном мозге · двигательных нервах · вегетативных ганглиях · парасимпатических нервах Но ацетилхолин является ингибитором ритмики сердца и расширяет сосуды. Декарбоксилирование глутамата. В нервных клетках декарбоксилирование глутамата под действием декарбоксилазы приводит к образованию γ – аминомасляной кислоты (ГАМК). Содержание ГАМК в головном мозге в десятки раз выше других нейромедиаторов. Она увеличивает проницаемость постсинаптических мембран для ионов К+, что вызывает торможение нервного импульса, отсюда её функция ингибиторного нейротрансмиттера головного мозга. Лекарства, увеличивающие уровень ГАМК или её действие, очень важны в лечении эпилепсии. Декарбоксилирование гистидина. В тучных клетках соединительной ткани гистидиндекарбоксилаза катализирует образование гистамина из гистидина. Гистамин сохраняется в секреторных гранулах тучных клеток и секретируется в кровь при повреждении ткани (удар, ожог, эндо - и экзогенных веществ), вызывая развитие иммунных и аллергических реакций. Гистамин действует через два основных типа рецепторов – Н1 и Н2.Через Н2 –рецепторы гистамин стимулирует секрецию соляной кислоты в желудочный сок. В клинике гистамин используется для оценки кислотообразовательной функции желудка.
Через Н1 – рецепторы – в физиологических концентрациях расширяет кровеносные сосуды, повышает проницаемость капилляров, вызывает отёки снижает артериальное давление (но увеличивает внутричерепное давление, участвует в развитии головной боли). Также гистамин сокращает гладкую мускулатуру лёгких, вызывает спазм бронхов. Участвует в формировании воспалительных реакций, вызывая расширение сосудов, покраснение кожи, отёчность тканей. Гистамин является медиатором боли, вызывает аллергическую реакцию. Синтез катехоламинов из тирозина. В нервной ткани, в мозговом веществе надпочечников тирозин гидроксилируется, превращается в небелковую аминокислоту дигидрофенилаланин (ДОФА), который декарбоксилируется в дофаминергической системе, превращаясь в дофамин. В симпатико – адреналовой системе дофамин гидроксилируется с участием аскорбата, превращаясь в норадреналин. Последний метилируется SAM в адреналин. Декарбоксилирование триптофана. Декарбоксилированию триптофана предшествует его гидроксилирование в 5 - ОН- триптофан. Продукт декарбоксилирования 5 - ОН - триптофана – серотонин. Серотонин – нейротрансмиттер в некоторых проводящих путях головного мозга (реализует эффекты с участием группы серотониновых рецепторов). Серотонин обнаружен в высокой концентрации в энтерохромафинных клетках желудочно-кишечного тракта (кишечник), а также в лёгких. В крови транспортируется в комплексе с тромбоцитами. Серотонин способствует лидерству (много серотонина вырабатывается у боевого генерала, у волка – вожака стаи), снижает чувство страха, агрессивность. Серотонин – мощный антидепрессант (большая группа антидепрессантов является ингибиторами обратного захвата серотонина и/ или норадреналина). Серотонин является важным нейрогормоном, поддерживающим нормальную психическую деятельность, обладает сосудосуживающим действием, регулирует ряд центральных вегетативных функций – регулирует температуру тела, дыхание, кровяное давление. Кроме того, серотонин снижает активность половых желёз, увеличивает моторику кишечника, увеличивает свёртывание крови, увеличивает пролиферацию, участвует в воспалительных и аллергических реакциях. Метаболизируется серотонин, главным образом, под действием моноаминооксидазы (МАО). Конечный продукт метаболизма – 5-оксииндолилуксная кислота выводится почками, содержание которой в моче характеризует состояние синтеза и освобождения серотонина из депо. В шишковидной железе из серотонина синтезируется гормон мелатонин, который снижает активность половых желёз, пигментацию кожи, способствует сну («гормон темноты»). Малые дозы мелатонина в медицине применяются как снотворное. ОБМЕН ПО АМИНОГРУППЕ Аминокислоты, поступившие в клетки, подвергаются катаболизму. Катаболизм большинства аминокислот начинается с отщепления a-аминогруппы (рис.14). Аминокислоты теряют аминогруппу в результате двух типов реакций: трансаминирования (переаминирования) и дезаминирования – прямого для глутамата и непрямого – для остальных аминокислот.
Рис. 14. Обмен аминокислот
Переаминирование – обратимый процесс переноса a-аминогруппы с аминокислоты на a-кетокислоту, в результате чего образуются новая кетокислота и новая аминокислота. Процесс протекает без промежуточного образования аммиака. Катализируют реакции ферменты аминотрансферазы, коферментом которых служит пиридоксальфосфат – производное витамина В6. Аминотрансферазы обладают субстратной специфичностью. Наиболее распространенными ферментами являются аланинаминотрансфераза (АЛТ), которая катализирует реакцию переаминирования между аланином и a-кетоглутаратом, и аспартатаминотрансфераза (АСТ), которая катализирует реакцию переаминирования между аспартатом и a-кетоглутаратом. Активность АЛТ наиболее велика в ткани печени, а АСТ – в сердечной мышце. Поэтому повышение в крови активности АЛТ характерно для заболеваний печени, а повышение активности АСТ – для инфаркта миокарда. Иногда для диагностики используют коэффициент де Ритиса (отношение активности АСТ/ АЛТ). В норме он равен 1,33±0,42. Отношение менее 1,0 характерно для острого вирусного гепатита. При инфаркте миокарда коэффициент возрастает.
Рис.15. Взаимопревращение амино- и кетокислот
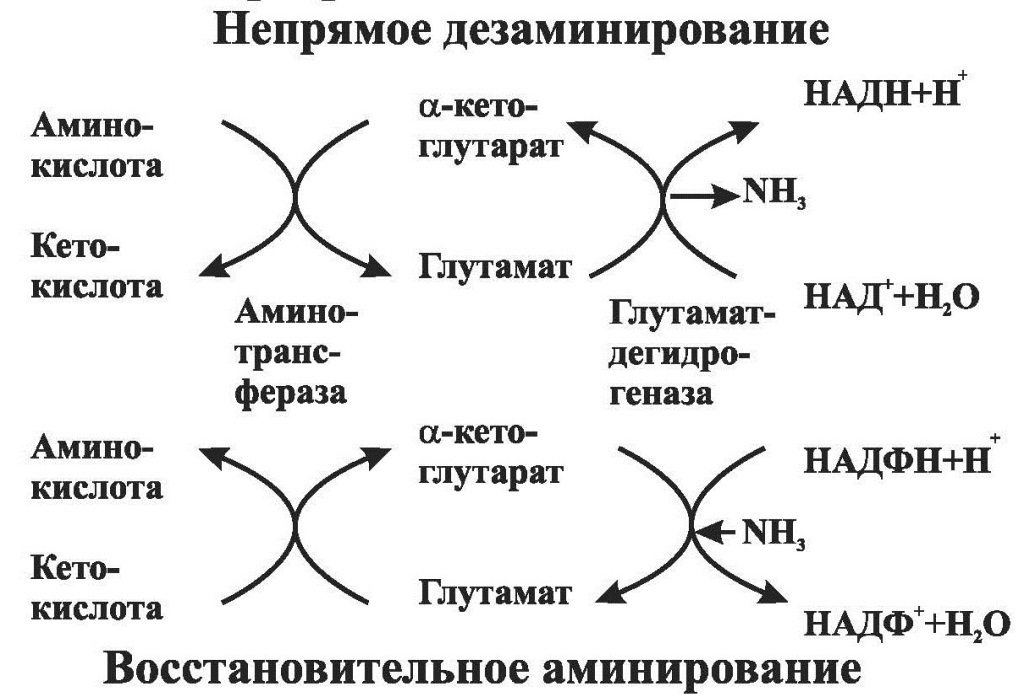
Значение переаминирования: переаминирование – первая стадия непрямого дезаминирования большинства аминокислот, т.е. начальный этап их катаболизма. Образующиеся при этом кетокислоты окисляются в ЦТК или используются для синтеза глюкозы и кетоновых тел. Переаминирование – это заключительный этап синтеза заменимых аминокислот из соответствующих кетокислот, если они в данный момент необходимы клеткам (рис.15). Дезаминирование аминокислот – реакция отщепления a-аминогруппы от аминокислоты, в результате чего образуется a-кетокислота (безазотистый остаток) и выделяется молекула аммиака. Дезаминирование бывает окислительным и непрямым. Окислительному дезаминированию подвергается глутамат. Реакцию катализирует глутаматдегидрогеназа, коферментом которой является НАД. Реакция протекает в 2 этапа: сначала происходит ферментативное дегидрирование глутамата с образованием иминоглутаровой кислоты, затем – неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется a-кетоглутарат. Глутаматдегидрогеназная реакция обратима и при повышении концентрации аммиака в клетке может протекать в обратном направлении, как восстановительное аминирование a-кетоглутарата. Глутаматдегидрогеназа является регуляторным ферментом. Ее аллостерически ингибируют АТФ, ГТФ, НАДН. Высокие концентрации АДФ активируют фермент. Таким образом, низкий энергетический уровень в клетках стимулирует разрушение аминокислот и образование a-кетоглутарата, поступающего в ЦТК как энергетический субстрат. Непрямое дезаминирование. Большинство аминокислот не способно дезаминироваться в одну стадию, подобно глутамату. Аминогруппы таких аминокислот в результате переаминирования переносятся на a-кетоглутарат с образованием глутамата, который затем подвергается прямому окислительному дезаминированию. Такой механизм дезаминирования аминокислот в 2 стадии получил название непрямого дезаминирования. Оно протекает при участии 2 ферментов: аминотрансфераз и глутаматдегидрогеназы.
|
|||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 534; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.255.162 (0.01 с.) |