Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Пентозофосфатный путь превращения глюкозы
Функционирует в цитозоле клетки с пластической целью, то есть его главные продукты – рибозо-5-фосфат и НАДФН используются для синтезов. Пентозофосфатный путь (ПФП) может протекать в двух вариантах – окислительного и неокислительного. Окислительный вариант включает 2 реакции дегидрирования, катализируемых НАДФ-зависимыми дегидрогеназами. Суммарное уравнение окислительного варианта можно представить в таком виде: Глюкозо-6-фосфат + 2 НАДФ+Рибозо-5-фосфат + 2 НАДФН+ 2Н+ +СО2 Неокислительный вариант ПФП включает серию обратимых реакций, катализируемых транскетолазой и трансальдолазой, первая в качестве кофермента использует ТПФ. В качестве промежуточных соединений в этом варианте образуются углеводы, содержащие от 3 до 7 атомов углерода. В этом варианте нет реакций дегидрирования, поэтому он используется только для синтеза пентоз. Суммарное уравнение реакций неокислительного варианта: 5 глюкозо-6-фосфат d xGqxaTalFPVUhLaC9DZNpklodjZkt0n67x296OXB8B7vfZMuR9uonjpfOzYQTyJQxLkrai4NfO7f Hl5A+YBcYOOYDFzJwzK7vUkxKdzAW+p3oVRSwj5BA1UIbaK1zyuy6CeuJRbv5DqLQc6u1EWHg5Tb Rj9G0UxbrFkWKmxpXVF+3l2sgfcBh9U0fu0359P6etg/f3xtYjLm/m5cLUAFGsNfGH7wBR0yYTq6 CxdeNQbkkfCr4j3N56COkpnOQGep/s+efQMAAP//AwBQSwECLQAUAAYACAAAACEAtoM4kv4AAADh AQAAEwAAAAAAAAAAAAAAAAAAAAAAW0NvbnRlbnRfVHlwZXNdLnhtbFBLAQItABQABgAIAAAAIQA4 /SH/1gAAAJQBAAALAAAAAAAAAAAAAAAAAC8BAABfcmVscy8ucmVsc1BLAQItABQABgAIAAAAIQDM 8JGgwQIAAJcGAAAOAAAAAAAAAAAAAAAAAC4CAABkcnMvZTJvRG9jLnhtbFBLAQItABQABgAIAAAA IQBECXWc2wAAAAMBAAAPAAAAAAAAAAAAAAAAABsFAABkcnMvZG93bnJldi54bWxQSwUGAAAAAAQA BADzAAAAIwYAAAAA "> 6 рибозо-5-фосфат Роль ПФП определяется его конечными продуктами: рибозо-5фосфатом и НАДФН. Рибозо-5-фосфат необходим для синтеза нуклеотидов, а затем и нуклеиновых кислот (ДНК и РНК). Быстрый синтез ДНК происходит в быстро делящихся тканях: красный костный мозг, эмбрион, базальный слой эпителия кожи, слизистая тонкого кишечника и др. Также рибозо-5-фосфат необходим для синтеза РНК и далее биосинтеза белка – в печени, экзокринных железах, синтезирующих белок на экспорт, а также усиленный синтез белка происходит при гипертрофии тканей. При этом у взрослого человека есть ткани, которые практически не делятся, а значит, в них ПФП неактивен. Но и в этих тканях ПФП может активироваться, например, при процессах репарации. Другой продукт ПФП – НАДФН необходим для реакций гидроксилирования и для восстановительных биосинтезов. Он активно используется для биосинтеза жирных кислот в жировой ткани, в печени; для синтеза холестерина (печень), для синтеза стероидных гормонов в эндокринных железах, для реакций гидроксилирования эндогенных веществ и ксенобиотиков. В эритроцитах НАДФН необходим для работы антиоксидативной системы, что обеспечивает их устойчивость к гемолизу.
ГОМЕОСТАЗ ГЛЮКОЗЫ КРОВИ
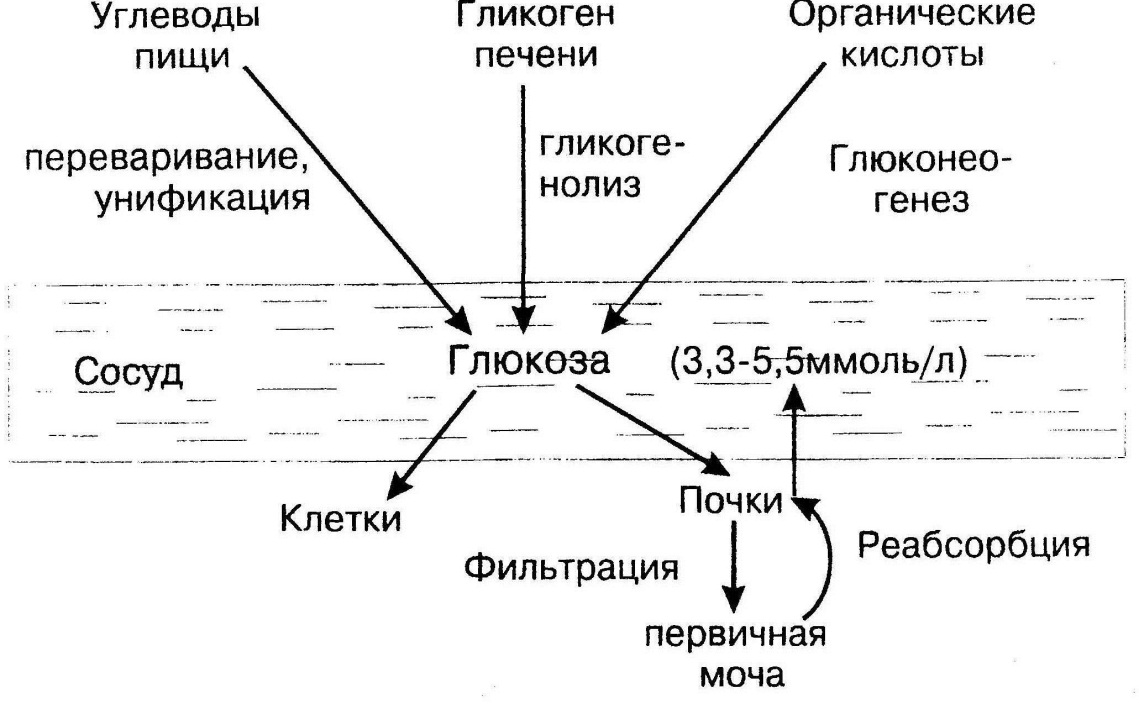
Уровень глюкозы крови поддерживается на постоянном уровне за счет того, что пути поступления глюкозы в кровь и пути расходования глюкозы крови между собой сбалансированы. При этом в течение суток уровень глюкозы не является одинаковым, но у здорового человека эти колебания лежат в пределах нормы (3,3 – 5,5 ммоль/л). Источниками глюкозы крови являются: углеводы пищи, гликоген печени и органические кислоты, которые в результате глюконеогенеза превращаются в глюкозу. Расходуется глюкоза крови всеми клетками организма, при этом в одни клетки глюкоза поступает диффузно (например, головной мозг), а в другие – с помощью инсулина. Кроме того, глюкоза из крови в результате фильтрации попадает в первичную мочу, но затем в результате реабсорбции она возвращается в сосудистое русло (рис. 6).
Рис.6. Гомеостаз глюкозы крови
В регуляции уровня глюкозы крови принимают участие гормоны. Гормоны делятся на гипогликемические, т.е. снижающие уровень глюкозы крови, и гипергликемические, т.е. повышающие уровень глюкозы крови. Единственным гипогликемическим гормоном является инсулин. Гипергликемическими гормонами являются: глюкагон, катехоламины (адреналин и норадреналин), ГКС и соматотропный гормон (СТГ). При гипергликемии (повышении глюкозы крови, которое может быть вызвано алиментарной причиной, сахарным диабетом, стрессом, некрозом поджелудочной железы, избытком гипергликемических гормонов) усиливается выработка инсулина, который за счет своих эффектов снижает уровень глюкозы крови. Это происходит за счет усиления потребления глюкозы тканями (в связи с увеличением проницаемости мембран для глюкозы в мышечной, жировой и соединительной тканях, усилением синтеза гликогена, гликолиза и пентозофосфатного пути), а также за счет торможения поступления глюкозы из тканей в кровь (в результате торможения распада гликогена и торможения глюконеогенеза).
При гипогликемии (снижении уровня глюкозы крови, которое может быть вызвано алиментарной причиной, патологией печени и ЖКТ, избытком инсулина, при алкоголизме и др.) усиливается выработка гормонов гипергликемических, которые повышают уровень глюкозы крови. Это обусловлено усилением глюконеогенеза и распада гликогена, торможением синтеза гликогена и гликолиза. СТГ при этом действует опосредованно, путем усиления секреции глюкагона. ОБМЕН ЛИПИДОВ ПЕРЕВАРИВАНИЕ И ВСАСЫВАНИЕ Липиды обеспечивают 30% от калорийности рациона (при этом каждая группа жирных кислот – насыщенные, мононенасыщенные и полиненасыщенные – по 10%), что при суточной калорийности в 2000-3000 ккал составляет 70-100 г. Полиненасыщенные жирные кислоты (ПНЖК) не синтезируются в организме и обязательно должны поступать с пищей. Их источниками являются растительные масла и жиры морепродуктов. ПНЖК по месту расположения первой двойной связи, считая с гидрофобного конца цепи, делятся на две группы: w-3 и w-6. Подсолнечное, кукурузное и хлопковое масла являются источником w-6 кислот (линолевой и арахидоновой). Соевое, конопляное и льняное масла содержат как w-6, так и w-3 кислоты (линоленовую и эйкозапентаеновую). Растительные масла содержат цис-ПНЖК, которые необходимы для синтеза фосфолипидов, обеспечивающих полноценность мембран, для образования эйкозаноидов и липидных вторых посредников. Кроме того, они полезны для профилактики атеросклероза и ИБС. Переваривание жиров у взрослых происходит в тонком кишечнике при участии липазы поджелудочной железы. Липаза действует только на эмульгированный жир, поэтому перевариванию предшествует процесс эмульгации (дробление крупной липидной капли на мелкие), который осуществляется при участии желчных кислот, входящих в состав желчи. Жиры под действием липазы расщепляются на глицерин и жирные кислоты. Глицерин всасывается свободно, жирные кислоты образуют при участии желчных кислот мицеллы. Снаружи мицеллы находятся гидрофильные группы желчных кислот, а внутри – гидрофобные жирные кислоты. Мицелла путем пиноцитоза попадает в кишечную стенку, где распадается на жирные и желчные кислоты. Желчные кислоты с кровью снова приносятся в печень, откуда вместе с желчью опять попадают в кишечник. А из жирных кислот и глицерина в кишечной стенке происходит ресинтез жира. Из этого жира в кишечной стенке происходит образование транспортной формы экзогенных жиров – хиломикронов. Гидрофобные липиды не могут самостоятельно транспортироваться по крови, т.к. это бы привело к жировой эмболии. Хиломикроны являются одним из классов липопротеидов, которые осуществляют транспорт гидрофобных липидов по водным средам. Хиломикроны через лимфатические капилляры попадают в грудной лимфатический проток, а затем в кровь. В крови на них действует фермент липопротеинлипаза, которая расщепляет входящий в состав хиломикрона жир на глицерин и жирные кислоты, используемые тканями. Остатки хиломикронов поступают в печень, где используются для синтеза других классов липопротеидов. При нарушении переваривания липидов развивается стеаторея (жирный кал). Причинами этого наиболее часто является дефицит панкреатической липазы и дефицит желчи (например, при желчнокаменной болезни).
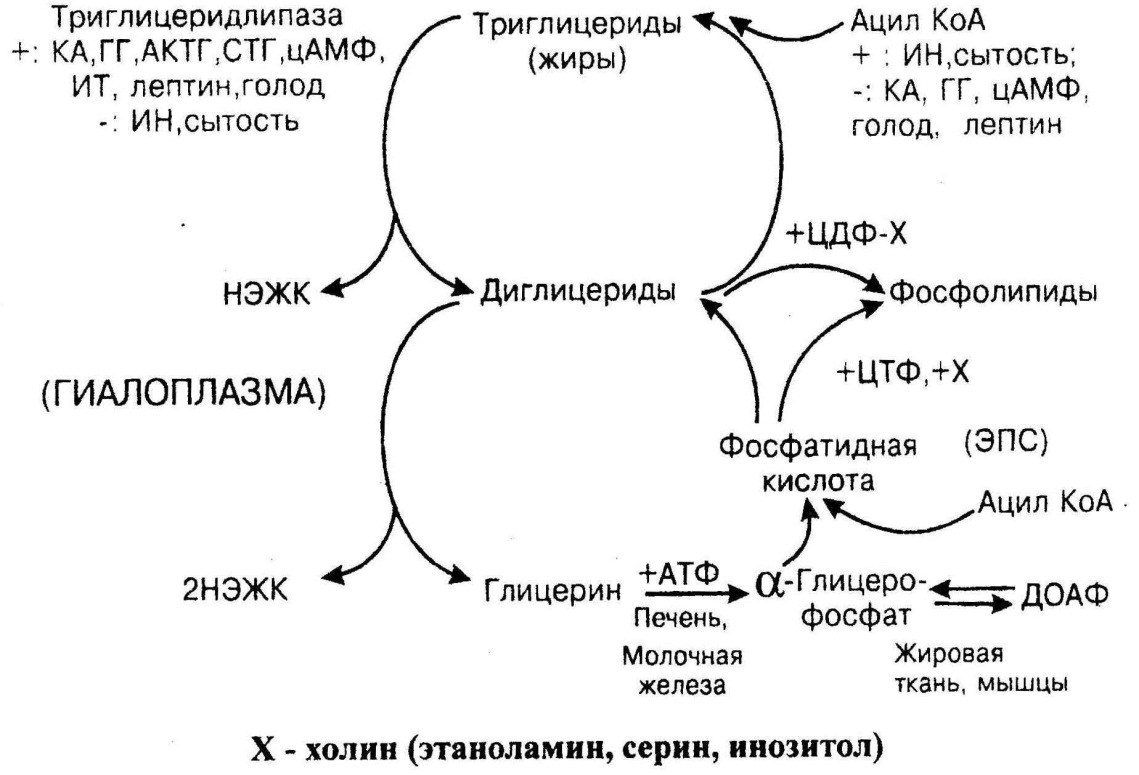
ОБМЕН ЖИРА Включает в себя два противоположных процесса: липолиз и синтез жира. Липолиз – это распад эндогенных жиров. Распад жира происходит при голодании и стрессе. Гидролиз внутриклеточных жиров происходит поэтапно. Сначала на триглицерид действует фермент триглецеридлипаза (ТГЛ), который отщепляет жирную кислоту у первого атома углерода глицерина. На образовавшийся при этом диглицерид действует диглицеридлипаза, которая отщепляет жирную кислоту у третьего углеродного атома глицерина. Образовавшийсямоноглицерид под действием моноглицеридлипазы, расщепляется до глицерина и жирных кислот. Существует два вида жировой ткани: белый и бурый. Белый жир находится в подкожной жировой клетчатке, сальнике, вокруг внутренних органов, он составляет 13-27% от массы тела. Белый жир снабжает жирными кислотами другие органы и ткани, т.е. после липолиза жирные кислоты выходят в кровь и в комплексе с альбуминами разносятся к органам и тканям. Бурый жир находится между лопатками, на шее, вдоль позвоночника, на его долю приходится 1-2% от массы тела. После липолиза бурого жира жирные кислоты не выходят в кровь, а подвергаются окислению непосредственно в митохондриях бурого жира. Здесь жирные кислоты выступают в роли разобщителей, поэтому большая часть энергии окисления жирных кислот выделяется в виде тепла. Отсюда функцией бурого жира является выработка тепла для обогревания спинного мозга, сердца. Ключевым ферментом липолиза является триглицеридлипаза. Липолиз усиливают катехоламины, глюкагон, СТГ, йодтиронины, АКТГ, лептин (гормон «худобы»). Тормозит липолиз гормон покоя и сытости – инсулин (рис.7).
Рис.7. Обмен жира
Синтез жиров происходит в состоянии покоя и сытости. Таким образом, инсулин усиливает этот процесс, а тормозят катехоламины, глюкагон, лептин. Наиболее активно синтез жиров происходит в жировой ткани и печени. Непосредственными субстратами в синтезе жиров являются активные формы жирных кислот – ацил-КоА и активная форма глицерина – глицерол-3-фосфат, который образуется разными путями в печени и жировой ткани. В печени глицерол-3-фосфат образуется путем фосфорилирования глицерина при участии глицеролкиназы. В жировой ткани этот фермент отсутствует, поэтому единственный путь образования глицерол-3-фосфата – это восстановление диоксиацетонфосфата – промежуточного метаболита гликолиза.
Жирные кислоты активируются до ацил-КоА при участии ацил-КоАсинтетазы, затем два ацил-КоА взаимодействуют с глицерол-З-фосфатом с образованием фосфатидной кислоты. Фосфатидная кислота после дефосфорилирования превращается в диацилглицерол, который ацилируется с образованием триацилглицерола, т.е. жира. Жир, синтезированный в печени, упаковывается в ЛПОНП и выносится из печени в кровь. Если синтез жиров в печени усилен, а образование ЛПОНП нарушено, то жир, синтезированный в печени, там остается, что приводит к ожирению печени. Избыточное накопление жира в адипоцитах – клетках жировой ткани (ожирение) широко распространено. Если индекс массы тела (вес в кг/ рост в м2) больше 27, то такое состояние считают ожирением. Первичное ожирение обычно является результатом дисбаланса –избыточной калорийности рациона по сравнению с расходами энергии. Т.е. причинами ожирения являются переедание, гиподинамия. Причиной ожирения может быть наличие «генов тучности» - это мутации в генах лептина и его рецепторах. Ожирение, развивающееся в результате какого-либо основного заболевания, чаще эндокринного, называют вторичным (например, ожирение при гипотиреозе). Гормон лептин продуцируется адипоцитами, под его влиянием снижается потребление пищи, синтез жира и увеличивается распад жира. С ожирением связывают меньшую продолжительность жизни, увеличение частоты таких заболеваний как атеросклероз, гипертония, сахарный диабет, ИБС, желчнокаменная болезнь. Кроме того, ожирение коррелирует с увеличенной частотой рака толстой кишки, молочных желез и эндометрия.
ОБМЕН ЖИРНЫХ КИСЛОТ
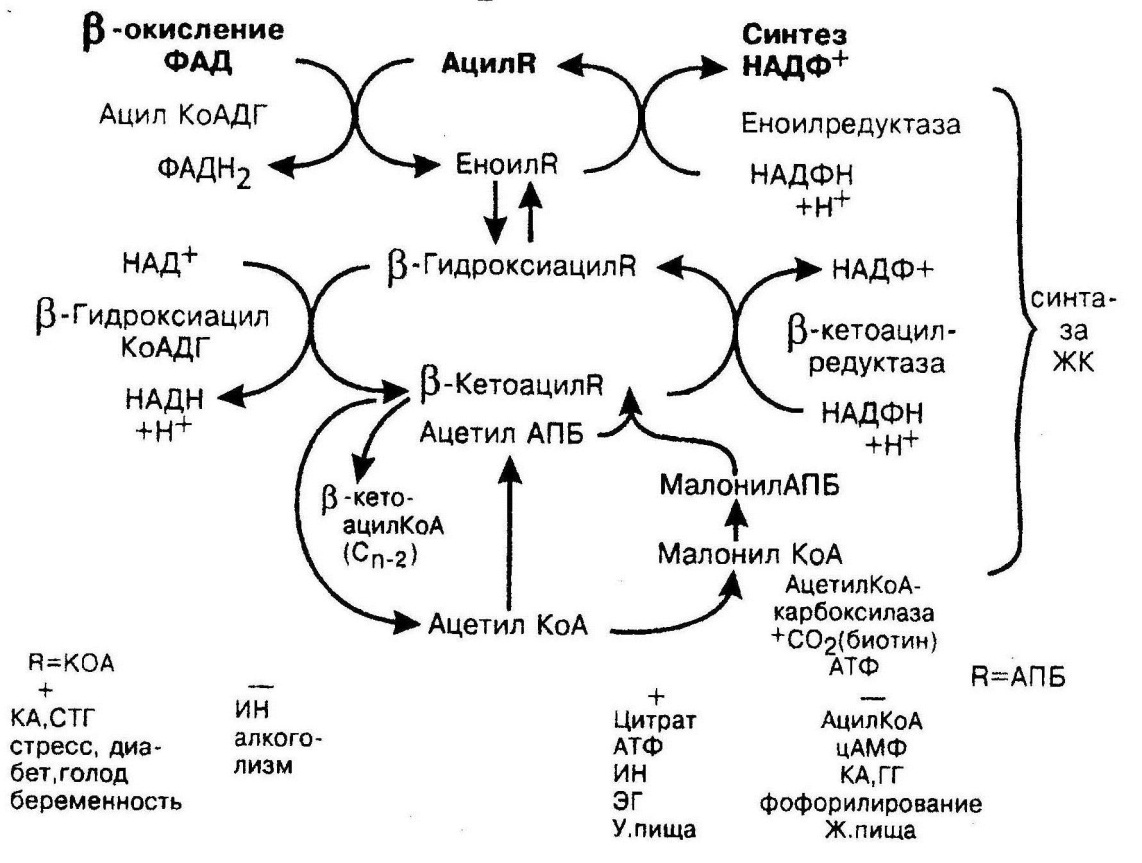
Окисление жирных кислот – важный источник энергии для многих тканей – сердечной мышцы, скелетных мышц, паренхиматозных органов. Не использует жирные кислоты как источник энергии головной мозг и эритроциты. Окисление жирных кислот можно представить как три этапа. Первый, протекающий в гиалоплазме, сводится к активации жирных кислот при участии ацил-КоА синтетаз. При этом образуется активная форма жирных кислот – ацил-КоА, процесс требует затраты энергии АТФ. Второй этап представляет собой транспорт жирной кислоты через митохондриальную мембрану при участии небелковой аминокислоты – карнитина. Третий этап протекает в митохондриях и представляет собой процесс b-окисления, главными ферментами этого процесса являются дегидрогеназы. Процесс этот протекает только в аэробных условиях, каждый цикл b-окисления повторяется многократно, при этом длина жирной кислоты становится меньше на два углеродных атома, которые отщепляются от жирной кислоты в виде ацетил-КоА. Атомы водорода из реакций, катализируемых дегидрогеназами, поступают в ДЦ, а ацетил-КоА сгорает в ЦТК, который также поставляет водороды в ДЦ. b-окисление (рис. 8) начинается с дегидрирования ацил-КоА ФАД-зависимой ацил-КоА дегидрогеназой с образованием еноил-КоА. В следующей реакции по месту двойной связи присоединяется молекула воды таким образом, что ОН-группа находится у b-углеродного атома, образуя b-гидроксиацил-КоА. Затем это соединение окисляется НАД+-зависимой дегидрогеназой. Образовавшийся b-кетоацил-КоА подвергается расщеплению ферментом тиолазой. В результате этой последовательности из 4 реакций от ацил-КоА отделяется два углеродных атома в виде ацетил-КоА. Жирная кислота, укороченная на 2 атома углерода, опять проходит последовательность из описанных 4 реакций. Эти циклы b-окисления повторяются с радикалом жирной кислоты до тех пор, пока вся кислота не превратится в ацетильные остатки.
Рис. 8. Обмен жирных кислот
При окислении пальмитиновый кислоты, содержащей 16 атомов углерода, процесс будет повторяться 7 раз, суммарный энергетический выход составляет 106 АТФ. Использование жиров как источника энергии необходимо при выполнении длительной работы в устойчивом режиме (бег стайера, перелетные птицы). При этом окисляются не только жирные кислоты, но и глицерин, освободившийся при липолизе. При этом глицерин активируется до глицерол-3-фосфата, последний окисляется до ДОАФ – метаболита гликолиза, который в аэробных условиях окисляется до СО2 и воды. Полное окисление глицерина дает 17,5 АТФ. Тогда молекула жира – трипальмитата дает 106+106+106+17,5=335,5 АТФ. Т.о., жиры более выгодный источник энергии, чем углеводы. Причем, если запасы гликогена обеспечивают организм энергией менее суток, то депонированный жир может обеспечивать организм энергией в течение длительного времени (50 суток). Синтез жирных кислот. Наиболее активно происходит в печени, жировой ткани, лактирующей молочной железе. Процесс протекает в гиалоплазме клеток. Источником углерода для синтеза жирных кислот служит ацетил-КоА. Процесс синтеза происходит путем наращивания длины жирной кислоты за счет малонил-КоА, который образуется из ацетил-КоА при участии фермента ацетил-КоА-карбоксилазы, АТФ и биотина. Этот фермент является регуляторным и он определяет скорость синтеза жирных кислот. В гиалоплазме происходит синтез пальмитиновой кислоты, реакции катализируются мультиферментным комплексом – синтазой жирных кислот, в котором роль переносчика ацилов выполняет не КоА, а ацилпереносящий белок (НS-АПБ). Поэтому сначала остаток уксусной и малоновой кислот переносится на НS-АПБ. Затем ацетильная группа конденсируется с остатком малонила по месту отделившегося СО2. Образовавшийся b-кетоацил-АПБ восстанавливается редуктазой, которая в качестве источника водорода использует НАДФН пентозного пути. Образовавшийся b-гидроксиацил-АПБ подвергается дегидратации, в результате чего образуется еноил-АПБ, который восстанавливается редуктазой. В результате образуется радикал жирной кислоты из 4 атомов углерода, связанный с ферментом. Во время второго цикла жирная кислота из 4 атомов углерода удлиняется на 2 атома за счет малонил-АПБ. Аналогичные циклы повторяются до тех пор, пока не образуется радикал пальмитиновой кислоты (всего 7 раз), который гидролитически отделяется от полиферментного комплекса, превращаясь в свободную пальмитиновую кислоту. Другие насыщенные жирные кислоты образуются из пальмитиновой кислоты путем элонгации (удлинения) в эндоплазматическом ретикулуме с участием малонил-КоА. Образование мононенасыщенных жирных кислот происходит из насыщенных в эндоплазматическом ретикулуме путем десатурации. В основном образуются С16:1 и С18:1. ПНЖК семейства w-3 и w-6 не синтезируются в организме, являются незаменимыми и обязательно должны поступать с пищей (С18:2, С 18:3).
ОБМЕН И РОЛЬ КЕТОНОВЫХ ТЕЛ
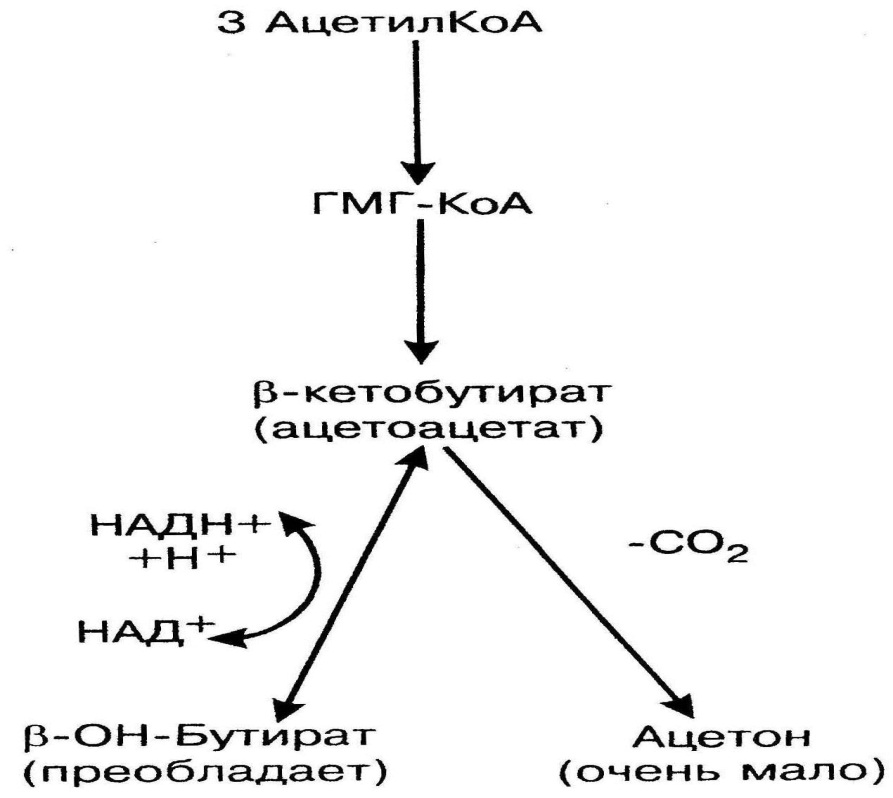
Синтез кетоновых тел происходит только в митохондриях печени (рис.9). Источником для синтеза кетоновых тел служит ацетил-КоА, образующийся при окислении жирных кислот. Таким образом, кетоновые тела – это вещества липидного происхождения, но в отличие от липидов, они являются веществами гидрофильной природы, поэтому в плазме транспортируются в свободном виде. При синтезе кетоновых тел из 3 молекул ацетил-КоА образуется b-гидрокси-b-мелилглутарил-КоА (ГМГ-КоА). Далее ГМГ-КоА-лиаза расщепляет ГМГ-КоА на ацетоацетат (b-кетобутират) – первое кетоновое тело и ацетил-КоА. b-кетобутират может восстанавливаться при участии НАДН до b-гидроксибутирата (второе кетоновое тело, преобладает в крови). При высокой концентрации ацетоацетата часть его неферментативно декарбоксилируется, превращаясь в ацетон. Ацетон не утилизируется тканями, выделяется с выдыхаемым воздухом, мочой, потом. Таким путем организм удаляет избыточное количество кетоновых тел, которые (кроме ацетона), являясь водорастворимыми кислотами, вызывают ацидоз. Кетоновые тела являются дополнительными источниками энергии при голоде и стрессе, особенно для головного мозга, который не использует жирные кислоты как источник энергии. Также кетоновые тела используют скелетные мышцы, сердце, почки. При этом b-кетобутират превращается в две молекулы ацетил-КоА, сгорающие в ЦТК и ДЦ (при этом каждая молекула ацетил-КоА дает 10 АТФ). Кроме того, кетоновые тела могут использоваться как субстраты для синтеза липидов головного мозга и периферических нервов.
Рис.9. Кетогенез В норме концентрация кетоновых тел в крови низкая (0,1 – 0,3 ммоль/л), но при ряде ситуаций она увеличивается, это называют гиперкетонемией, при этом избыток кетоновых тел выделяется с мочой – кетонурия. Все вместе называют термином кетоз. Кетозы бывают физиологическими (при голодании, тяжелой работе), патологическими (при лихорадках, неукротимой рвоте). Особой формой кетоза является диабетическая кома (концентрация кетоновых тел в крови может повышаться до 12-35 ммоль/л), при этом развивается кетоацидоз.
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 417; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.16.254 (0.029 с.) |