
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Модель атома Бора, ее недостатки. Постулаты Бора. Энергетические уровни атома водорода и его спектр по модели резерфорда – Бора.Содержание книги
Поиск на нашем сайте
1. Специальные состояния: Е1, Е2, Е3, … - уровни энергии. 2. Момент импульса: (волна де Бройля: 3. n,k – номера уровней энергии hν = Еn - Ek – Энергия излучается скачком, при переходе с одного энергетического уровня на другой n→k. Схема расчета:
Eп – полная энергия на уровне с номером n: Схема уровней энергий атома водорода (представлена на рис.):
Опыт: формула Бальмера:
Модель Бора отлично согласуется с опытом для одноэлектронных атомных систем. атом Н, водородоподобные ионы: He+; Li++.
Однако, для двухэлектронных и более сложных атомов теория Бора не работает. Эта теория приближенная. Заслуга теории Бора заключается в том, что она показала необходимость перехода от классических к квантовых представлениям. Сама модель Бора была полуклассической, полуквантовой. В настоящее время имеет только исторический интерес. Постулаты Бора: Первый постулат Бора (постулат стационарных состояний): в атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергии. Второй постулат Бора (правило частот): при переходе электрона с одной стационарной орбиты на другую излучается (поглощается) один фотон с энергией
28. Волновая модель атома водорода. Квантовые числа, их проявления в опыте. Периодическая таблица элементов Менделеева как отражение квантовых состояний электронов. Атом Н
Δ – оператор Лапласа
U – сферически-симметричная функция
n – главное квантовое число, n = 1,2,3,…,∞ - уровни энергии (квантование энергии)
l – азимутальное (орбитальное) квантовое число; l = 0,1,…, (n -1) n=1 → l=0 n=2 → l=1,2 и т.д. Квантование момента импульса:
m – магнитное квантовое число, связано орбитальным. m = -l,-(l-1),…, -1, 0, 1,…, l – всего (2 l +1) значение. Орбитальный момент электрона связан его магнитным моментом (электрон образует круговой ток). Во внешнем магнитном поле магнитная стрелка стремится повернуть вдоль поля.
Lz = hm.
Из УШ следует квантование энергии момента импульса и проекции момента импульса, что подтверждается в опыте, т.е. в спектре излучения атома. Квантование энергии – спектр линейчатый; квантование момента импульса и его проекции проявляются в том, что под действием внешнего магнитного поля спектральные линии расщепляются на m -близких линий. Опыт показал, что даже в отсутствии поля спектральные линии являются дублетами (двойными), что свидетельствует еще об одном квантовом числе S. S = ±1/2 (2 значения). S – спиновое квантовое число. Электрон обладает собственным механическим и магнитным моментами. Собственный механический момент называется спин. Классическая аналогия:
Состояние электрона в атоме: (n, l, m, S). Периодическая система Менделеева отображает периодичность свойств разных элементов. Объяснение тому дает квантовая механика. Электроны подчиняются принципу Паули. 1. Паули: n, l, m, S – только один электрон. 2. Принцип минимума Е В многоэлектронных атомах заполнение электронных оболочек идет снизу вверх. n =1, l =0, m =0, S =±1/2 2 состояния (H, He);
Квантовая механика – основа химии.
|
||||
|
Последнее изменение этой страницы: 2017-01-23; просмотров: 432; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.203.195 (0.006 с.) |

 Модель планетарная (ядерная) + постулаты Бора
Модель планетарная (ядерная) + постулаты Бора , n =1,2,3,…– номер стационарного состояния, орбиты.
, n =1,2,3,…– номер стационарного состояния, орбиты. , 2 πr=λn – Бор не знал!)
, 2 πr=λn – Бор не знал!) rn, υn
rn, υn - характер притяжения
- характер притяжения

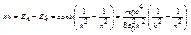 - Теория.
- Теория.
 Полное совпадение опыта и теории!
Полное совпадение опыта и теории! , где Z – порядковый номер элемента (заряд ядра); R – постоянная Ридберга.
, где Z – порядковый номер элемента (заряд ядра); R – постоянная Ридберга. равной разности энергий соответствующих стационарных состояний (En и Em энергии до и после излучения (поглощения)).
равной разности энергий соответствующих стационарных состояний (En и Em энергии до и после излучения (поглощения)).





 (как в модели Бора)
(как в модели Бора) - на одном и том же уровне энергии могут быть электроны с различными моментами импульса.
- на одном и том же уровне энергии могут быть электроны с различными моментами импульса. m – проекция Lz, z – ось, заданная внешним полем, например
m – проекция Lz, z – ось, заданная внешним полем, например  .
.




