
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ионное произведение воды. Понятие рн
Вода является очень слабым электролитом и сама в себе диссоциирует на ионы: Н2О Образовавшиеся ионы водорода в воде не существуют в свободном виде, а каждый из них соединяется с одной молекулой воды с образованием катиона оксония: Н+ + Н2О В дальнейшем будем говорить об ионе водорода, подразумевая при этом катион оксония. Константа диссоциации воды при 220С равна: Кд = Поскольку из 555 млн. молекул воды на ионы диссоциирована только одна, то величина [ H2O ] практически равна общей молярной концентрации воды. Ее находят, поделив массу 1 л воды на молярную массу воды, то есть [ H2O ] = 1000 г/л: 18 г/моль = 55,56 моль/л Подставляя это значение в выражение константы диссоциации, получают [ H+ ]∙[ OH– ] = Кд [ H2O ] = 1,8 ž10–16 ž55,56 = 10–14 Выражение КW = [ H+ ]∙[ OH– ] = 10–14 называется ионным произведением воды. Оно показывает, что в водных растворах существует жесткая взаимосвязь между концентрациями ионов водорода и гид-роксид ионов. Среди всех катионов ион водорода занимает особое место тем, что это единственный ион, который не имеет электронной оболочки, то есть представляет собой “голое” ядро. В результате он обладает очень маленьким размером и аномально высокой плотностью положительного заряда. Образование катиона оксония сопровождается выделением значительного количества энергии – 460,2 кДж/моль, что в некоторой степени сглаживает “агрессивность” иона водорода. Однако реакционная способность катиона оксония все же остается на относительно высоком уровне. Поэтому малейшее изменение концентрации ионов водорода может привести к существенному изменению скорости химических и, особенно, биохимических процессов. Из ионного произведения воды следует, что в нейтральных водных растворах [ H+ ] = [ OH– ] =
рН = – lg [H+], где [H+] – концентрация ионов водорода в водном растворе, моль/л. В нейтральных водных растворах рН = 7, в кислых – рН<7, а в щелочных – рН>7. В растворах, встречающихся на практике, значение рН находится в интервале от 0 до 14. Растворы, у которых рН меньше 0, можно называть сверхкислыми, а с рН>14 – сверхще-лочными. Обычно для таких растворов используют другие количественные показатели кислотности – функции кислотности растворов, которые здесь не рассматриваются. Наряду с рН пользуются параметром рОН – показателем основности водных растворов рОН = –lg [OH–], где [OH–] – концентрация гидроксид ионов в водном растворе, моль/л. Из ионного произведения воды следует: рН + рОН = 14 Для водных растворов различают общую и активную кислотность (или основность). Общая кислотность (основность) определяется нормальной концентрацией (С Н) растворов кислот (оснований). Активная кислотность (основность) определяется молярной концентрацией ионов водорода (гидроксид ионов). Поэтому параметры рН и рОН являются показателями активной кислотности и активной основности. Активную кислотность можно измерить колориметрически, т.е. с использованием различных индикаторов или универсального инди-катора. О значении рН судят по изменению окраски индикатора. Более точные измерения рН растворов проводят на специальных приборах – потенциометрах, которые называются рН- метрами. Эти приборы позволяют определять рН окрашенных и мутных растворов, что невозможно осуществить колориметрическим методом. При выращивании различных культур необходим строгий контроль показателя кислотности почвы рН. Для большинства растений оптимальными являются значения рН почвы, находящиеся в слабокислой области. Если почва становится кислым, то проводят его известкование. При этом значение рН возрастает (кислотность уменьшается). Если реакция почвенного раствора щелочная, то проводят гипсование, что приводит к уменьшению значения рН (кислотность увеличивается). В биологических исследованиях совершенно бессмысленно предпринимать попытку изучения целых клеток, субклеточных структур, выделять и охарактеризовать очищенные биомолекулы, не контролируя рН.
БУФЕРНЫЕ РАСТВОРЫ
Большинство органических соединений в живых организмах являются полифункциональными соединениями, и существуют в виде ионов. В зависимости от знака заряда бывают органические катионы, органические анионы и так называемые цвиттер ионы, которые несут одновременно одинаковые по величине положительные и отрицательные заряды. Существование полифункционального соединения в форме катиона, аниона или цвиттер иона зависит от рН раствора. Из-за того, что рН раствора определяет форму существования органических ионов, вполне логично, что живые организмы способны препятствовать чрезмерным колебаниям значений рН во внутриклеточной и межклеточной жидкостях. Это достигается с помощью буферных систем. Буферные растворы – это растворы, поддерживающие определенную концентрацию ионов водорода (рН) при разбавлении и незначительно изменяющие ее при добавлении небольших количеств сильных кислот и оснований. Состав буферных систем. В составе буферных систем небхо-димо наличие двух компонентов – донора протона и акцептора протона. В зависимости от этого различают буферные системы трех типов: 1-й тип – содержащие смесь слабой кислоты и ее соль от сильного основания (щелочи); 2-й тип – содержащие слабое основание и его соль от сильной кислоты; 3-й тип – содержащие полифункциональные соединения, в которых одни функциональные группы играют роль донора протона, а другие – акцептора протона. В качестве примера можно привести следующие буферные сис-темы: 1-й тип: СН3СООН + СН3СООNa — ацетатный буфер; Н2СО3 + NaHCO3 — гидрокарбонатный буфер; NaH2PO4 + Na2HPO4 — фосфатный буфер. В последнем примере дигидрофосфат натрия играет роль слабой кислоты, а гидрофосфат натрия – роль ее соли. 2-й тип: NH4OH + NH4Cl — аммиачный буфер. 3-й тип: НООССН(ОН)СН(ОН)СООК — гидротартратный буфер Н2N(CH2)nCH(NH2)COOH — аминокислотный буфер (H2N)mPt(COOH)n — белковый буфер, где под (NH2)m и (СООН)n подразумеваются аминогруппы и карбоксильные группы боковых цепей полипептида Pt Механизм действия. Для буферных систем 1-го типа механизм действия заключается в протекании следующих реакций: – при добавлении сильных кислот: СН3СООН + СН3СООNa + HCl то есть имеющаяся в системе соль реагирует с сильной кислотой, образуя слабую кислоту с незначительной степенью диссоциации, в результате чего происходит только небольшое изменение рН раствора; – при добавлении сильных оснований: CH3COOH + CH3COONa + NaOH то есть имеющаяся в системе слабая кислота реагирует с добавленным сильным основанием, образуя соль и воду, что приводит также только к незначительному изменению рН раствора. В буферных системах 2-го типа протекают следующие реакции: – при добавлении кислот: NH4OH + NH4Cl + HCl – при добавлении сильных оснований: NH4OH + NH4Cl + NaOH В буферных системах 3-го типа в зависимости от природы функциональных групп возможны различные варианты механизмов буферного действия. Например, гидротартратный буфер работает следующим образом: – при добавлении кислот: НООССН(ОН)СН(ОН)СООК+НCl + KCl – при добавлении щелочей: НООССН(ОН)СН(ОН)СООК+КOH + H2O При работе белкового буфера в зависимости от рН среды роль донора протона может играть (т.е. реагировать с щелочью) как груп-па –СООН, так и протонированная аминогруппа –NH
рН буферных систем. При выводе формулы для вычисления рН буферных систем 1-го типа исходят из константы диссоциации слабой кислоты, которая для уксусной кислоты имеет вид: Кд = Это равенство также справедливо для раствора уксусной кислоты, в котором кроме нее могут присутствовать ионы Н+ и ионы СН3СОО– от других соединений. В ацетатном буферном растворе кроме уксусной кислоты присутствует еще ацетат натрия, который полностью диссоциирован. Это приводит к значительному увеличению концен-трации ионов СН3СОО– и сдвигает равновесие диссоциации уксусной кислоты в сторону реакции молизации. Поэтому уравнение констан-ты диссоциации можно преобразовать с учетом следующих соотно-шений: [ CH3COOH ] Отсюда [ H+ ] = Кд∙ и после логарифмирования обеих частей уравнения и изменения зна-ка логарифма на противоположный, получается –lg [H+] = –lg Kд – lg или рН = р Кд + lg где р Кд = –lg Кд, а Кд – константа диссоциации слабой кислоты бу-ферной системы 1-го типа при данной температуре. В более общем виде уравнение можно записать как рН = р Кд + lg где псоль и пкисл. – число молей соли и кислоты в буферном растворе. Из последнего выражения следует, что если буферный раствор приготовлен путем смешения растворов соли Vсоль и кислоты Vкисл. одинаковой концентрации, то рН = р Кд + lg Вывод уравнения для буферных систем 2-го типа производится аналогичным образом и в результате получается: рОН = р Кд + lg где С соль– молярная концентрация соли в буферном растворе; С осн.– молярная концентрация слабого основания в буферном растворе; р Кд = –lg Кд; Кд – константа диссоциации слабого основания при дан-ной температуре. Последнее соотношение дает формулу для вычисления рН бу-ферных систем 2-го типа: рН = 14 –р Кд + lg Если буферный раствор получен путем смешения растворов одинаковой концентрации, то рН = 14 – р Кд + lg Для буферных систем 3-го типаможно написать следующую формулу для определения рН их растворов:
рН = р Кд + lg где Кд –константа диссоциации функциональной группы, являющейся донором протона; С дон – молярная концентрация функциональной группы – донора протона; С акц. – молярная концентрация функцио-нальной группы – акцептора протона. На практике часто возникает необходимость приготовления бу-ферного раствора с заданным значением рН. Его удобно готовить пу-тем смешения отдельных растворов одинаковой концентрации. Нужное значение рН достигается путем изменения соотношения объемов смешиваемых растворов. Например, для приготовления ацетатного буферного раствора можно взять 0,1 М раствор СН3СООН и 0,1 М раствор СН3СООNa. Буферная емкость. При рассмотрении механизма буферного действия было показано, что при добавлении в буферный раствор сильной кислоты в реакцию с ней вступает компонент, играющий роль акцептора протона, а при добавлении щелочи – компонент, играющий роль донора протона. Поэтому в буферной системе рН будет изменяться незначительно только до тех пор, пока в ней имеется запас того компонента, который реагирует с добавляемой кислотой или щелочью. Например, при добавлении в аммиачный буферный раствор сильной кислоты действие системы против подкисления продолжается до тех пор, пока не прореагирует весь NH4OH, после чего добавление даже небольшого количества кислоты вызывает резкое уменьшение рН раствора. Следовательно, буферные растворы обладают определенной “емкостью”. Буферная емкость – это количество моль-экв. сильной кислоты или щелочи, которое необходимо добавить к 1 л буферного раство-ра,чтобы изменить его рН на единицу. Если разбавление буферного раствора не влияет заметно на изменение рН, то оно существенно отражается на буферной емкости. Чем выше концентрация буферного раствора, тем больше буферная емкость. На практике обычно употребляют буферные растворы с суммарной концентрацией компонентов от 0,05 до 0,1 н. Они устойчивы примерно в пределах рН = рКд Буферная емкость также зависит от соотношения компонентов буферного раствора. Например, если в ацетатном буферном растворе концентрация СН3СООН выше концентрации СН3СООNa, то его буферная емкость по щелочи будет высокой, а по сильной кислоте – низкой. Поэтому в буферных растворах максимальная буферная емкость достигается при соотношении концентрации компонентов, равном единице.
ЭЛЕКТРОХИМИЯ РАСТВОРОВ ОБЩИЕ СВЕДЕНИЯ
Электрохимия – это раздел физической химии, изучающий физико-химические процессы, которые сопровождаются появлением электрического тока, или, наоборот, возникают под воздействием электрического тока на химические соединения. Из определения электрохимии вытекает, что она состоит из двух частей. В первой части рассматриваются закономерности физико-химических процессов, вызванных действием электрического тока на растворы и расплавы – электролиз и электропроводность. Во второй части изучаются закономерности возникновения электродных потенциалов и электрического тока в результате протекания физико-химических процессов.
Поскольку при работе химических источников тока приходится сталкиваться с явлением проводимости растворами электрического тока, сначала необходимо рассматривать закономерности электропроводности растворов.
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-26; просмотров: 273; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.189.247 (0.045 с.) |
 Н+ + ОН–
Н+ + ОН– Н3О+
Н3О+ = 1,8 ž10–16
= 1,8 ž10–16 = 10–7 моль/л, в кислых растворах – [ H+ ]>[ OH– ] ([ H+ ] может быть 10–6, 10–4 и т.д.), а в щелочных растворах [ H+ ]<[ OH– ] ([ H+ ] может быть 10–8, 10–11 и т.д.). Из приведенных выше данных следует, что в растворах, встречающихся в практической деятельности, концентрация ионов водорода составляет очень маленькую величину, и оперировать этой величеной зачастую бывает неудобно. Поэтому на практике пользуются параметром рН – показателем кислотности водных растворов.
= 10–7 моль/л, в кислых растворах – [ H+ ]>[ OH– ] ([ H+ ] может быть 10–6, 10–4 и т.д.), а в щелочных растворах [ H+ ]<[ OH– ] ([ H+ ] может быть 10–8, 10–11 и т.д.). Из приведенных выше данных следует, что в растворах, встречающихся в практической деятельности, концентрация ионов водорода составляет очень маленькую величину, и оперировать этой величеной зачастую бывает неудобно. Поэтому на практике пользуются параметром рН – показателем кислотности водных растворов. . В качестве акцептора протона может выступать (т.е. реагировать с кислотой) как группа –NH2, так и депротонированная карбоксильная группа –СОО–.
. В качестве акцептора протона может выступать (т.е. реагировать с кислотой) как группа –NH2, так и депротонированная карбоксильная группа –СОО–. .
.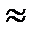 C кисл. и [ CH3COO– ]
C кисл. и [ CH3COO– ] 

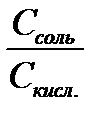 ,
, ,
,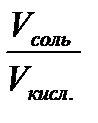
 ,
, .
. ,
, ,
, 1.
1.


