
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Влияние температуры на скорость
ХИМИЧЕСКИХ РЕАКЦИЙ
Скорость большинства химических реакций с увеличением температуры возрастает. Наиболее простое соотношение между температурой и скоростью реакции определяется правилом Вант-Гоф-фа: при повышении температуры на 10 градусов скорость химической реакции увеличивается в 2...4 раза. Математическая форма записи данного правила:
где Более точная зависимость константы скорости реакции от температуры описывается уравнением С.Аррениуса: k = A e где k – константа скорости реакции при температуре Т; R – универ-сальная газовая постоянная (R =8,31Дж/(град∙моль); А – предэкспо-ненциальный множитель; Физический смысл параметров А и N* = N 0 е где N* – число активных молекул; N 0 – общее число молекул в системе; Е*– минимальный уровень энергии активных молекул; R – универсальная газовая постоянная; Т – температура системы.
Рисунок 2 Распределение молекул системы по энергиям
Каждая активная молекула, сталкиваясь с неактивной молекулой, имеющей достаточной энергии для образования переходного состояния, может дать продукт реакции. Поэтому количество молекул, участвующих в химическом превращении Nхп, будет в два раза больше, то есть Nхп= 2 N* или Nхп = 2 N0 e Число молекул Nср, имеющих энергию Е Ncр=N0 e где Еср– средняя энергия всех молекул системы. Если принять N0= 2 Nср, получается выражение: N0= 2 N0 e Долю химически превращенных молекул Nхп от общего количества молекул в системе N0 находят, почленно поделив два полученных уравнения по отношению друг к другу:
или Nхп=N0 e где
Деление обеих частей последнего уравнения на произведение NAV t дает v=vmaxe где NA– число Авогадро; V – объем реакционной системы; t – время реакции; v – скорость реакции при данной температуре Т; vmax– максимально возможная скорость данной реакции, которая достигается в том случае, если каждое столкновение молекул является результативным, то есть дает продукт реакции. Сопоставление уравнения Аррениуса и последнего уравнения позволяет раскрыть физический смысл параметров А и Предэкспоненциальный множитель А – это максимально воз-можная константа скорости реакции, которая достигается в том случае, если каждое столкновение молекул является результатив-ным. Для мономолекулярных реакций значение его находится в интервале частоты колебания молекул 1012...1017 с-1, а для бимолекулярных реакций – 103...1010л/(моль∙с) Энергия активации( Обычно его относят на 1 моль одного из реагентов или на 1 моль одного из продуктов реакции. Для различных реакций она меняется примерно в пределах 40...300 кДж/моль. Если экспериментально определить константы скорости реакции k 1 и k 2 при двух разных температурах Т 1 и Т 2, то энергию активации ее можно вычислить по формуле:
Если известны энергия активации и константа скорости реакции при одной температуре, то используя это уравнение, расчетным путем можно определить константу скорости данной реакции при любой другой температуре. Для наглядного изображения изменения энергетических параметров системы по ходу реакции пользуются так называемой энергетической диаграммой химической реакции (рисунок 3). На этих диаграммах по оси абсцисс отложена условная координата, которая названа путь реакции.
Рисунок 3 Энергетическая диаграмма экзотермической реакции (а) и эндотермической реакции (б) Он имеет определенный физический смысл для каждой конкретной реакции. Упрощенно можно представить, что для реакции А + В
|
|||||||||||
|
Последнее изменение этой страницы: 2017-01-26; просмотров: 226; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.189.193.172 (0.006 с.) |
 =
=  ,
, и
и  – скорости реакции при температурах
– скорости реакции при температурах  и
и  ;
;  - темпе-ратурный коэффициент реакции (коэффициент Вант-Гоффа).
- темпе-ратурный коэффициент реакции (коэффициент Вант-Гоффа). ,
, Е – энергия активации реакции.
Е – энергия активации реакции. E*, определяется уравнением Максвелла-Больцмана:
E*, определяется уравнением Максвелла-Больцмана: 
 ,
,
 ,
, = e
= e 
 ,
, ,
,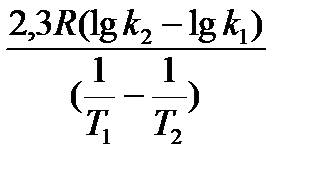 .
.

 D в начальнем участке оси абсцисс находятся исходные реагенты (А и В), в середине – переходное состояние А...В, образованное в момент столкновения, и в конце – продукт реакции D. Тогда
D в начальнем участке оси абсцисс находятся исходные реагенты (А и В), в середине – переходное состояние А...В, образованное в момент столкновения, и в конце – продукт реакции D. Тогда 


