
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общая характеристика коллоидных системСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Сами коллоидные системы по характеру взаимодействия между дисперсионной средой и дисперсной фазой делятся на две группы: лиофобные коллоиды и лиофильные коллоиды. Лиофобные коллоиды – это коллоидно-дисперсные системы, в которых частицы дисперсной фазы инертны по отношению к дисперсионной среде, то есть силы взаимодействия молекул дисперсионной среды с поверхностью частиц дисперсной фазы незначительны. Если в качестве дисперсионной среды использована вода, то такие системы называются гидрофобными коллоидами. Лиофобные коллоиды образуются как из органических, так и из нерганических веществ, нерастворимых в данной среде. Поверхность их частиц обладает значительной свободной энергией. Поэтому лиофобные золи являются термодинамически неустойчивыми системами, то есть стремятся соединиться друг с другом для того, чтобы освободиться от избыточной поверхностной энергии. Соединению частиц можно препятствовать, если создать условия для адсорбирования на их поверхности ионов. В результате подобной адсорбции частицы дисперсной фазы избавляются от некоторой части свободной поверхностной энергии и приобретают одноименные заряды, что создает условия для обеспечения устоичивости частиц к взаимному слипанию (агрегативная устойчивость). Частица лиофобного коллоида с адсорбированными ионами электролита-стабилизатора образует мицеллу. Лиофильные коллоиды характеризуются интенсивным взаимо-действием молекул дисперсионной среды с макромолекулами дис-персной фазы. В гидрофильных коллоидах дисперсионной средой является вода. В результате такого взаимодействия выделяется значительное количество энергии в виде теплоты ( Коллоидная система может существовать в жидком виде (золь) и потерять свою текучесть в результате образования межчастичных связей (гель). В последнем случае в объеме сохраняется равномерное распределение частиц дисперсной фазы.
ПОЛУЧЕНИЕ КОЛЛОИДНЫХ СИСТЕМ
Лиофобные золи. Размеры частиц коллоидных систем занимают промежуточное положение между размерами частиц моле-кулярно (ионно)-дисперсными и грубодисперсными системами. По-этому лиофобные золи можно получать либо путем конденсации мо-лекул или ионов молекулярно (ионно)-дисперсных систем, либо дис-пергированием частиц грубодисперсных систем. Метод диспергирования основан на раздроблении твердых частиц грубодисперсных систем до частиц коллоидного размера механическим размалыванием, электрическим распылением, действием ультразвука и пептизацией. Механическое размалывание осуществляется с помощью специальных коллоидных мельниц и шаровых мельниц. В коллоидных мельницах быстро вращающиеся лопасти отбрасывают крупные частицы твердой фазы с высокой скоростью на неподвижные выступы, расположенные на внутренней стенке корпуса мельницы, что приводит к разрушению частиц. В шаровых мельницах грубодисперсная система загружается в полый цилиндр, внутри которого находятся гладко отполированные стальные или фарфоровые шары. При вращении цилиндра частицы дисперсной фазы попадают между шарами и растираются до размеров коллоидных частиц. Электрическое распыление используется для получения золей пассивных металлов (Au, Ag, Pt и другие). Два электрода, изготовленные из металла, золь которого надо получить, опускают в дисперсионную среду (например, в воду) и создают между ними электрическую дугу. Металл испаряется до отдельных атомов, которые затем образуют агрегаты в объеме дисперсионной среды, имеющие размеры коллоидных частиц. При ультразвуковом методе колебания ультразвука с частотой 105...106 Гц создают внутри твердых частиц быстро сменяющиеся сжатия и расширения, что в результате приводит к разрушению крупной частицы с образованием частиц колоидных размеров. К методам диспергирования можно отнести пептизацию. Это процесс перехода частиц дисперсной фазы из состояния осадка во взвешенное состояние с образованием золя под действием особых веществ – пептизаторов. Катионы или анионы пептизатора адсорбируются на поверхности частиц свежеполученного рыхлого осадка. Частицы осадка приобретают одноименные заряды и переходят во взвешенное состояние, образуя золь. В данном случае разрушение частиц дисперсной фазы не происходит, а разрушаются только не очень прочные межчастичные связи. Метод конденсации. Различают физические и химические методы конденсации. При физическом методе осуществляют замену растворителя. Например, если к молекулярно-дисперсному раствору канифоли в спирте постепенно добавлять воду, то в полученном смешанном растворителе спирт-вода резко понижается растворимость смоляных кислот, из которых состоит канифоль. Молекулы этих кислот собираются в агрегаты, имеющие размеры коллоидных частиц. Химический метод конденсации основан на образовании нерастворимых веществ в результате различных химических реакций: окисления, восстановления, обменного разложения, гидролиза и другие. Частицы образующихся нерастворимых веществ стабилизируются путем адсорбции определенных ионов из раствора. Лиофильные золи. Лиофильные золи представляют собой растворы высокомолекулярных соединений (ВМС) и образуются самопроизвольно. Например, если поместить кусочек желатина в воду, то он сначала набухает, а затем постепенно растворяется. Набухание – это самопроизвольный процесс поглощения образцом ВМС низкомолекулярной жидкости – растворителя, приводящий к значительному увеличению объема и массы образца. Молекулы растворителя сольватируют макромолекулу, что приводит к отодвиганию их друг от друга и ослаблению сил взаимодействия между ними. Различают ограниченное и неграниченное набухание. Ограниченное набухание наблюдается при наличии химических связей между отдельными макромолекулами (например, резина). При ограниченном набухании достигается максимальная или равновесная степень набухания, не меняющаяся во времени. Степень набухания – это количество граммов жидкости, поглощенное одним граммом образца ВМС при ограниченном набухании. Процесс набухания экзотермичен, так как при сольватации макромолекулы выделяется теплота. Теплота набухания – это количество теплоты, выделившейся при ограниченном набухании одного грамма образца ВМС. В связи с тем, что поглощенная жидкость находится в более уплотненном состоянии, объем набухшего тела оказывается меньше суммы объема образца ВМС до набухания и объема поглощенной жидкости (явление контракции). Неограниченное набухание со временем приводит к образованию раствора ВМС. В данном случае можно говорить только о теплоте растворения. В большинстве случаев для процесса растворения ВМС
|
||
|
Последнее изменение этой страницы: 2017-01-26; просмотров: 791; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.137 (0.02 с.) |

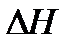 <0), что приводит к существенному уменьшению свободной поверхностной энергии и переходу системы в более стабильное состояние. Следовательно, в лиофильных коллоидах роль стабилизатора, обеспечивающего агрегативную устойчивость, играют молекулы дисперсионной среды. Поэтому лиофильные коллоиды образуются самопроизвольно и являются термодинамически устойчивыми системами.
<0), что приводит к существенному уменьшению свободной поверхностной энергии и переходу системы в более стабильное состояние. Следовательно, в лиофильных коллоидах роль стабилизатора, обеспечивающего агрегативную устойчивость, играют молекулы дисперсионной среды. Поэтому лиофильные коллоиды образуются самопроизвольно и являются термодинамически устойчивыми системами. H< 0. Кроме того, растворение сопровождается более беспорядочным расположением молекул в системе (
H< 0. Кроме того, растворение сопровождается более беспорядочным расположением молекул в системе (


