
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Материальный расчет ректификационной колонны второй ступени дистилляцииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Исходные данные: Давление, МПа 0,3 (3×105 Па) Потери карбамида, % от массы готового продукта 5 Содержание водяного пара в газовой фазе, выходящей из ректификационной колонны, % от объема сухих газов 30
Состав плава, приходящего на ректификацию, принимаем в соответствии с расчетом стриппер-аппарата. Принимаем также, что разложение карбамата аммония, отгонка аммиака и оксида углерода (IV) из плава будут полными. Масса карбамида, разложившегося при дистилляции: G’к = 1000×0,05 = 50 кг/т. При этом по реакции: СО(NH2)2 + H2O ® NH2COONH4 Образуется карбамата аммония: Gк.а.= и расходуется воды
Общая масса карбамата аммония, разлагающегося в колонне: SGк.а. = Gрк.а. + Gк.а. = 105,5+65 = 170,5 кг/т. При разложении карбамата аммония по реакции (51) выделяется:
Общая масса аммиака, выделяющегося в колонне: SGNH3 = GрNH3 + GNH3 = 74,63+74,32=148,95 кг/т. Объем NH3 и СО2, которые отгоняются из колонны:
где 101325 – давление при нормальных условиях, Н/м2; (273+110) – средняя температура отогнанных газов, К. Объем паров воды в газах, выходящих из колонны:
или при нормальных условиях
что соответствует
Общая масса аммиака и оксида углерода (IV), отгоняемых их колонны:
Масса воды, остающейся в растворе карбамида:
Масса воды на выходе из ректификационной колонны:
Масса раствора карбамида на выходе из ректификационной колонны:
Массовая доля карбамида в растворе:
Результаты расчета сведем в таблицу 13.
Таблица 13. – Материальный баланс ректификационной колонны
Тепловые расчеты
Колонна синтеза карбамида Исходные данные: Температура реагентов на входе в колонну, °С жидкий аммиак 5,0 СО2 35,0 Раствор УАС 167,0 Температура в колонне, °С 184,0 Критическая температура NH3, °С 132,4 Избыток NH3,% 125,0 Теплота образования карбамида из карбамата аммония при Т=184°С и избытке аммиака 125 %, Qк кДж 19030,0
Масса исходных реагентов и продуктов реакций принята в соответствии с материальным расчетом. Приход тепла 1. С газообразным СО2: Q1 = МСО2×iСО2 = 744,4×67=49874,8 кДж/т, где 67 – энтальпия СО2 при 35°С и 20 МПа, кДж/кг. 2. С другими газами, приходящими вместе с СО2: Q2 = mдр.×С×t = 11,53×1,026×35 = 414 кДж/т, где 1,026 – теплоемкость азота, кДж/(кг×К). 3. С жидким азотом: Q3 = А1× ipNH3 = 1418×23 = 32614 кДж/т, где 23 – энтальпия аммиака при 5°С, кДж/кг. 4. Теплота реакции образования карбамата аммония:
где V – теплота образования твердого карбамата аммония, кДж/моль; r – теплота плавления карбамата аммония, кДж/моль;
5. Теплота реакцити образования гидроксида аммония:
где
6. Физическая теплота растворения УАС при 167°С и 14 МПа
Суммарный приход теплоты:
Расход теплоты: 1. На образование карбамида:
2. На нагревание реагирующей части жидкого аммиака от 5°С до критической температуры 132,4° при 14 МПа:
3. На нагрев газообразного СО2 от 35 до 132,4°С:
4. На выделение СО2 из раствора аммонийных солей:
где 5. На нагрев СО2 из раствора аммонийных солей от 100 до 132,4°С:
6. На нагрев части карбамата аммония, превращающейся в карбамид от 132,4до 184°С:
где 7. Теплота, выносимая с плавом карбамида:
=2373541,9 кДж/т. 8. Потери тепла в окружающую среду (7,25%)
9. Суммарный расход тепла:
Таблица 14. Тепловой баланс синтеза на 1 т. Карбамида
Стрипер-аппарат Исходные данные: Температура плава, °С 180,00 Температура плава на выходе, °С 160,00 Температура СО2, °С 100,00
Приход тепла
1. С плавом карбамида (по тепловому расчету колонны синтеза)
2. С СО2
3. С греющим паром
4. Общий приход тепла
Расход тепла 1. С плавом карбамида:
2. на разложение карбамата аммония:
где 3. На выделение аммиака из гидроксида аммония:
4. с отходящими газами в результате дистилляции при 120°С
Суммарный расход тепла
2639132,2+Х=5793210,5 Х=5793210,5-2639132,2 = 3154078,3 кДж/т. Расход пара на стриппер-процесс составляет:
1953 – теплота парообразования греющего пара при 15×105 Н/м2, кДж/кг.
Таблица 15. Тепловой баланс стриппера
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 414; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.223.136 (0.006 с.) |

 кг/т
кг/т кг/т.
кг/т. кг/т NH3.
кг/т NH3. кг/т СО2.
кг/т СО2. м3/т;
м3/т; м3/т;
м3/т; м3/т;
м3/т; нм3/т,
нм3/т, кг/т.
кг/т. кг/т.
кг/т. кг/т.
кг/т.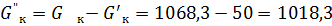 кг/т.
кг/т. кг/т.
кг/т. %.
%. кДж/т,
кДж/т, - мольная масса карбамата аммония.
- мольная масса карбамата аммония. кДж/т,
кДж/т, – интегральная теплота растворения 1 кмоля газообразного аммиака в 1 кмоле воды, кДж/кмоль;
– интегральная теплота растворения 1 кмоля газообразного аммиака в 1 кмоле воды, кДж/кмоль; – разница стандартных энтальпий жидкого и газообразного аммиака, кДж/кмоль.
– разница стандартных энтальпий жидкого и газообразного аммиака, кДж/кмоль. кДж/т,
кДж/т, кДж/т,
кДж/т, кДж/т,
кДж/т, кДж/т.
кДж/т.
 кДж/т.
кДж/т. 338829,15 кДж/т.
338829,15 кДж/т. кДж/т.
кДж/т.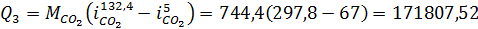 кДж/т.
кДж/т. кДж/т
кДж/т - теплота растворения СО2, кДж/т.
- теплота растворения СО2, кДж/т. кДж/т.
кДж/т. кДж/т,
кДж/т, – разница между образованным и непрореагировавшим карбаматом аммония, кг/т;
– разница между образованным и непрореагировавшим карбаматом аммония, кг/т;  - теплоемкость карбамата аммония, кДж/кг.
- теплоемкость карбамата аммония, кДж/кг.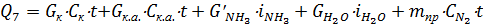

 кДж/т.
кДж/т.
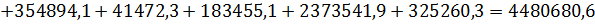 кДж/т.
кДж/т. кДж/т.
кДж/т. кДж/т.
кДж/т. .
. .
.
 кДж/т.
кДж/т. кДж/т
кДж/т кДж/т.
кДж/т.
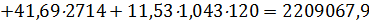 кДж/т.
кДж/т.
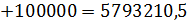 кДж/т.
кДж/т.
 кг/т,
кг/т,


