
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Составление теплового баланса контактного узлаСодержание книги
Поиск на нашем сайте
Приход тепла вследствие реакций окисления NН3 (38) и (42) в час (в кДж/кмоль):
Приход тепла с аммиачновоздушной смесью
где m - количество поступающей аммначновоздушной смеси, кмоль; Ср - средние молярные теплоемкости компонентов газа, кДж/(кмоль×°С) (при температурах 0—300°С СРNH3=39,4 кДж/(кмоль×С), СрO2 = 30,5; СpN2 = 29,43); tx – температура аммиачновоздушной смеси, °С.
Расход тепла с выходящими после катализа нитрознымн газами будет: Q4 = (994×32,1+398×32,8+1552×38,3+6320×31,2) 930 = 281000000 кДж, где средние молярные теплоемкости в пределах 0—950°С соответственно СрNO = 32,1; СрO2 = 32,8; СрH2O= 38,3; СрN2 =31,2 кДж/(кмоль×°С). Потери тепла путем излучения, вызывающие снижение температуры сеток, принимаем 1%, т.е.: Q5 = 0,01×281000000 = 2810000 кДж. Исходя из прихода и расхода тепла определяем температуру аммиачновоздушной смеси, поступающей в контактный аппарат 225200000+13120000+277050tx = 281000000+2810000, tx = 165°C. Определим тепло, приносимое NH3 при 120°С Q6 = mCpt = 1035×36,2×120 = 4480000 кДж. Тогда для обеспечения температуры аммиачновоздушной смеси, поступающей в конвертор, 165°С необходимо подогревать воздух до температуры
где 6300+1670— количество воздуха; 29,5 - средняя теплоемкость воздуха в пределах 0—200°С. С учетом потерь температура воздуха составит 185°С. Количество тепла, приносимого воздухом, будет Q7 = (6300+1670)29,5×185 = 43550000 кДж. Примем температуру нитрозного газа, выходящего из теплообменника 9 (см. рис. 4) и входящего в скоростной холодильник 10, равной 200°С. Тогда количество уносимого из теплообменника тепла, составит Q8 = (994×29,45+398×30,05+1552×33,85+6320×29,05)200=55350000 кДж. где средние молярные теплоемкости воздуха в пределах 0—200°С равны соответственно СрNO = 29,45; СрO2 = 30,05; СрH2O= 33,85; СрN2 =29,05 кДж/(кмоль×°С). Количество тепла, передаваемое в теплообменниках 7, 8, 1 и 9, составит: Q9 = Q4 - Q8 =281000000-55350000 = 225650000 кДж. Количество тепла, забираемое воздухом в теплообменнике 1, при температуре его поступления из компрессора 150°С составит Q10 = 7970×29,5(185-150)=8250000 кДж. Тогда количество тепла, передаваемое нитрозным газом в теплообменниках 7, 8 и 9, составит Q11 = Q9 - Q10 = 225650000-8250000»217×106 кДж.
СОСТАВЛЕНИЕ МАТЕРИАЛЬНОГО И ТЕПЛОВОГО БАЛАНСА СКОРОСТНОГО ХОЛОДИЛЬНИКА По практическим данным в первом холодильнике погружного типа при охлаждении нитрозного газа с содержанием О2 6,5—7% до 35—40°С под давлением 8×105 Па образуется конденсат в виде 48%-ного раствора HNО3.
По данным [Атрощенко, рис. 49] при малом содержании О2 в нитрозном газе (соотношение О2:NН3 равно 1,6) в холодильнике погружного типа образуется 36%-ный раствор НNO3. Применяя пластинчатый тип холодильника можно добиться содержания HNО3 в конденсате до 30%. Для расчета примем, что при охлаждении газа до 45°С образуется 36%-ный раствор HNО3. Парциальное давление паров воды при этих условиях составляет 5×103 Па, что соответствует
паров воды в выходящем газе, степень их конденсации:
Этому соответствует 22,6% -ая степень превращения оксидов азота в азотную кислоту [Атрощенко]. Состав нитрозных газов, поступающих из теплообменников в скоростной холодильник, следующий:
Количество NO, превращенного в HNО3: 994×0,226 = 224 кмоль. На образование HNО3 по реакции: 2NO + H2О + 1,5О2 = 2HNО3 расходуется воды: 224×0,5 = 112 кмоль. Количество конденсирующейся воды (х) при образовании 36%-ного раствора HNО3 составит:
Общее количество выделившейся воды: 112 + 1392 = 1504 кмоль. Количество паров воды, остающейся в газе, 1552—1504 = 48 кмоль. Количество образующейся НNО3 в виде 36%-ного раствора: 224 + 1392 = 1616 кмоль. Состав конденсата: HNO3 - 224×63=14200 кг или 36%; Н2О - 1392×18=25100 кг или 64%. Всего – 39300 кг. Этот конденсат направляется с помощью насоса в среднюю часть абсорбционной колонны. Количество О2, израсходованного на образование HNО3 по реакции 2NO + Н2О + 1,5О2 = 2НNО3, равно 224×0,75 = 108 кмоль. Количество О2, израсходованного на дополнительное окисление NО по реакции (39), равно (994 — 224)0,5×0,09 = 34,6 (кмоль), где 0,09 — принятая степень окисления. Тогда в газе 02 останется: 398 — 108 — 34,0 = 195,4 кмоль, NО2 образуется: (994 — 224)×0,09 = 69,4 кмоль, а NО остается: (994 — 224)×0,91 = 700,6 (кмоль). Газ, выходящий из скоростного холодильника, будет следующего состава:
Соотношение между парциальным давлением NО и NO2 в выходящем газе должно соответствовать равновесному, давлению над 30%-ным раствором HNO3 при 45°С.
pNO = 0,0953×8×105 = 0,762×105 Па (0,762 атм); pNO2 = 0,0095×8×105 = 0,076×105 Па (0,076 атм);
Это соответствует значениям константы равновесия системы. Размеры скоростного холодильника рассчитываются по коэффициентам теплопередачи и по времени окисления NO, равному
РАСЧЕТ ДОБАВОЧНОГО ВОЗДУХА И ВОДЫ НА ОБРАЗОВАНИЕ HNO3
Общее количество О2, необходимого для получения из NО, азотной кислоты при 99,96%-ной абсорбции (0,005% NО на выхлопе), соответственно уравнению 2NO+ Н2О+ 1,5О2 = 2HNO3 составит 994×0,9996×1,5×0,5 = 745 кмоль. Добавочно О2 необходимо: 745-398=347 кмоль. N2, вводимый с этим О2 воздуха: 347×0,79/0,21 = 1305 кмоль. Для ускорения процесса образования азотной кислоты необходим избыток кислорода. Примем его равным 4%. Вместе с ним вводится N2 в количестве 4×0,79/0,21 = 15,05%. Содержание паров воды в выхлопных газах при 30°С (упругость паров 4,2×103 Па) и давлении 15×105 Па составляет
Потери оксидов азота составляют
Общее количество выхлопных газов можно вычислить из уравнения х = 0,04 + 0,04х + 0,0028х + 6320,5 + 1305 + 0,1505х. Откуда х = 9460 кмоль. Из них на долю избыточного О2 приходится: 9460×0,04 =378 кмоль, а на долю N2: 9460×0,1505 =1422 кмоль. Общее количество воздуха, вводимого в отбелочную и поглотительную колонну: О2 — 347 + 378 = 725 кмоль; N2 — 1305 + 1422 = 2727 кмоль. Всего — 3452 кмоль. Количество паров воды: 9460×0,0028 = 26,4 кмоль. Состав выхлопных паров будет следующим:
Количество воды, необходимой для образования 100%-ной НNО3, составляет: 994 0,5=492 кмоль. Количество воды, необходимой для получения 65%-го раствора HNО3:
С учетом влажности выхлопного газа и реакционной воды в колонну следует вводить чистой воды: 492+1880 + 26,4 — 1552 =846,4 кмоль.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 238; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.87.225 (0.01 с.) |

 .
. .
. ,
,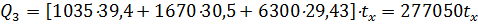 .
.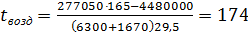 °С,
°С, %.
%. %.
%. , откуда x = 1392 кмоль.
, откуда x = 1392 кмоль.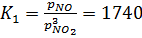 ;
;  .
. %.
%. %.
%. кмоль.
кмоль. = 1880 кмоль.
= 1880 кмоль.


