
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расчет энергии на компрессию воздуха и нитрозных газовСодержание книги
Поиск на нашем сайте
К газу, выходящему из скоростного холодильника, вводится дополнительный воздух, после чего полученная смесь сжимается турбокомпрессором до 16×105 Па и поступает через холодильник-конденсатор в абсорбционную колонну. Часть воздуха проходит через отбелочную колонну и затем с продувочными газами также направляется в колонну. Для упрощения расчета примем, что в холодильник-конденсатор поступает весь воздух сразу и что образовавшийся в нем конденсат вместе с нитрозными газами также идет в абсорбционную колонну. Количество воздуха, добавленного в холодильник-конденсатор и в отбелочную колонну, будет: О2 — 725 кмоль; N2 — 2727 кмоль; всего - 3452 кмоль. В результате в компрессор нитрозного газа поступает смесь следующего состава:
Воздух, который необходим для окисления NH3 и дополнительный сжимаются от 0,95×105 до 8×105 Па. Количество этого воздуха следующее: О2 — 1670 + 725 = 2395 кмоль; N2 — 6300+2727 = 9027 кмоль. Всего — 7970+3452 = 11422 кмоль. Для сжатия воздуха и нитрозных газов берем трехступенчатый турбокомпрессор центробежного типа с промежуточным охлаждением. Определим температуру газа па выходе из первой ступени компрессии
где Т1 - температура газа на входе, равная 303 К; Р1 - давление газа на входе, равное 0,95×105 Па; Р2 - давление газа после первой ступени сжатия, равное 2,75×105 Па; К - показатель адиабаты, равный 1,4; h - адиабатический коэффициент полезного действия, равный 0,8.
Работу, потребляемую первой ступенью турбокомпрессора, определяем по уравнению
где u - количество сжимаемого воздуха равное 11422 кмоль/ч;.
При внутреннем к.п.д. = 0,8 и механическом к.п.д. = 0,98 мощность, потребляемая первой ступенью турбокомпрессора, составляет
В промежуточном холодильнике между первой и второй ступенью компрессора воздух охлаждается от 170 до 40°С. Определим температуру воздуха после второй ступени сжатия
Примем, что на пути до теплообменника температура воздуха снижается до 150°С. Работа, потребляемая второй ступенью компрессора, составляет:
Тогда мощность второй ступени турбокомпрессора составляет
Температура нитрозных газов после третьей ступени компрессора (газ сжимается от 8×105 Па до 16×105 Па, начальную температуру газа примем 40°С):
Работа, потребляемая третьей ступенью компрессора, составляет:
Тогда
Общая мощность привода компрессора составит: 12850 + 13320 + 7650 = 33720 кВт. Затраты на сжатие газа до 16×106 Па на 1 т продукции (HNО3) будут:
РАСЧЕТ ЭНЕРГИИ, ВЫРАБАТЫВАЕМОЙ В ГАЗОВЫХ ТУРБИНАХ
Состав выхлопных газов указан выше. Этот газ подогревается в теплообменнике 9 (см. рис. 4), затем в теплообменнике 7, расширяется в газовой турбине от 13×105 до 4,5×105 Па, подогревается в теплообменнике 8, далее расширяется до 1,5×105 Па и поступает в паровой котел. В первую ступень газовой турбины выхлопной газ поступает с температурой 790 °С. Определим температуру газа после расширения в первой ступени:
Определим температуру газа после расширения во второй ступени:
Найдем количество тепла, которое несут 9451,94 кмоль выхлопных газов, при температурах 790, 560 и 577°С. Q1 = 9451,94×30,9×790 = 230×106 кДж; Q2 = 9451,94×30,05×560 = 159×106 кДж; Q3 = 9451,94×30,05×577 = 163×106 кДж. Количество энергии, возвращаемое газовой турбиной в первой и второй ступенях (230×106-159×106)+ (230×106-163×106) = 138×106 кДж Мощность газовой турбины при механическом к.п.д. = 0,98 со ставит:
при потребности компрессоров 33720 кВт. Однако общая передача тепла в теплообменниках 7, 8 и 9 218×106 кДж. Недостающую энергию можно взять, если вместо парового котла установить теплообменник с использованием поступающего в него тепла для предварительного подогрева выхлопного газа между теплообменниками 9 и 1. Q = 163×106- (218×106 - 138×106) = 83,8×106 кДж.
РАСЧЕТ ХОЛОДИЛЬНИКА-КОНДЕНСАТОРА
Считаем, что температура нитрозного газа понизится до 35°С, а давление нитрозного газа упадет до 158×105 Па. Упругость паров воды над 65%-ным раствором HNO3 при этой температуре составляет 1,6×103 Па (11,6 мм рт.ст.). Это соответствует:
Допустим, NO окислится на 95 %. Тогда на его окисление потратится О2:
На выходе из холодильника газ содержит х паров воды. Найдем его, составив равенство
Откуда х = 10,1 кмоль. Сконденсируется паров воды: 48-10,1=37,9 кмоль. В этом количестве воды растворится y моногидрата с образованием 65%-ого раствора кислоты:
Состав конденсата: НNO3 – 15,9 моль (1000 кг); Н2О – 29,9 кмоль (539 кг). Всего – 45,8 кмоль (1539 кг). Вследствие окисления получится NO2 69,4+700,6×0,95 = 735,0 кмоль, останется NO 700,6(1-0,95) = 35,0 кмоль. Образование НNO3 определяют по уравнению достижения равновесия второй реакции с учетом коэффициентов достижения равновесия, зависящих от основных технологических параметров в конструктивных особенностей тарелок. Расчет ведем от тарелки к тарелке до достижения расчетной степени поглощения оксидов азота, тем самым определяем необходимое число тарелок. Объемная скорость нитрозного газа u при 25°С и среднем давлении Р=
Принимая линейную скорость газа w в свободном объеме равной 0,4 м/с, найдем площадь сечения абсорбционной колонны
Диаметр колонны:
Примем расстояние между слоем жидкости в нижней части колонны и первой тарелкой равной 1 м. Тогда окислительный объем под первой тарелкой составит
а секундный объем проходящего газа:
Время пребывания нитрозного газа в окислительном объеме под первой тарелкой составит:
Для определения степени окисления NО за это время воспользуемся уравнением
где t — время окисления, с; К — константа скорости реакции; 2а — концентрация NО, об.%; Р —общее давление газа, ат; g - отношение содержания О2 к половинному количеству NО, g=b/a. Представляем следующие значения величин: 2а=0,41; а = 0,205; b = 5,64; Р = 15,8; t = 2,45; g=5,64/0,205=27,5; при 35°С К = 0,00408, и определим a: ^-__ = = 27,5; при 35°С К = 0,00408, и определяем а:
Отсюда a = 0,72. Образовалось NО2, останется О2: 920,4-333=587,4 кмоль. После реакции (40) останется NО2: 735— 1,5×15,9 = 711,1 кмоль И образуется NO 35 + 0,5×15,9 = 43,0 кмоль. Состав газа после холодильника-конденсатора
Правильность результата будет проверена дальше.
РАСЧЕТ ПРОЦЕССА АБСОРБЦИИ ПО ТАРЕЛКАМ
Число тарелок абсорбционной колонны рассчитывают по реакциям (39) и (40), определяющим скорость процесса образования азотной кислоты. Образование NО2 рассчитывают повремени пребывания нитрозных газов в свободном окислительном объеме между тарелками: 43×0,72=32 кмоль. После окисления получается NО2 711,1 +43×0,72 = 742,1, остается NО 43(1 —0,72) = 12,0 и О2 в газе: 587,4 — 43×0,72×0,5 = 571,9. Состав газа после окисления под первой тарелкой будет следующим:
Скорость массообмена между оксидами азота и растворами НNО3 расcчитаем по коэффициентам скорости достижения равновесного состояния. Равновесную концентрацию NO2 х над 65%-ным раствором НNO3 на первой тарелке согласно реакции (40) определяем но уравнению
где Частные константы равновесия определяем по уравнениям Терещенко, Панова, Позина и Боденштейна:
Парциалыгое давление оксидов азота в газе, поступающем на первую тарелку под давлением 15,8 ат, следующее:
Подставляя значение величин в уравнение (48), определяем х:
Парциальное давление всех оксидов азота в состоянии равновесия (в конечном газе): рр =
Парциальное давление всех оксидов азота в начальном газе рн = а+b+2с = 0,018+1,13= 1,148 (ат) = 1,16×105 Па. Уменьшение парциального давления оксидов азота вследствие их частичного превращения в НNO3 составит: Dрт = рн - рр = 1,148 —0,967 = 0,181 (ат) =0,183×105 Па. К.п.д. тарелки:
где h - к.п.д. тарелки, доли ед.; Р - давление газа, атм; С учетом к.п.д. тарелки практическое уменьшение парциального давления оксидов азота: Dрпр = Dрт ×h = 0,181×0,568=0,104×105 Па. Количество оксидов азота, превращенных в HNO3, составляет:
На образование кислоты по реакции (40) расходуется NО2: 1,5f = 1,5×67,53 = 101,3 (кмоль). При этом по той же реакции регенерировалось NO 0,5f= 0,5×67,53 = 33,77 (кмоль). После первой тарелки в газе содержится NО2 — 742,1 — 101,3 = 640,8 (кмоль); NО — 12,0 + 33,77 = 45,77 (кмоль). На образование моногидрата кислоты расходуется воды: 0,5f= 0,5×67,53 = 33,77 (кмоль). Состав газа после первой тарелки будет следующим:
Определим количество кислоты, образующейся на верхних тарелках колонны 994,0 0,9999 - 67,53 = 926,37 кмоль, где 994,0 - общее количество оксидов азота; 0,9999 - степень абсорбции оксидов азота; 67,53 - количество кислоты, образовавшейся на первой тарелке. Количество Н2О в кислоте, стекающей с первой тарелки 1880+33,77=1913,77 кмоль, где 1880 - количество Н2О, заключенное в продукционной HNO3; 33,77 - количество Н2О, необходимое для образования моногидрата на первой тарелке. Определим концентрацию кислоты, стекающей со второй тарелки
Снижение давления за счет гидравлического сопротивления
где w - линейная скорость газа в свободном сечении колонны, м/с; d – диаметр отверстий на тарелках, мм; S - свободное сечение отверстий на тарелках, %; g - плотность 65 и 26%-ной кислоты, кг/м3. Тогда
Объемная скорость газа:
Слой жидкости на тарелках принимаем равным 70 мм, высоту свободного окислительного объема 0,5 м, расстояние между первой и второй тарелками:
Продолжительность пребывания газа между первой и второй тарелками
Затем расчет повторяется как и в случае первой тарелки.
Расчет карбамида (NН2)2СО, стр 486-509 (Лобойко)
Карбамид - концентрированное азотное удобрение для разных почв под различные сельскохозяйственные культуры. В животноводстве применяется как заменитель протеина. Синтез карбамида осуществляется при температуре 458-468 К и давлении 19-20 МПа из жидкого аммиака и газообразной двуокиси углерода по суммарной реакции: NH3 + CO2 = CO(NH2)2 + H2O (48) Реакция протекает в две стадии по уравнениям: NH3 + CO2 = NH2COONH4 + 125,69 кДж (49) 2COONH4 = NH2-CO-H2N + H2O - 15,51 кДж (50) Технологический процесс производства карбамида состоит из следующих стадий: ·Синтез карбамида; ·Дистилляция плава; ·Концентрирование раствора карбамида; ·Гранулирование концентрированного раствора карбамида. Быстрый рост производства карбамида обусловлен усовершенствованием его технологии и конструктивного оформления процесса синтеза, успехами химического машиностроения, а также доступностью и дешевизной исходного сырья. Технологическая схема производства карбамида изображена на рисунке 5.
Рис. 5. Технологическая схема производства карбамида: 1 - углекислотный компрессор; 2 - колонна синтеза; 3 - разлагатель первой ступени; 4 - разлагатель второй ступени; 5 - подогреватель; 6 - газосепаратор; 7,8 - вакуум-кристаллизаторы; 9, 27 - центробежные насосы; 10 - центрифуга; 11 - эжектор; 12 - сборник; 13 - вентиляторы; 14 - циклон; 15 - плавитель; 16 - грануляционная башня; 17 - конвейер; 18 - сушилка; 19 - калорифер; 20, 21 - конденсаторы-абсорберы аммиака и С02; 22 - промывная колонна; 23 - теплообменник к промывной колонне; 24 - конденсатор; 25 - буферная емкость; 26 - плунжерные насосы
Материальный баланс
Расчет годового выпуска при 330 рабочих дня в год:
Стехиометрический выход NH3 и CO2 в соответствии с реакцией 49 составит:
где 17; 44; 60 – молярные массы соответственно NH3, СО2, (NH2)2СО; 1,07 – коэффициент, учитывающий потери карбамида. Практический выход реагентов в цикле с учетом их мольного соотношения и степени превращения составит:
Масса NH3, СО2, H2О, которые направляются в цикл с раствором угле-аммонийных солей (УАС), определяется следующим образом. Обозначим массовые доли компонентов NH3, СО2, H2О в УАС соответственно a, b, g. В соответствии с практическими данными a=30%, т.к. a+b+g=1, то g=0,7-b. Тогда:
где П – потери карбамида при дистилляции и выпаривании за исключением безвозвратных потерь: П = 0,05+0,01-0,005 = 0,055.
Масса свежего и оборотного аммиака без учета того, что возвращается с УАС:
Масса воды, введенной со свежим и оборотным аммиаком:
где 0,002 – содержание воды в аммиаке. Кроме того, массу воды, введенной со свежим и оборотным аммиаком, можно определить из равновесия:
Следовательно:
Тогда: b=0,4858, g=0,7-0,4858=0,2142. Определим массу воды, которая приходит с раствором УАС:
Всего в цикл с раствором УАС поступает:
Масса свежего и оборотного аммиака без учета аммиака, поступающего с УАС:
Масса воды, введенной со свежим и оборотным аммиаком:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 461; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.008 с.) |

 , (47)
, (47)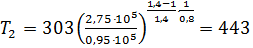 К.
К. , кДж.
, кДж. , кДж.
, кДж. кВт.
кВт. °С.
°С. , кДж.
, кДж. кВт.
кВт. .
.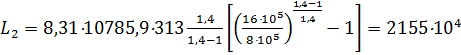 , кДж.
, кДж. кВт.
кВт. кВт×ч (1944×103 кДж).
кВт×ч (1944×103 кДж). = 560°С.
= 560°С. = 577°С.
= 577°С. кВт.
кВт. %.
%. кмоль.
кмоль. ,
, ; y= 1000 кг = 15,9 кмоль.
; y= 1000 кг = 15,9 кмоль. Па;
Па; м3/с.
м3/с. м2.
м2. м.
м. м3,
м3, м3/с.
м3/с. с.
с.
 .
. . (48)
. (48) – константа равновесия, ат-2;
– константа равновесия, ат-2;  – константа равновесия, ат-2; х – равновесное парциальное давление начального газа, соответственно NO, NO2, N2O4, ат.
– константа равновесия, ат-2; х – равновесное парциальное давление начального газа, соответственно NO, NO2, N2O4, ат. ,
, .
. ,
,  .
. , откуда х = 0,275 ат = 0,278×105 Па.
, откуда х = 0,275 ат = 0,278×105 Па.
 Па.
Па. .
. - концентрация исходного нитрозного газа, об.%; a- окисленность нитрозного газа, доли ед.; Н - высота перелива жидкости на тарелке, м;
- концентрация исходного нитрозного газа, об.%; a- окисленность нитрозного газа, доли ед.; Н - высота перелива жидкости на тарелке, м;  , - концентрация HNО3, %; w - скорость газа в полном сечении колонны, м/с; d - диаметр отверстий в ситчатой тарелке, м; S - свободное сечение ситчатой тарелки, доли ед.; Т - температура кислоты, К; 8,73 - коэффициент А, учитывающий изменение концентрации газа.
, - концентрация HNО3, %; w - скорость газа в полном сечении колонны, м/с; d - диаметр отверстий в ситчатой тарелке, м; S - свободное сечение ситчатой тарелки, доли ед.; Т - температура кислоты, К; 8,73 - коэффициент А, учитывающий изменение концентрации газа. кмоль.
кмоль. =63,56 %.
=63,56 %. ,
, Па.
Па. м3/с.
м3/с. м3/с.
м3/с. с.
с.
 кг/год.
кг/год. кг NH3,
кг NH3, кг СО2,
кг СО2, кг/т;
кг/т; кг/т;
кг/т; кг/т.
кг/т. ;
; кг/т;
кг/т; ;
; .
.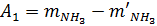
 ;
; ;
; ;
;
 кг/т;
кг/т; кг/т.
кг/т. кг/т.
кг/т. кг/т.
кг/т. кг/т.
кг/т.


