Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 2. Анализ продуктов питания по индексу еСодержание книги
Поиск на нашем сайте
Выполнение опыта Прочитайте этикетки на упаковках продуктов, имеющихся в Вашем распоряжении. Запишите в табл. 4 названия продуктов и индексы Е, указанные на этикетках. Пользуясь данными, приведенными в теоретической части, укажите влияние вещества, соответствующего конкретному индексу, на организм человека. Таблица 4.
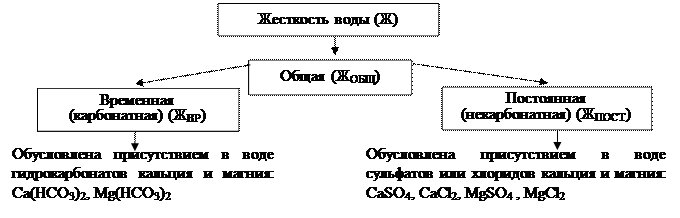
В выводе дайте оценку качества используемых продуктов. Какие из них не содержат токсичных пищевых добавок, а какие представляют потенциальную опасность для здоровья человека? В чем заключается эта опасность? Вопросы для самоконтроля знаний 1. Что такое химические загрязнители? 2. Назовите основные вещества-загрязнители окружающей среды и пути проникновения их в организм человека. 3. Что такое биоаккумуляция? Какие токсичные вещества обладают способностью к биоаккумуляции? 4. Рассчитайте, во сколько раз концентрация ДДТ возрастает при переходе ДДТ из воды: а) в водные растения, б) в мелких рыб, в) в крупных рыб, г) в хищных птиц, если концентрация ДДТ в воде составляет 0,02 части на млн., а количество ДДТ, заключенное в биомассе организмов, находящихся на разных трофических уровнях пищевой цепи, соответственно составляет 0,04, 10, 50, 75 ч. на 1 млн. весовых частей биомассы. На каком трофическом уровне ДДТ оказывает наибольшее влияние? На каких уровнях находятся насекомые-вредители урожаев и человек? Какие выводы Вы можете сделать из Вашего ответа на вопросы и расчета? 5. Было замечено, что многие животные погибают от отравления ДДТ в те периоды, когда им не хватает пищи. Объясните это явление, вспомнив в каких частях тела накапливается ДДТ, и что происходит при голодании? 6. Какие вещества называют мутагенами? Канцерогенами? Тератогенами? Приведите примеры таких токсичных веществ. 7. Охарактеризуйте возможные последствия воздействия на организм человека тяжелых металлов – свинца, кадмия и ртути. 8. Чем опасен алюминий? 9. Назовите основные источники тяжелых металлов и алюминия. 10. Опишите потенциальные эффекты воздействия на организм человека и источники поступления летучих органических веществ, пестицидов, формальдегида и продуктов сгорания. Дайте рекомендации по защите от опасных веществ. 11. Почему диоксины относятся к числу наиболее опасных загрязнителей? Назовите источники их происхождения. Какими свойствами они обладают? Работа № 3 Определение жесткости воды Теоретическая часть Жесткость воды – один из показателей, принятых для характеристики состава и качества природных вод. Жесткость – это природное свойство воды, обусловленное наличием в ней ионов кальция (Са2+) и магния (Mg2+), содержащихся в виде разных солей.
Суммарное содержание этих солей в воде называется ее общейжесткостью. Общую жесткость воды условно подразделяют на два вида: временную (или карбонатную) и постоянную (или некарбонатную) жесткость воды. Количественной мерой жесткости воды является сумма концентраций (С) ионов Са 2+ и Mg 2+ : Ж = ССа2+ + СMg2+ Измеряют жесткость числом миллимолей эквивалентов ионов жесткости Са2+ и Mg2+ в 1 дм3 воды, т.е. в ммоль/дм3 эквивалентов ионов жесткости. При расчетах, связанных с жесткостью воды, следует учитывать, что эквивалент иона Са2+ – Э(Са 2+) = ½ Са2+, эквивалент иона Mg2+ Э(Mg2+) = ½ Mg2+; молярная масса эквивалента иона кальция МЭ(Са2+) = ½ МИ (Са2+) = 20 г/моль молярная масса эквивалента иона магния МЭ (Mg2+) = ½ МИ (Mg2+ ) = 12 г/моль. Другими словами, масса 1 моль эквивалента Са2+ равна 20 г, а Mg2+ – 12 г. Тогда, например, 0,2 г – это масса 0,01 моль или 10 ммоль эквивалентов Са2+. Общая жесткость природных вод изменяется в широких пределах. Она различна в разных водоемах, а в одной и той же реке изменяется в течение года. Жесткость морей значительно выше, чем рек и озер, а максимальное значение жесткость достигает в водах океана. Так, вода с жесткостью до 3 ммоль/дм3 называется мягкой, от 4 до 7 – средней и выше 8 – жесткой. Жесткая вода не пригодна для технических целей и бытового использования. Так, например, стенки паровых котлов постепенно покрываются плотной коркой накипи, которая уже при толщине около 1 мм значительно снижает передачу теплоты стенками котла и, следовательно, ведет к увеличению расхода топлива. Кроме того, она может служить причиной появления трещин, как на кипятильных трубах, так и на стенках самого котла. Вода с жесткостью свыше 10 ммоль/дм3 имеет неприятный вкус. Резкий переход при пользовании от мягкой к жесткой воде (а иногда и наоборот) может вызвать у людей расстройство желудочно-кишечного тракта. При использовании жесткой воды ухудшается течение почечно-каменной болезни. Жесткие воды способствуют появлению дерматитов. При повышенном поступлении в организм кальция с питьевой водой на фоне йодной недостаточности чаще возникает зобная болезнь. Для питьевых целей используют воду средней жесткости – от 3 до 7 ммоль/дм3, для хозяйственных и промышленных целей – мягкую воду – до 3 ммоль/дм3. Одним из способов устранения временной жесткости воды является кипячение. При этом растворимые гидрокарбонаты переходят в малорастворимые карбонаты, общая жесткость воды уменьшается.
t0 Ca(HCO3)2 = CaCO3↓ + CO2 + H2O
t0 Mg(HCO3)2 = MgCO3 ↓ + CO2 + H2O Постоянную жесткость можно удалить добавлением в воду гидрокарбоната натрия (питьевой соды – NaHCO3) или карбоната натрия (технической соды – Na2CO3). При этом ионы кальция и магния связываются с ионами СО32–, образуя малорастворимые соли: Са 2+ + СО3 2– = CaCO3↓, Са 2+ + НСО3 - = CaCO3↓ + Н+
Жесткость воды при этом также уменьшается.
Экспериментальная часть Тема работы “Определение жесткости воды”. Цель работы - проведение анализа воды на жесткость.
|
||||||||||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 334; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.172.250 (0.008 с.) |