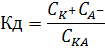Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные типы химических реакций.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Аналитическими являются только те реакции, которые сопровождаются каким-нибудь внешним эффектом, позволяющим установить, что химический процесс связан с выпадением осадка, изменением окраски анализируемого раствора, выделением газообразных веществ. В классической химии реакцию между кислотой и основанием с образованием соли и воды называют кислотно-основной реакцией. Окислительно-восстановительными называют реакции, идущие с изменением степени окисления атомов. Реакции, в результате которых происходит образование комплексных соединений, называют реакциями комплексообразования. Также часто используются реакции осаждения и растворения. Реакции осаждения - это реакции, идущие с выпадением осадков. Наоборот, реакции, сопровождающиеся растворением осадков, называются реакциями растворения. Теория кислот и оснований. В настоящее время не существует однозначного определения понятий кислоты и основания, которое в равной степени можно было бы использовать для характеристики кислотно-основных взаимодействий в любых растворителях. Для характеристики электролитов в водных растворах в настоящее время можно использовать понятия кислоты и основания, данные Аррениусом. Согласно теории Аррениуса кислотой считается соединение, при электролитической диссоциации которого образуются катионы водорода, а основанием считается соединение, в результате диссоциации которого образуется гидроксид-ион. Амфолитом (амфотерным гидроксидом) называют электролит, диссоциирующий в растворе с образованием как катионов водорода, так и гидроксид – ионов. К амфолитам относят гидроксиды цинка, алюминия, хрома и других аммфотерных элементов, а так же аминокислоты, белки, нуклеиновые кислоты. Таким образом, свойства кислот обусловлены наличием в их растворах водород - ионов, а свойства оснований - присутствием в их растворах гидроксид - ионов. Однако такой взгляд на кислоты и основания применим только для водных растворов. Ограниченность понятий кислоты и основания, данных Аррениусом, можно проиллюстрировать примерами: 1. Молекула NH3+ не содержит иона ОН-, а молекула СО2- иона H+, однако в водном растворе первая проявляет свойства основания, а вторая - кислоты.
2. Безводный хлорид водорода, состоящий только из молекул, реагирует с безводными основаниями. 3. Многие электролиты, содержащие водород, в одном растворителе диссоциируют как кислоты, а в другом – как основания. Например, СН3СООН в воде – слабая кислота: СН3СООH СН3СОО-+ H+ а в жидком фториде водорода - основание: НF+СН3СООH СН3СООH2++F- Исследования подобного типа реакций, и в особенности реакций, протекающих в неводных растворителях, привело к созданию более общих теорий кислот и оснований. Протонная теория кислот и оснований. В 1923г И. Бренстед и Т. Лоури разработали протонную теорию кислот и оснований. Согласно этой теории кислотой называют любое вещество, молекулярные частицы которого (в том числе ионы) способны отдавать протон, т.е. быть донором протонов; основанием называют вещество, молекулярные частицы которого (в том числе и ионы) способны присоединять протоны, т.е. быть акцептором протонов. Такие определения кислот и оснований позволяют включать в их число не только молекулы, но и ионы. Например, карбонат-ион согласно протонной теории является основанием, т.к. в водном растворе он присоединяет протон: СО32- + H+ HCO3-
Согласно протонной теории кислоты подразделяют на три типа: 1. Нейтральные кислоты, например HCl, H2SO4, H3PO4 и др. H2SO4 H++ HSO4- 2. Катионные кислоты, представляющие собой положительные ионы, например NH4+, Н3О+: NH4+ NH3+Н+ 3. Анионные кислоты, представляющие собой отрицательные ионы, например, HSO4-, H2PO4-, HPO42- и др.: HSO4- H++ SO42-
Подобного типа классификация имеется и для оснований: 1. Нейтральные основания, например, NH3,Н2О, С2Н5ОН и др.: NH3+Н+ NH4+ 2. Анионные основания, представляющие собой отрицательные ионы, например, Cl-, СН3СОО-, ОН-: СН3СОО-+Н+ СН3СООН 3. Катионные основания, представляющие собой положительные ионы, например, Н2N−NH3+. Растворители типа воды, жидкого аммиака, а так же анионы многоосновных кислот, которые могут быть и донорам и акцепторами протонов, являются амфолитами. Например, в реакции Н2О+ NH3→ОН-+ NH4+ молекула воды отдает протон и является кислотой. Однако в реакции Н2О+ HCl→ Н3О++Сl- молекула воды присоединят протон и является основанием. Таким образом, вода - типичный амфолит. Процесс диссоциации (ионизации) вещества происходит в контакте с растворителем. При этом растворитель выполняет или функцию кислоты или основания. Например, при растворении аммиака вода – кислота
NH3+ Н2О NH4++ ОН- При растворении фторида водорода – основание HF+ Н2О F-+H3O+ Если сродство к протону у растворителя больше, чем у растворенного вещества, то растворитель выступает как основание (сродство к протону Н2О больше сродства к протону HF), а если оно меньше – как кислота (сродство к протону Н2О меньше сродства к протону NH3). Согласно протонной теории, отдавая протон, кислота превращается в основание, которое называют сопряженным этой кислоте: I. (кислота)1=(сопряженное основание)1+Н+ т.е. каждой кислоте соответствует сопряженное основание. Наоборот, основание, присоединяя протон, превращается в сопряженную кислоту: II. (основание)2+Н+ =(сопряженная кислота)2 Например, кислоте H2SO4 соответствует сопряженное основание HSO4-, а основанию Cl- - сопряженная кислота НСl. III. (кислота)1+(основание)2=(кислота)2+(основание)1 Для краткости обратимый процесс кислотно-основного взаимодействия называют кислотно-основным равновесием. Например: HCl+ NH3 NH4++Cl- Несмотря на свои достоинства теория Бренстеда, как и теория Аррениуса, не применима к веществам, проявляющим функцию кислоты веществ, не содержащих водорода, например галогенидам бора, алюминия, кремния и олова. Поэтому более общей является теория кислот и оснований Льюиса. Теория Льюиса (электронная теория). В теории Льюиса за основу взято наиболее общее свойство кислот и оснований – их электронное строение. Согласно этой теории: кислотой называют вещество, принимающее неподеленную электронную пару, - акцептор электронов; основанием называют вещество, поставляющее электроны для образования химической связи, - донор электронов. По Льюису отличительной способностью кислот и оснований является их взаимная нейтрализация путем образования ковалентной связи:
Cl3Br+: NH3 Cl3Br: NH3; O3S+:OH2 O3S:OH2
В приведенных примерах в качестве кислоты выступают молекулы трихлорида брома и оксида серы (VI), а в качестве оснований – молекулы аммиака и воды. Таким образом, теория Льюиса рассматривает разные химические процессы как однотипные: реакцию аминов с галогенидом бора, комплексообразование. К основаниям Льюиса относят галогенид - ионы, аммиак, алифатические и ароматические амины, кислородсодержащие соединения общей формулы R2CO (где R- органический радикал). К кислотам Льюиса относят галогениды бора, алюминия, кремния, олова и других элементов. Рассмотренные теории кислот и оснований не противоречат, а дополняют друг друга и имеют глубокую внутреннюю связь. Так, кислоты, по Бренстеду, можно рассматривать как частный случай льюисовских кислот, поскольку протон характеризуется большим сродством к электронной паре и может рассматриваться, по Люйсу, как кислота.
Константа диссоциации Кд – константа диссоциации – это отношение произведения концентрации диссоциированных ионов к концентрации недиссоциированных молекул электролита. Например, КА K++A- Кд – показывает во сколько раз скорость диссоциации больше скорости ассоциации. Чем больше Кд, тем сильнее электролит. Кд зависит от природы электролита и растворителя, температуры и не зависит от концентрации раствора.
|
||||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 422; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.112.2 (0.014 с.) |