Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химический состав тканей орг. И определение СаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Химический состав тканей орг. И определение Са Из известных в настоящее время элементов в тканях животных обнаружено около шестидесяти. Часть этих элементов найдена у всех животных. Они необходимы для осуществления основных функций жизни. Другие элементы имеются только у некоторых видов животных и, по-видимому, важны только для данных животных; иногда они появляются в тканях животных случайно и затем выводятся из организма. К первой группе относятся элементы: кислород, водород, угле-род, азот, сера, фосфор, кальций, натрий, калий, хлор, магнии, кремний, железо, цинк, медь, йод, марганец, кобальт. Ко второй группе относятся: литий, алюминий, бром, фтор, серебро, ртуть, свинец, никель, барий, стронций, мышьяк, молибден. золото, бор, висмут, теллур, титан, ванадий, цезий, рубидий, селен, лантан, хром, гелий, уран, кадмий, торий, неодим и некоторые другие. Большинство этих элементов обнаружено в организме в очень незначительных количествах и не у всех животных. Норма: общий - 2,1-2,6 ммоль/л СИ (9-12 мг«), ионизированный - 1,05-1,3 ммоль/л СИ (4,2- 5,2 «rl). На содержание кальция в плазме и других жидкостях организма влияет питание, состояние эндокринной системы, почек, желудочно-кишечного тракта. Для интерпретации результатов необходимо также определять концентрацию альбумина в плазме, так как часть кальция находится в связанном с белками плазмы состоянии. Повышение показателя имеет место при гиперпаратиреозе, секреции паратиреоидподобного гормона злокачественными опухолями, гипервитаминозе D, молочно-щелочном синдроме, остеолитических процессах, например, при множественной миеломе, метастазах опухоли в кости, болезни Паже, болезни Века, при иммобилизации и семейной гипокальциурии. Иногда повышение наблюдается при гипертиреозе и при приеме лекарственных препаратов из группы тиазидов. Снижение показателя имеет место при гиполара-тиреозе. дефиците витамина D (рахит, остеомаляция), почечной недостаточности, гипопротеинемии, синдроме малабсорбции (илеите, недостаточности поджелудочной железы), тяжелом панкреатите с панкреонекрозом и при псевдогипопаратиреозе Вода и водный обмен Вода – важнейший фактор формирования внутренней среды организма и в то же время один из факторов внешней средыТканевой обмен, процессы жизнедеятельности протекают в водной среде. Вода участвует в процессах ассимиляции и диссимиляции, в процессах резорбции и диффузии, сорбции и десорбции, регулирует характер осмотических отношений в тканях, в клетках. Вода регулирует кислотно-щелочное равновесие, поддерживает рН. Буферные системы активны только в тех условиях, где есть вода. Вода – это универсальный растворитель. Она растворяет все физиологически активные вещества. Вода – это жидкая фаза, имеющая определенную физическую и химическую структуру, которая и определяет ее способность как растворителя. Живые организмы, потребляющие воду с разной структурой, развиваются и растут по-разному. Поэтому структуру воды можно рассматривать как важнейший биологический фактор Микро/макроэлементы Существуют различные классификации химиче–ских элементов, содержащихся в организме человека. Так, В. И. Вернадский в зависимости от среднего содер–жания (массовой доли w, %) в живых организмах делил элементы по декадной системе. Согласно этой клас–сификации элементы, содержащиеся в живых орга–низмах, делят на три группы: макро-, микро– и ультра–микроэлементы. Макроэлементы Это элементы, содержание которых в организме вы–ше 10-2%. К ним относятся кислород, углерод, водород, азот, фосфор, сера, кальций, магний, натрий и хлор. Микроэлементы Это элементы, содержание которых в организме на–ходится в пределах от-10-3 до 10-5%. К ним относятся йод, медь, мышьяк, фтор, бром, стронций, барий, ко–бальт. Ультрамикроэлементы Это элементы, содержание которых в организме ниже 10-5%. К ним относятся ртуть, золото, уран, торий, радий и др. В настоящее время ультрамикроэлементы объеди–няют с микроэлементами в одну группу. Эта класси–фикация отражает только содержание элементов в живых организмах, но не указывает на биологиче–скую роль и физиологическое значение того или ино–го элемента. В. В. Ковальский, исходя из значимости для жизне–деятельности, подразделил химические элементы на три группы. Жизненно необходимые (незаменимые) элементы Они постоянно содержатся в организме человека, вхо–дят в состав ферментов, гормонов и витаминов: Н, О, Са, N, К, Р, Na, S, Mg, d, С, I, Mn, Cu, Co, Fe, Zn, Mo, V. Их де–фицит приводит к нарушению нормальной жизнедея–тельности человека. Примесные элементы Эти элементы постоянно содержатся в организме жи–вотных и человека: Ga, Sb, Sr, Br, F, В, Be, Li, Si, Sn, Cs, Al, Ba, Ge, As, Rb, Pb, Ra, Bi, Cd, Cr, Ni, Ti, Ag, Th, Hg, U, Se. Биологическая роль их мало выяснена или неизвестна. Примесные элементы Sc, Tl, In, La, Pr, Sm, W, Re, Tb и др. Обнаружены в ор–ганизме человека и животных. Данные о количестве и биологическая роль пока не выяснены. Элементы, необходимые для построения и жиз–недеятельности различных клеток и организмов, называются биогенными элементами. Точно перечислить все биогенные элементы в настоя–щее время еще невозможно из-за сложности определе–ния очень низких концентраций микроэлементов и уста–новления их биологических функций. Для 24 элементов биогенность установлена надежно. Это элементы пер–вой и некоторые элементы второй групп (по Ковальскому). 6Гормоны Гормоны - мобильные посредники в регуляторной системе. Термин «гормон» - от латинского «побуждать к действию». Гормоны - это вещества, синтезирующиеся специальными железами, транспортируемые кровью и воздействующие на различные органы. Гормоны характеризуются: - синтезируются железами внутренней секреции; - действуют дистантно; - строгая специфичность действия; - высокая биологическая активность (концентрация 10-12-10-15 моль/л). В настоящее время установлено, что гормоны образуются во всех тканях. Выделяют гормоны: - с эндокринным эффектом - гормоны, синтезируемые ЖВС и поступающие в кровь; - с паракринным эффектом - гормоны образуются в одном месте и действуют рядом; - гормоны с аутокринным эффектом - действуют на ту ткань, где и образуются.
Для каждого гормона существует ткань-мишень. По первым представлениям, ткань-мишень - это та ткань, в которой гормоны вызывают физиологические или биохимические изменения. Например, тиреотропный гормон действует на щитовидную железу, следовательно, ткань-мишень - щитовидная железа; для инсулина - печень, мышечная ткань, жировая ткань. По современным же представлениям, ткань-мишень - это ткань, в которой имеются рецепторы к данному гормону. Концентрация гормонов значительно ниже, чем других БАВ, поэтому клетка-мишень должна отличить гормоны от других соединений, что осуществляется с помощью рецепторов - молекул узнавания. Связывание гормона с рецептором основано на комплиментарности какого-то участка мембраны. G+R®GR®G+R Комплекс «гормон-рецептор» может быть более активен, чем просто гормон. Свойства рецепторов: связывают гормоны, генерируют сигналы (усиливают сигналы гормона). Гормоны - это межклеточные регуляторы рецепторного действия (включая и гормоны и нейромедиаторы). Классификация гормонов Существует несколько видов классификации. По месту образования гормонов: 1. гормоны гипоталамуса; 2. гормоны гипофиза; 3. гормоны щитовидной железы; 4. гормоны поджелудочной железы; 5. гормоны паращитовидных желез; 6. гормоны надпочечников; 7. гормоны половых желез; 8. гормоны местного действия. По химическому строению: 1. белково-пептидные гормоны: гормоны гипоталамуса, гипофиза, поджелудочной железы, паращитовидных желез; 2. производные аминокислот: адреналин, норадреналин, тироксин, трийодтиронин; 3. стероиды: в их основе лежит структура циклопентанпергидрофенантрена, образуются из холестерина (половые гормоны, коры надпочечников). 7По механизму действия (по расположению рецепторов): 1. гормоны, действующие через внутриклеточный рецептор - липофильные гормоны - стероиды и тиреоидные гормоны; 2. гормоны, действующие через рецепторы, находящиеся на поверхности клетки - гидрофильные гормоны. Они действуют через внутриклеточный посредник - мессенджер. Гормон - первый посредник, а цАМФ, ионы Са2+, фосфатидилинозиды - вторые (чаще цАМФ, которая образуется из АДФ) посредники. [рис. цАМФ] Механизм действия гормонов Липофильные гормоны. Гормон диффундирует через плазматическую мембрану и связывается внутренними рецепторами, образуется комплекс «гормон-рецептор», который активируется и действует на ДНК. G+R®GR®GR*®ДНК. В ДНК выделяют гормон-чувствительный элемент (ГЧЭ). Под его влиянием изменяется транскрипция, что влияет на деградацию мРНК. Гормоны влияют на процессинг белка. Гормоны действуют непосредственно на ДНК, активируют ферменты, стимулируя их синтез. Гидрофильные гормоны. Самый распространенный второй посредник - цАМФ-аденилатциклазная система. Она состоит из 2 частей: собственно аденилатциклазный компонент и протеинкиназный компонент. В плазматической мембране находятся рецепторы 2 типов: Rs - стимулирующий и Ri - ингибирующий. Внутри мембран находится G-белок (Gs, Gi) (читается джи-белок). G-белок распадается на a и bg субъединицы, которые могут взаимодействовать между собой. a-субъединица и ГТФ действуют на аденилатциклазу, превращая ее в активную форму. Эта активная аденилатциклаза находится на внутренней поверхности ЦПМ. Под влиянием АЦ АТФ превращается в цАМФ+ФФн. Разрушается цАМФ с помощью фермента - фосфодиэстеразы. После образования АЦ включается протеинциклазный компонент. цАМФ + протеинкиназа (фермент, вызывающий фосфорилирование других белков) ®активированая протеинкиназа. Протеинкиназа – тетрамер, содержащий 2 субъединицы R (регуляторная субъединица) и 2 субъединицы C (каталитическая субъединица). R2C2+4цАМФ«R2(4цАМФ) +2C (активная протеинкиназа). Активная протеинкиназа вызывает фосфорилирование белков. Белок+ АТФ®(над стрелкой 2С) фосфопротеин (серин-фосфат, треонин-фосфат) +АДФ. В результате образования фосфорилированных белков могут быть: 1. усиленный распад гликогена: фосфорилаза В®фосфорилаза А; 2. изменение транспорта ионов; 3. изменение метаболизма углеводов, липидов; 4. регулируется генная транскрипция. Таким образом, фосфорилирование белков является важнейшим регуляторным механизмом. Гормоны щитовидной железы В щитовидной железе образуются 3 гормона, 2 из которых близки по действию и образуются из тирозина: 1. 3,5,3’-трийодтиронин (Т3); 2. 3,5,3’,5’–тетрайодтиронин (Т4); 3. тиреокальцитонин. Т3 и Т4 образуются из АК – тирозина.
Образование тиреотропных гормонов происходит на белке тиреоглобулине. Сначала молекулы тирозина включаются в белковую структуру.
Особенности образования тиреоидных гормонов: - они связаны со структурой тиреоглобулина в ЩЖ; - для синтеза необходим йод. ЩЖ способна концентрировать йод в виде йодидов, при этом происходит: 1. окисление йодидов с помощью тиреопероксидазы; 2. йодирование тирозина; 3. конденсация (соединение) йод-тирозина. Тиреоглобулин, который содержит Т3 и Т4, разрушается с образованием этих гормонов под влиянием тиреотропного гормона (тиреоглобулин«(над стрелкой ТТГ, под - KI) Т3+Т4. KI тормозит распад тиреоглобулина и поэтому применяется для лечения гипертериоза. В кровь поступают свободные тиронины, но в крови они транспортируются с тироксин-связывающим глобулином (ТСГ). Биологически более активны свободные тиронины, но их немного.
Механизм действия тиреоидных гормонов. Тиреоидные гормоны проникают через плазматическую мембрану и связываются с ядерными рецепторами (рецепторы есть в ядре и цитоплазме). Сродство Т3 в 10 раз больше, чем Т4. Эти гормоны (Т3, Т4) индуцируют синтез белков, активируют транскрипцию мРНК.
Влияние на обмен веществ: 1. увеличивают поглощения кислорода почти во всех тканях, кроме мозга и половых желез; 2. повышают активность Na +,K + -АТФ-азы, но если активность повышается, концентрация АТФ снижается, следовательно усиливаются окислительные процессы; 3. снижают отношение кислорода к АТФ. Тиреоидные гормоны повышают синтез белка, при их нормальной концентрации наблюдается положительный азотистый баланс, но при очень высокой концентрации этих гормонов проявляется обратный эффект.
Нарушения секреции. Гипофункция – гипотиреоз - у детей может привести к нарушению умственного и физического развития, кретинизм. У взрослых - микседема (слизистый отек). Развитие эндемичного зоба связано с недостатком йодидов в воде и пище. Железистая ткань не развивается, а вместо нее образуется соединительная ткань, что приводит к увеличению массы ЩЖ. Гиперсекреция тиреоидных гормонов – гипертиреоз – проявляется в виде тиреотоксикоза - увеличение ЩЖ, но за счет железистой ткани. При этом повышаются окислительные процессы в организме. Наблюдается отрицательный азотистый баланс, потеря массы тела, повышается возбудимость, пучеглазие, дрожание конечностей.
Кальцитонин образуется в клетках ЩЖ. Это пептид, состоящий из 32 АК. Он снижают уровень Са2+ в крови, но механизм действия недостаточно изучен.
Гормоны половых желез Гонады - яйчники и семенники - железы смешанного типа. По химической природе их гормоны - стероиды. Андрогены (мужские) синтезируются в семенниках и коре надпочечников. Эстрогены (женские) - в яичниках и коре надпочечников. Синтезируются из холестерола, который образуется из Ац-КоА. Ац-КоА® холестерол® прегненолон ®прогестерон ®кортикостероиды. Из прогестерона также образуются андрогены (тестостерон), а из них - эстрогены. Эстрогены: эстрадиол, эстрон (образуется из эстрадиола в плаценте), эстриол, прогестерон.
Андрогены: тестостерон, андростерон (образуется из тестостерона).
Органы-мишени для эстрадиолов - матка и молочные железы, для андрогенов - простата, семенные пузырьки, мышцы. Механизм действия – цитозольный - гормоны соединяются с цитозольными рецепторами и действуют на ген. Основной эффект - синтез специальных белков репродуктивной системы.
ФЕРМЕНТЫ Ферменты – это биологические катализаторы белковой природы. В одной клетке до 10 тыс. молекул фермента, которые катализируют 2000 ферментативных реакций. 1800 тыс. ферментов выделены, но их строение не расшифровано. Старое название ферментов – энзимы, а наука, их изучающая – энзимология. По своей химической природе ферменты – это белки, они имеют несколько уровней структурной организации и обладают всеми другими свойствами белков. Очень большое количество ферментов не имеют 4-ую структуру, т.е. являются олигомерами. Ферменты могут быть простыми и сложными. Простые состоят только из полипептидной цепи, а сложные имеют пептидную (апофермент) и небелковую части (кофермент). Далее идёт рис. [апофермент+кофермент=холофермент – обладает полноценной функциональной активностью]. По отдельности ни апофермент, ни кофермент, не выполняют функции так, как холофермент. Строение ферментов. В пространственной структуре фермента условно выделяют ряд участков, которые выполняют соответствующие им функции. Активный центр (АЦ) – участок в молекуле фермента, где происходит связывание и химическое превращение субстрата (S). Субстрат – вещество, подвергающееся химическому превращению (например, для фермента лактатдегидрогеназы (ЛДГ) субстратом будет молочная кислота). В активном центре выделяется контактный участок и каталитический участок. Контактный участок – это место активного центра, в котором происходит связывание фермента с субстратом по принципу комплементарности, т.е. именно контактный участок обеспечивает специфическое сродство субстрата ферменту. Образовавшийся комплекс носит название фермент-субстратный комплекс. Каталитический участок (центр) – это место в активном центре фермента, где происходит химическое превращение субстрата [рис. изображён фермент-субстратный комплекс, а именно контактный участок, каталитический участок, активный центр и субстрат]. Если фермент – сложный белок, то обычно простетическая часть находится тоже в активном центре и участвует в формировании активного центра. Активный центр занимает небольшую часть молекулы фермента, обычно располагается в углублении, и в его образовании участвует небольшое число аминокислотных остатков (до 20). Аминокислотные остатки могут быть удалены друг от друга, но при формировании пространственной структуры фермента они располагаются в области активного центра. В формировании активного центра могут участвовать остатки, несущие следующие функциональные группы: NH2 (ЛИЗ, АРГ), COOH (ГЛУ, АСП), OH (СЕР, ТРЕ), SH (ЦИС), имидазольное кольцо (ГИС). В качестве единиц, участвующих в формировании активного центра, могут выступать кофакторы - ионы металлов (Cu2+, Fe2+ и т.д.), а также коферменты. В сложном ферменте АК-остатки активного центра создают условия для правильной его конформации и помогают кофакторам в связывании, ориентации, а, следовательно, и в превращении субстрата. Боковые группы остальных аминокислот не участвуют в образовании активного центра, но обеспечивают правильную пространственную конформацию активного центра и влияют на его реакционную способность. Ряд ферментов могут содержать аллостерический центр. [рис. фермента с аллостерическим и активным центрами] Эти ферменты относят к аллостерическим ферментам. К аллостерическому центру присоединяются различные вещества, отличные по строению от субстрата. Эти вещества могут изменять конформацию активного центра, т.е. влиять на связывание и превращение субстрата, они называются аллостерическими эффекторами. Все аллостерические эффекторы делятся на положительные – активаторы, и отрицательные – ингибиторы.
Изоферменты Изоферменты – это изофункциональные белки. Они катализируют одну и ту же реакцию, но отличаются по некоторым функциональным свойствам в силу отличий по: - аминокислотному составу; - электрофоретической подвижности; - молекулярной массе; - кинетике ферментативных реакций; - способу регуляции; - стабильности и др. Изоферменты – это молекулярные формы фермента, различия в аминокислотном составе обусловлены генетическими факторами. Примеры изоферментов: глюкокиназа и гексокиназа.
Гексокиназа может фосфорилировать любой шестичленный цикл, гексокиназа – только превращение глюкозы. После приёма пищи, богатой глюкозой, глюкокиназа начинает работать. Гексокиназа – стационарный фермент. Он катализирует реакцию расщепления глюкозы при низких её концентрациях, поступающих в организм. Отличаются по локализации (глюкокиназа – в печени, гексокиназа – в мышцах и печени), физиологическому значению, константе Михаэльса. Если фермент – олигомерный белок, то изоформы могут получаться в результате различной комбинации протомеров. Например, лактатдегидрогеназа состоит из 4-х субъединиц. Н – субъединицы сердечного типа, М – мышечного. Может быть 5 комбинаций этих субъединиц, а, следовательно, и 5 изоферментов: НННН (ЛДГ1 – в сердечной мышце), НННМ (ЛДГ2), ННММ (ЛДГ3), НМММ (ЛДГ4), ММММ (ЛДГ5 – в печени и мышцах). [рис. эти 4 буквы в кружочки. Надо отличать изоферменты от множественных форм ферментов. Множественные формы ферментов – это ферменты, которые модифицированы после своего синтеза, например фосфорилаза A и B. Мультиферментные комплексы это надмолекулярные образования которые включают, несколько ферментов и коферментов. Они катализируют последовательные этапы реакции преобразования одного субстрата. Примером мультиферментов являются реакции окисли тельного декарбоксилирования αкетокислот (пирувата и αкетоглутарата) под влиянием пи руватдегидрогеназы и αкетоглутаратдегидрогеназы. Например пируватдегидрогеназный комплекс включает 3 фермента и использует 5 коферментов Проферменты, или проэнзимы, зимогены, энзимогены — функционально неактивные предшественники ферментов, подвергающиеся тем или иным преобразованиям (обычно расщеплению специфическими эндо- или экзопептидазами или гидролизу), в результате чего образуется каталитически активный продукт — фермент. Относятся к группе протеиназ(сериновые, тиоловые, кислые). Синтез зимогенов осуществляется на рибосомах эндоплазматического ретикулума особыми секреторными клетками в виде зимогенных гранул, которые после завершения процесса мигрируют к поверхности клеток и затем секретируются в окружающую среду. Достигнув места действия они превращаются в активные формы ферментов. К ним относятся пепсиноген, активной формой которого является пепсин (основной протеолитический фермент желудочного сока), трипсиноген — трипсин, химотрипсиноген — химотрипсин, прокарбоксилепептидазы — карбоксипептидазы (ферменты поджелудочной железы) и др. К зимогенам относятся ферменты свёртывания крови (факторы свёртывания крови), компоненты и факторы системы комплемента. Химическая природа ферментов. Однокомпонентные (мономерные) и двухкомпонентные (олиголимерные) ферменты. По химической природе бывают мономерные (однокомпонентные) ферменты, состоящие только из белковой части и олигомерные (двухкомпонентные), содержащие наряду с белковой частью (апофермент) и небелковую часть (кофактор). В роли кофактора могут выступать: коферменты, непрочно связанные с белковой частью, и простетические группы прочно связанные с белком. Кофактор может быть представлен коферментными формами водорастворимых витаминов (В1, В2, В3, В5, В6, В12, Н) и многими двухвалентными металлами (Mg2, Mn2, Ca2). Отличительная особенность двухкомпонентных ферментов – ни кофактор отдельно, ни апофермент сами по себе не обладают каталитической активностью, а только в комплексе, образуя холофермент. 20 Свойства ферментов Общие черты ферментов и небиологических катализаторов: 1) и те, и другие катализируют только энергетически возможные реакции; 2) увеличивают скорость реакции; 3) не меняют направления реакции; 4) в ходе реакции не расходуются; 5) для обратимых процессов катализируют как прямую, так и обратную реакции, не смещая равновесия, а лишь ускоряя время его наступления. Особые свойства ферментов: 1) высокая каталитическая активность. Металлы увеличивают скорость реакции в тысячи раз, а ферменты в миллионы раз. Например, уреаза ускоряет скорость реакции в 1014 раз. Каталаза ускоряет распад H2O2 в 1 млдр. раз! 2H2O2 ®2H2O +O2. Без катализатора выделения кислорода не видно. Металлический катализатор увеличивает скорость реакции в 1000 раз, а при добавлении каталазы – бурное вспенивание. 2) специфичность действия – наиболее характерная черта. Строение активного центра фермента, катализирующего реакции, различна. Структура активного центра фермента комплементарна структуре его субстрата, поэтому фермент из множества веществ присоединяет только свой субстрат – субстратная специфичность фермента. Каждый фермент катализирует не любое превращение субстрата, а какое либо одно – специфичность пути превращения. Например, на АК ГИС действуют 2 фермента: гистидаза (отщепляет NH3) и гистидиндекарбоксилаза (отщепляет CO2).
Выделяют несколько видов специфичности: а) абсолютная специфичность. Фермент действует только на один единственный субстрат. Пр.: уреаза разрушает мочевину: NH2-CO-NH2® (над стрелкой уреаза, под – вода) 2NH3+ CO2. Аргиназа катализирует распад аргинина. б) групповая специфичность. Фермент действует на определённую связь в разных субстратах. Пр.: пептидазы разрывают пептидные связи [-NH-CH(R)-CO--NH-CH(R)-CO-]. Пепсин действует только на связи, образованные карбоксильной группой ароматических АК (ФЕН, ТИР, ТРИ). Эстеразы разрывают сложно-эфирную связь [-CO-NH-] в различных липидах. Гликозидазы действуют на гликозидную связь. Действие ферментов, обладающих групповой специфичностью, позволяет организму содержать небольшое количество ферментов. в) стереоспецифичность. Фермент действует на определённый стереоизомер (D- и L-, цис- и транс-). Пр.: бутен-2-диовая кислота имеет 2 стереоизомера: транс-изомер или фумаровая к-та, и цис-изомер или малеиновая кислота.
Фумараза действует на фумаровую к-ту с превращением последней в яблочную.
В стереоспецифичности выделяют оптическую специфичность – избирательное действие ферментов на оптические изомеры. Например, под действием ЛДГ разрушается только L-форма молочной к-ты.
3) Влияние температуры (правило Вант-Гоффа). При увеличении температуры на 10 градусов скорость реакции увеличивается в 1,5-2 раза. Но для фермента это правило действует только до 40 градусов, т.к. дальше наступает тепловая денатурация фермента. Большинство ферментов в организме человека имеет оптимальную температуру 25-40 градусов [рис. графика: по оси х – температура, по у – процент активности. Рисуем горочку, оптимум – на 37-40°С]. Повышение активности фермента при увеличении температуры объясняется увеличением кинетической энергии реагирующих молекул, что приводит к увеличению числа столкновений между молекулами. При дальнейшем повышении температуры энергия становится чрезмерной, и внутри молекулы разрываются слабые связи – водородные, гидрофильные взаимодействия; происходит нарушение вторичной, третичной, четвертичной структуры фермента. Ряд ферментов термостабильны, например, гликопротеины. 4) Влияние рН. Для поддержания третичной или четвертичной структуры фермента часто может быть необходимо наличие заряда на группе, удаленной от области связывания субстрата. Если же заряд этой группы меняется, то может происходить частичное развертывание белковой цепи, или компактизация, или диссоциация (олигомерные белки). Поэтому при отклонении рН от оптимального значения, фермент может потерять свою нативную структуру, в результате чего не происходит полноценного связывания активного центра с субстратом. Также при изменении рН может происходить изменение заряда на субстрате. [рис. график. По х – рН, по у – процент активности. Рисуем горочку.] Пепсин – 1.5-2, амилаза слюны - 6.8-7.2, трипсин - 7.5-8.6. Для большинства ферментов оптимум рН лежит в среде, близкой к нейтральной. 5) Скорость ферментативной реакции прямо пропорциональна кол-ву фермента (для небиологических катализаторов такой зависимости нет). Недостаток фермента в живом организме, например при неполноценном питании, генетических нарушениях, приводит к уменьшению скорости превращения веществ и наоборот. 6) Ферменты являются регулируемыми катализаторами. Так под действием различных веществ (активаторов и ингибиторов) меняется скорость ферментативной реакции.
Классификация витаминов Принята классификация по растворимости: 1) жирорастворимые (A, D, E, K); 2) водорастворимые (все остальные: В_, С, Р, Н); 3) витаминоподобные вещества – синтезируются в организме, но в недостаточном количестве (парааминобензойная к-та, коэнзим Q, холин, инозит, пангамовая к-та). Номенклатура витаминов представлена химическим названием и буквенным обозначением. Напр., витамин А – ретинол, витамин РР – никотинамид или никотиновая кислота, витамин В6 – пиридоксин, пиридоксаль или пиридоксамин. Также существует клиническое название витамина, которое состоит из названия патологического проявления недостатка витамина с приставкой анти-. (напр., витамин А – антиксерофтальмический витамин, витамин D – антирахитический витамин). Жирорастворимые витамины могут откладываться в печени в виде резервов (A, D, K), витамин Е может накапливаться в жировой ткани. Так как эти витамины нерастворимы в воде, то они не могут свободно проникать в кровь и выводиться с мочой. При избыточном поступлении этих витаминов могут развиваться токсические эффекты (в основном, витамина А и D). Водорастворимые витамины выводятся с мочой, поэтому их избытка не наблюдается. Возможен небольшой резерв фолиевой к-ты и витамина В12 в печени. Токсические эффекты не наблюдаются.
Причины гиповитаминозов 1. Первичные: недостаток витамина в пище. 2. Вторичные: а) снижение аппетита; б) повышенный расход витаминов; в) нарушения всасывания и утилизации, напр., энтероколиты, желчно-каменная болезнь; г) химиотерапия (антибиотики, аспирин – недостаток фолиевой к-ты); д) хирургические вмешательства; е) физиотерапия и др. 3. Врожденные: отсутствие ферментов, катализирующих превращение провитамина в витамин (напр., каротин не превращается в ретинол – витамин А).
Причины недостаточной витаминной обеспеченности в современных условиях Чешские исследователи выяснили, что при оптимальной диете человек не получает достаточное количество витаминов. Причины: 1) снижение энерготрат с 3500-4000 ккал/сут до 2000-2500 ккал/сут за сто лет, из-за чего снижение количества пищи и, следовательно, уменьшение количества витаминов; 2) использование бедных витаминами продуктов (рафинированных и высококалорийных: сахар, белый хлеб, спирт); 3) использование рафинированных продуктов; 4) недостаточное потребление овощей и фруктов; 5) отсутствие централизованной системы витаминизации. Т.о., рацион современного человека достаточен по калорийности, но не удовлетворяет его потребностей в витаминах.
24 Витамин D Антирахитический витамин. Существуют два витамера: D2 – эргокальциферол и D3 – холекальциферол. Витамин D2 содержится в грибах. Витамин D3 синтезируется в организме под действием УФО (ультрафиолетового облучения): 7-дегидрохолестерол → холекальциферол (D3)
Роль витамина D в обмене веществ: Витамин D3 (холекальциферол) подвергается в организме превращению. Он поступает в печень, где под действием 25-гидроксилазы превращается в 25-гидроксихолекальциферол, затем в почках под действием ПТГ и 1-гидроксилазы – в 1,25-дигидроксихолекальциферол (гормон кальцитриол)
кальцитриол Функции кальцитриола 1. регулирует всасывание кальция и фосфора в кишечнике путем активации синтеза в энтероцитах кальций-связывающего белка (кальбиндина D); 2. в костях способствует минерализации ткани, поддержанию нормальной концентрации кальция и фосфора в межклеточном пространстве. (повышает активность щелочной фосфатазы, повышает концентрацию кальций-связывающего белка и остеокальцина) Гиповитаминоз D приводит к снижению уровня кальция в крови, снижению кальция и фосфора в межклеточном пространстве, нарушению минерализации костной ткани. Авитаминоз D – рахит. Различают рахит I типа (при недостатке витамина D) и рахит II типа (при недостатке рецепторов). Проявляется рахит деформациями скелета ("рахитические четки", Х-образные или О-образные голени, килевидная грудная клетка). Недостаток витамина D у взрослых сопровождается остеомаляцией, а в крови увеличивается активность щелочной фосфатазы. Причины гиповитаминозов D: - недостаток витамина D в пище - недостаток УФ (солнечного) облучения - недостаток парат-гормона Суточная потребность вит. D 0,012-0,025 мг. Источники витамина D: яичный желток, рыбий жир, сливочное масло (лучше летнее), печень, молоко.
Витамин А Витамеры: А1 – ретинол и А2 – ретиналь. Клиническое название: антиксерофтальмический витамин. По химической природе: циклический непредельный одноатомный спирт на основе кольца b-ионона.
Может разрушаться кислородом, т.е. является антиоксидантом. Роль витамина А в метаболизме: 1. Участвует в росте и дифференцировке клеток эмбриона, развивающегося организма. Участвует в делении и дифференцировке быстро пролиферирующих тканей (хрящевые, костные, эпителиальные ткани), т.к. витамин А может инициировать репликацию и участвует в образовании хондроитинсульфата. 2. Участвует в фотохимическом процессе зрения. В состав зрительного пигмента родопсина входит 11-цис-ретиналь, который при освещении переходит в 11-транс-ретиналь, активирующий фосфодиэстеразу, которая расщепляет цГМФ, в результате чего ионные каналы мембраны закрываются, возникает гиперполяризация мембраны и генерируется нервный импульс. При этом родопсин разлагается на белок опсин и 11-транс-ретиналь. В темноте наблюдается регенерация родопсина: транс-ретиналь ® (алкоголь-ДГ, НАД·Н2 → НАД) транс-ретинол ® (изомераза) цис-ретинол ®(алкоголь-ДГ, НАД·Н2 → НАД) цис-ретиналь ® (+опсин) родопсин Гиповитаминоз А проявляется нарушением темновой адаптации. Если наблюдается в растущем организме, то имеет место задержка роста. Гиповитаминоз А может перерасти в авитаминоз А, проявляющийся гемеролопией ("ночной слепотой"). При недостатке витамина А нарушается эпителизация, наблюдается избыточное ороговение эпителия (сухость кожи, сухость роговицы глаз – ксерофтальмия). Ксерофтальмия может привести к развитию микрофлоры, кератомаляции (размягчению роговицы), затем к её помутнению и амблеопии (слепоте). Причины гипо- и авитаминозов А: - недостаток в пище - нарушение всасывания в кишечнике - заболевания печени, при которых провитамин (кератин) не превращает
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 440; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.24.176 (0.014 с.) |


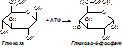 +АДФ
+АДФ