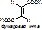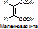Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Моноферменты ,изоферменты, мультиферменты проферменты, олигоферментыСодержание книги
Поиск на нашем сайте
Изоферменты Изоферменты – это изофункциональные белки. Они катализируют одну и ту же реакцию, но отличаются по некоторым функциональным свойствам в силу отличий по: - аминокислотному составу; - электрофоретической подвижности; - молекулярной массе; - кинетике ферментативных реакций; - способу регуляции; - стабильности и др. Изоферменты – это молекулярные формы фермента, различия в аминокислотном составе обусловлены генетическими факторами. Примеры изоферментов: глюкокиназа и гексокиназа.
Гексокиназа может фосфорилировать любой шестичленный цикл, гексокиназа – только превращение глюкозы. После приёма пищи, богатой глюкозой, глюкокиназа начинает работать. Гексокиназа – стационарный фермент. Он катализирует реакцию расщепления глюкозы при низких её концентрациях, поступающих в организм. Отличаются по локализации (глюкокиназа – в печени, гексокиназа – в мышцах и печени), физиологическому значению, константе Михаэльса. Если фермент – олигомерный белок, то изоформы могут получаться в результате различной комбинации протомеров. Например, лактатдегидрогеназа состоит из 4-х субъединиц. Н – субъединицы сердечного типа, М – мышечного. Может быть 5 комбинаций этих субъединиц, а, следовательно, и 5 изоферментов: НННН (ЛДГ1 – в сердечной мышце), НННМ (ЛДГ2), ННММ (ЛДГ3), НМММ (ЛДГ4), ММММ (ЛДГ5 – в печени и мышцах). [рис. эти 4 буквы в кружочки. Надо отличать изоферменты от множественных форм ферментов. Множественные формы ферментов – это ферменты, которые модифицированы после своего синтеза, например фосфорилаза A и B. Мультиферментные комплексы это надмолекулярные образования которые включают, несколько ферментов и коферментов. Они катализируют последовательные этапы реакции преобразования одного субстрата. Примером мультиферментов являются реакции окисли тельного декарбоксилирования αкетокислот (пирувата и αкетоглутарата) под влиянием пи руватдегидрогеназы и αкетоглутаратдегидрогеназы. Например пируватдегидрогеназный комплекс включает 3 фермента и использует 5 коферментов
Проферменты, или проэнзимы, зимогены, энзимогены — функционально неактивные предшественники ферментов, подвергающиеся тем или иным преобразованиям (обычно расщеплению специфическими эндо- или экзопептидазами или гидролизу), в результате чего образуется каталитически активный продукт — фермент. Относятся к группе протеиназ(сериновые, тиоловые, кислые). Синтез зимогенов осуществляется на рибосомах эндоплазматического ретикулума особыми секреторными клетками в виде зимогенных гранул, которые после завершения процесса мигрируют к поверхности клеток и затем секретируются в окружающую среду. Достигнув места действия они превращаются в активные формы ферментов. К ним относятся пепсиноген, активной формой которого является пепсин (основной протеолитический фермент желудочного сока), трипсиноген — трипсин, химотрипсиноген — химотрипсин, прокарбоксилепептидазы — карбоксипептидазы (ферменты поджелудочной железы) и др. К зимогенам относятся ферменты свёртывания крови (факторы свёртывания крови), компоненты и факторы системы комплемента. Химическая природа ферментов. Однокомпонентные (мономерные) и двухкомпонентные (олиголимерные) ферменты. По химической природе бывают мономерные (однокомпонентные) ферменты, состоящие только из белковой части и олигомерные (двухкомпонентные), содержащие наряду с белковой частью (апофермент) и небелковую часть (кофактор). В роли кофактора могут выступать: коферменты, непрочно связанные с белковой частью, и простетические группы прочно связанные с белком. Кофактор может быть представлен коферментными формами водорастворимых витаминов (В1, В2, В3, В5, В6, В12, Н) и многими двухвалентными металлами (Mg2, Mn2, Ca2). Отличительная особенность двухкомпонентных ферментов – ни кофактор отдельно, ни апофермент сами по себе не обладают каталитической активностью, а только в комплексе, образуя холофермент. 20 Свойства ферментов Общие черты ферментов и небиологических катализаторов: 1) и те, и другие катализируют только энергетически возможные реакции; 2) увеличивают скорость реакции;
3) не меняют направления реакции; 4) в ходе реакции не расходуются; 5) для обратимых процессов катализируют как прямую, так и обратную реакции, не смещая равновесия, а лишь ускоряя время его наступления. Особые свойства ферментов: 1) высокая каталитическая активность. Металлы увеличивают скорость реакции в тысячи раз, а ферменты в миллионы раз. Например, уреаза ускоряет скорость реакции в 1014 раз. Каталаза ускоряет распад H2O2 в 1 млдр. раз! 2H2O2 ®2H2O +O2. Без катализатора выделения кислорода не видно. Металлический катализатор увеличивает скорость реакции в 1000 раз, а при добавлении каталазы – бурное вспенивание. 2) специфичность действия – наиболее характерная черта. Строение активного центра фермента, катализирующего реакции, различна. Структура активного центра фермента комплементарна структуре его субстрата, поэтому фермент из множества веществ присоединяет только свой субстрат – субстратная специфичность фермента. Каждый фермент катализирует не любое превращение субстрата, а какое либо одно – специфичность пути превращения. Например, на АК ГИС действуют 2 фермента: гистидаза (отщепляет NH3) и гистидиндекарбоксилаза (отщепляет CO2).
Выделяют несколько видов специфичности: а) абсолютная специфичность. Фермент действует только на один единственный субстрат. Пр.: уреаза разрушает мочевину: NH2-CO-NH2® (над стрелкой уреаза, под – вода) 2NH3+ CO2. Аргиназа катализирует распад аргинина. б) групповая специфичность. Фермент действует на определённую связь в разных субстратах. Пр.: пептидазы разрывают пептидные связи [-NH-CH(R)-CO--NH-CH(R)-CO-]. Пепсин действует только на связи, образованные карбоксильной группой ароматических АК (ФЕН, ТИР, ТРИ). Эстеразы разрывают сложно-эфирную связь [-CO-NH-] в различных липидах. Гликозидазы действуют на гликозидную связь. Действие ферментов, обладающих групповой специфичностью, позволяет организму содержать небольшое количество ферментов. в) стереоспецифичность. Фермент действует на определённый стереоизомер (D- и L-, цис- и транс-). Пр.: бутен-2-диовая кислота имеет 2 стереоизомера: транс-изомер или фумаровая к-та, и цис-изомер или малеиновая кислота.
Фумараза действует на фумаровую к-ту с превращением последней в яблочную.
В стереоспецифичности выделяют оптическую специфичность – избирательное действие ферментов на оптические изомеры. Например, под действием ЛДГ разрушается только L-форма молочной к-ты.
3) Влияние температуры (правило Вант-Гоффа). При увеличении температуры на 10 градусов скорость реакции увеличивается в 1,5-2 раза. Но для фермента это правило действует только до 40 градусов, т.к. дальше наступает тепловая денатурация фермента. Большинство ферментов в организме человека имеет оптимальную температуру 25-40 градусов [рис. графика: по оси х – температура, по у – процент активности. Рисуем горочку, оптимум – на 37-40°С]. Повышение активности фермента при увеличении температуры объясняется увеличением кинетической энергии реагирующих молекул, что приводит к увеличению числа столкновений между молекулами. При дальнейшем повышении температуры энергия становится чрезмерной, и внутри молекулы разрываются слабые связи – водородные, гидрофильные взаимодействия; происходит нарушение вторичной, третичной, четвертичной структуры фермента. Ряд ферментов термостабильны, например, гликопротеины.
4) Влияние рН. Для поддержания третичной или четвертичной структуры фермента часто может быть необходимо наличие заряда на группе, удаленной от области связывания субстрата. Если же заряд этой группы меняется, то может происходить частичное развертывание белковой цепи, или компактизация, или диссоциация (олигомерные белки). Поэтому при отклонении рН от оптимального значения, фермент может потерять свою нативную структуру, в результате чего не происходит полноценного связывания активного центра с субстратом. Также при изменении рН может происходить изменение заряда на субстрате. [рис. график. По х – рН, по у – процент активности. Рисуем горочку.] Пепсин – 1.5-2, амилаза слюны - 6.8-7.2, трипсин - 7.5-8.6. Для большинства ферментов оптимум рН лежит в среде, близкой к нейтральной. 5) Скорость ферментативной реакции прямо пропорциональна кол-ву фермента (для небиологических катализаторов такой зависимости нет). Недостаток фермента в живом организме, например при неполноценном питании, генетических нарушениях, приводит к уменьшению скорости превращения веществ и наоборот. 6) Ферменты являются регулируемыми катализаторами. Так под действием различных веществ (активаторов и ингибиторов) меняется скорость ферментативной реакции.
|
|||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 2649; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.168.126 (0.007 с.) |

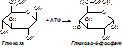 +АДФ
+АДФ