
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Цель работы: изучение зависимости скорости химической реакции от концентрации реагирующих веществ, температуры и катализатора.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Лабораторная работа №1
КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Цель работы: знакомство с различными классами неорганических соединений, получение некоторых из них и исследование их свойств. Важнейшие понятия: простые и сложные вещества, органические и неорганические соединения, номенклатура ИЮПАК, основные классы неорганических соединений: оксиды (основные, кислотные, амфотерные), основания (основные, амфотерные), кислоты (бескислородные и кислородсодержащие, одно- и многоосновные), соли (средние, кислотные, основные), их свойства. Следует уметь: определять основные классы неорганических соединений (оксиды, кислоты, основания, соли), называть вещества согласно номенклатуре ИЮПАК, писать уравнения, характеризующие основные свойства классов неорганических соединений.
Экспериментальная часть Опыт 1. Определение окраски индикаторов в различных средах Для опыта в три пробирки внесите по 5 капель 2 н раствора соляной кислоты. Добавьте в пробирки по 1-2 капли следующих индикаторов (фенолфталеина, метилового оранжевого, лакмуса). В другие три пробирки внесите по 5 капель 2 н раствора гидроксида натрия и по 1-2 капли индикатора. По результатам опыта заполните таблицу 1.1 Опыт 2. Оксиды и их свойства а) Получение и исследование свойств оксида серы (IV) Налейте в стаканчик 5-10 мл воды. Поместите небольшое количество порошка серы на ложечку для сжигания, нагрейте на спиртовке до воспламенения и держите над поверхностью воды. После прекращения горения серы образующийся газ растворите в воде; определите реакцию раствора, прибавив 2-3 капли метилоранжа. Напишите уравнения соответствующих реакций. б) Свойства оксида кальция В пробирку с водой поместите кристаллический оксид кальция. К раствору прибавьте 2-3 капли фенолфталеина. Отметьте изменение окраски раствора, напишите уравнение реакции.
Опыт 3. Основания и их свойства а) Взаимодействие оснований с кислотами Внесите в пробирку 5-6 капель 2 н раствора NaOH, добавьте 1-2 капли фенолфталеина и по каплям 2 н раствор серной кислоты до обесцвечивания раствора. Отметьте все изменения окраски раствора, напишите уравнение реакции. б) Получение и исследование свойств гидроксида хрома (III) Налейте в две пробирки 4-5 капель раствора хлорида хрома (III), добавьте 1 каплю 2 н раствора гидроксида натрия. Отметьте цвет осадка. Прибавьте в первую пробирку 2-3 капли кислоты, во вторую – 2-3 капли щелочи. Напишите уравнения соответствующих реакций.
Опыт 4. Кислоты и их свойства а) Взаимодействие кислот-неокислителей (HCl, H2SO4(разб)) с металлами В три пробирки внесите кусочки металлов (цинк, железо, медь) и в каждую пробирку прилейте по 5-6 капель 2 н раствора соляной кислоты. Напишите уравнения соответствующих реакций. б) Взаимодействие азотной кислоты с медью Внесите в пробирку с концентрированной азотной кислотой кусочек меди. Напишите уравнение реакции.
Опыт 5. Соли и их свойства а) Взаимодействие солей с кислотами Работа выполняется по вариантам.
Налейте в пробирку 5-6 капель раствора соли, добавьте 2 н раствор соответствующей кислоты. Напишите уравнение реакции.
б) Взаимодействие солей с солями Работа выполняется по вариантам.
К раствору соответствующей соли прибавьте 2-3 капли раствора другой соли. Напишите уравнение реакции.
в) Соли в реакциях замещения Выполнение работы. Кусочек железа поместите в раствор сульфата меди. Что при этом происходит? В каких случаях металл взаимодействует с солью? Напишите уравнение реакции.
ОТЧЕТ ПО ЛАБОРАТОРНОЙ РАБОТЕ №1
КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Цель работы: знакомство с различными классами неорганических соединений, получение некоторых из них и исследование их свойств.
КРАТКИЕ ТЕОРЕТИЧЕСКИЕ ОСНОВЫ РАБОТЫ
Реакцию среды (кислую, нейтральную, щелочную) можно определить с помощью специальных реактивов, которые называются __________________________________________________________________
Оксидами называются __________________________________________________________________
По химическим свойствам оксиды делятся на __________________________________________________________________
Основаниями (гидроксидами) называются ____________________________________________________________________________________________________________________________________
Амфотерные гидроксиды – это
____________________________________________________________________________________________________________________________________
Кислотами называются ____________________________________________________________________________________________________________________________________
Кислоты классифицируются: 1._________________________________________________________________ 2._________________________________________________________________3._________________________________________________________________
С соляной и разбавленной серной кислотами взаимодействуют металлы __________________________________________________________________при этом выделяеся_________________________________________________
Солями называются ____________________________________________________________________________________________________________________________________ Средние соли (примеры) __________________________________________________________________ Кислые соли (примеры) __________________________________________________________________Основные соли (примеры) __________________________________________________________________
Опыт 1. Определение окраски индикаторов в различных средах. Таблица 1.1
Опыт 2. Оксиды и их свойства. а) Получение и исследование свойств оксида серы (IV). Уравнение реакции горения серы: __________________________________________________________________Внешний вид, цвет, запах оксида серы (IV) __________________________________________________________________
Уравнение реакции растворения оксида в воде: __________________________________________________________________
Окраска индикатора метилоранжа_____________________________________ реакция раствора____________________________________________________
Вывод: ____________________________________________________________________________________________________________________________________
б) Свойства оксида кальция. Уравнение реакции взаимодействия оксида кальция с водой: __________________________________________________________________
Окраска индикатора фенолфталеина___________________________________ реакция раствора____________________________________________________
Вывод: ____________________________________________________________________________________________________________________________________ Опыт 3. Основания и их свойства. а) Взаимодействие оснований с кислотами. Окраска индикатора фенолфталеина в растворе NaOH____________________ Уравнение реакции взаимодействия гидроксида натрия с серной кислотой: __________________________________________________________________ Наблюдаемые явления __________________________________________________________________ реакция раствора____________________________________________________
Реакция между кислотой и основанием называется_______________________
б) Получение и исследование свойств гидроксида хрома (III).
Уравнение реакции между хлоридом хрома (III) и гидроксидом натрия __________________________________________________________________Наблюдаемые явления __________________________________________________________________ Уравнение реакции между гидроксидом хрома (III) и кислотой: __________________________________________________________________ Наблюдаемые явления __________________________________________________________________ Уравнение реакции между гидроксидом хрома (III) и щелочью: __________________________________________________________________ Наблюдаемые явления __________________________________________________________________
Вывод: ____________________________________________________________________________________________________________________________________
Опыт 4. Кислоты и их свойства а) Взаимодействие кислот-неокислителей (HCl, H2SO4(разб)) с металлами
С кислотой взаимодействуют_металлы_________________, так как ________ ____________________________________________________________________________________________________________________________________ Уравнения реакций и условия их протекания ____________________________________________________________________________________________________________________________________
Наблюдаемые явления __________________________________________________________________
С кислотой не взаимодействует_____________, так как ___________________ __________________________________________________________________ б) Взаимодействие азотной кислоты с медью Уравнение реакции __________________________________________________________________ Наблюдаемые явления __________________________________________________________________
Вывод: ______________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 5. Соли и их свойства а) Взаимодействие солей с кислотами Уравнение реакции __________________________________________________________________ Наблюдаемые явления __________________________________________________________________
б) Взаимодействие солей с солями Уравнение реакции __________________________________________________________________ Наблюдаемые явления __________________________________________________________________ в) Соли в реакциях замещения Уравнение реакции __________________________________________________________________ Наблюдаемые явления __________________________________________________________________
Вывод: ____________________________________________________________________________________________________________________________________ ____________________________________________________________________________________________________________________________________
Лабораторная работа № 2
КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Цель работы: изучение зависимости скорости химической реакции от концентрации реагирующих веществ, температуры и катализатора. Важнейшие понятия: гомогенные и гетерогенные реакции, скорость химической реакции, закон действующих масс для гомогенных и гетерогенных реакций, зависимость скорости химической реакции от температуры, энергия активации, катализатор и каталитические реакции, обратимые и необратимые реакции, химическое равновесие, смещение равновесия. Следует уметь: записывать закон действующих масс для гомогенной и гетерогенной реакции, рассчитывать скорость химической реакции в начальный момент и когда прореагировала часть веществ; определять изменение скорости реакции при изменении концентрации вещества и температуры, рассчитывать энергию активации; записывать выражение константы равновесия, определять направления смещения равновесия, используя принцип Ле Шателье.
Экспериментальная часть
Исследования проводят на примере реакции взаимодействия тиосульфата натрия с серной кислотой, которая протекает по уравнению:
Na2S2O3 + H2SO4 = S↓ + SO2 + Na2SO4 + H2O
Признаком протекания реакции является помутнение раствора вследствие выпадения серы.
Опыт 1. Зависимость скорости химической реакции от концентрации реагирующих веществ.
Используя две бюретки с 0,1 М раствором Na2S2O3 и водой, приготовьте растворы тиосульфата натрия разной концентрации. №1: 1 мл тиосульфата натрия + 3 мл воды; №2: 2 мл тиосульфата натрия + 2 мл воды; №3: 3 мл тиосульфата натрия + 1 мл воды; Из третьей бюретки в пробирку №1 добавьте 2 мл 2 н серной кислоты H2SO4 и измерьте время в секундах от момента добавления кислоты до появления первых признаков помутнения раствора. То же самое проделайте с пробирками №2 и №3. Результаты занесите в таблицу 2.1. Рассчитайте Vпракт. для второго и третьего случая, из соотношения где V1 – cкорость реакции в пробирке №1 (V1 = 1) V2 – cкорость реакции в пробирке №2, t1 – время до помутнения в пробирке №1, t2 – время до помутнения в пробирке №2. Сделайте вывод о зависимости скорости реакции от концентрации реагирующих веществ при данных условиях. Опыт 2. Зависимость скорости химической реакции от температуры. В одну пробирку внесите 3 мл 0,1 М раствора тиосульфата натрия Na2S2O3, а в другую пробирку – 3 мл 2 н серной кислоты H2SO4 и измерьте время от момента добавления кислоты до появления первых признаков помутнения раствора. Второй и третий опыты проведите аналогично первому, но при температуре соответственно на 10 и 200 выше комнатной. Для этого пробирки с растворами выдержите в стакане с водой соответствующей температуры 5 минут, затем смешайте. Температуру в стакане контролируйте с помощью термометра. Отметьте время от начала опыта до момента помутнения. Результаты опыта занесите в таблицу 2.2. Рассчитайте скорость реакции по формулам, приведенным в первом опыте. Рассчитайте средний температурный коэффициент реакции:
γср. = (γ1 + γ2)/2, если γ1 =
Сделайте вывод о зависимости скорости реакции от температуры.
Опыт 3. Влияние катализатора на скорость химической реакции. Внесите в пробирку 10 капель пероксида водорода и наблюдайте процесс разложения пероксида водорода (медленное выделение пузырьков газа):
2Н2О2 → 2Н2О + О2
Добавьте к раствору пероксида водорода несколько кристалликов диоксида марганца. К отверстию поднесите тлеющую лучинку. Какую роль играет диоксид марганца в этой реакции?
ОТЧЕТ ПО ЛАБОРАТОРНОЙ РАБОТЕ №2
КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Лабораторная работа №3
ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ РАСТВОРОВ Цель работы: определение точной концентрации приготовленного раствора гидроксида натрия титрованием его 0,1 М раствором серной кислоты. Важнейшие понятия: дисперсные системы, дисперсная фаза, дисперсионная среда, типы дисперсных систем; растворы, растворитель, растворенное вещество, растворимость; концентрация, способы выражения концентраций (молярная, нормальная, моляльная, процентная концентрации, титр); общие свойства растворов (закон Рауля, осмотическое давление) Следует уметь: давать определения важнейшим понятиям, использовать способы выражения концентраций для определения концентрации раствора, уметь перейти от одного способа выражения концентрации к другому; использовать законы, характеризующие общие свойства растворов для нахождения температуры замерзания и температуры кипения растворов, определения молярной массы растворенного вещества, осмотического давления и давления насыщенного пара над раствором.
Экспериментальная часть
Опыт 1. Приготовление раствора гидроксида натрия заданной Нормальной концентрации
Рассчитайте, какую массу NaOH нужно взять для приготовления 0,5 л 0,05 н раствора. На технических весах взвесьте (с точностью до 0,1 г) вычисленную массу. Навеску аккуратно перенесите в мерную колбу объемом 0,5 л и долейте до метки дистиллированной водой. Тщательно перемешайте раствор.
Опыт 2. Определение точной концентрации приготовленного раствора титрованием его серной кислотой известной концентрации. В бюретку налейте 0,1 н раствор H2SO4 почти доверху, осторожно слейте до нулевого значения (следите, чтобы нижняя часть бюретки была заполнена). В коническую колбу отмерьте пипеткой определенный объем щелочи, добавьте 1-2 капли индикатора метилового оранжевого. Затем к данному раствору добавляйте небольшими порциями кислоту из бюретки, непрерывно перемешивая раствор круговыми движениями колбы. Окраска индикатора должна измениться до розовой от одной избыточной капли кислоты. Отметьте объем раствора серной кислоты, пошедшей на титрование. Повторите определение три раза. Расхождение между титрованиями не должно превышать 0,1 мл. Результаты определения занесите в таблицу 3.1. Найдите среднее значение объема кислоты и по формуле рассчитайте нормальную концентрацию щелочи. ОТЧЕТ ПО ЛАБОРАТОРНОЙ РАБОТЕ
ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ РАСТВОРОВ Лабораторная работа № 4
РЕАКЦИИ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Цель работы: проведение реакций ионного обмена, изучение процесса гидролиза солей различного типа. Важнейшие понятия: электролиты, электролитическая диссоциация, степень и константа диссоциации, сильные и слабые электролиты, произведение растворимости, гидролиз соли, степень и константа гидролиза, ионное произведение воды, водородный показатель. Следует уметь: записывать уравнения диссоциации сильных и слабых электролитов, выражение константы диссоциации слабого электролита, сравнивать величину константы диссоциации с силой электролита, записывать молекулярное и ионно-молекулярное уравнения обменного взаимодействия в растворах электролитов, выражать процесс гидролиза с помощью молекулярного и ионно-молекулярного уравнений, объяснять влияние температуры, концентрации соли, введения одноименного иона на степень гидролиза.
Экспериментальная часть
Опыт 1. Реакции в растворах электролитов, идущие с образованием труднорастворимого вещества
Работа выполняется по вариантам.
В пробирку внесите по 5-7 капель растворов исходных веществ. Отметьте цвет образовавшихся осадков. Запишите уравнения реакций ионного обмена в растворах электролитов в молекулярном и ионно-молекулярном виде, а также произведение растворимости труднорастворимого вещества. Таблица растворимости солей и оснований в воде, а также значения констант произведения растворимости находятся на стр. 37, 39 (Приложение, табл. 1, 3). Опыт 2. Реакции, идущие с образованием слабых электролитов Работа выполняется по вариантам.
В пробирку внесите по 5-7 капель растворов исходных веществ (или на кончике шпателя несколько кристалликов твердого вещества). Определите, какие вещества образовались в пробирках. Напишите молекулярные и ионно-молекулярные уравнения реакций. Для этого воспользуйтесь таблицей констант диссоциации слабых кислот и оснований (Приложение, табл. 2).
Опыт 3. Гидролиз солей различного типа Работа выполняется по вариантам.
В пробирку внесите несколько кристалликов соответствующей соли, добавьте дистиллированной воды. С помощью бумажки универсального индикатора определите реакцию среды, сравнивая её окраску с индикаторной шкалой. Запишите уравнения гидролиза в молекулярном и ионно-молекулярном виде, учитывая специфику гидролиза многозарядных ионов.
ОТЧЕТ ПО ЛАБОРАТОРНОЙ РАБОТЕ № 4 РЕАКЦИИ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Цель работы: проведение реакций ионного обмена, изучение процесса гидролиза солей различного типа.
КРАТКИЕ ТЕОРЕТИЧЕСКИЕ ОСНОВЫ РАБОТЫ
Диссоциация это ___________________________________________________ ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Электролитами называются вещества _________________________________ __________________________________________________________________ К электролитам относятся ___________________________________________ Назовите характер проводимости в растворах электролитов: __________________________________________________________________ Степенью диссоциации называется ___________________________________ ____________________________________________________________________________________________________________________________________ К слабым электролитам относятся ____________________________________ Количественной характеристикой диссоциации слабых электролитов является ________________________________________________________________ Введение в раствор одноименного иона смещает ионное равновесие _______ __________________________________________________________________ Произведение растворимости - ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Условием выпадения осадка является __________________________________ ____________________________________________________________________________________________________________________________________ Для сравнения растворимости осадков ________________________________ ____________________________________________________________________________________________________________________________________ Реакции ионного обмена идут необратимо до конца, если 1. ________________________________________________________________ 2. ________________________________________________________________ 3. ________________________________________________________________ 4. ________________________________________________________________ Гидролизом называется _____________________________________________ ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Соль подвергается гидролизу по катиону, если она образована ____________ основанием, _________________ кислотой. Соль подвергается гидролизу по аниону, если она образована _____________ основанием, _________________ кислотой. Соль гидролизуется по катиону и по аниону, если она образована __________ основанием, _________________ кислотой. Соль не подвергается гидролизу, если она образована ____________ основанием, ________________ кислотой. Количественными характеристиками гидролиза являются ________________ ____________________________________________________________________________________________________________________________________ Чтобы усилить гидролиз соли нужно __________________________________ __________________________________________________________________ Водородный показатель (рН) рассчитывается по формуле_________________ Реакция среды в зависимости от рН____________________________________ __________________________________________________________________
Опыт 1. Реакции в растворах электролитов, идущие с образованием труднорастворимого вещества. Молекулярное уравнение реакции: __________________________________________________________________ Полное ионно-молекулярное уравнение реакции: __________________________________________________________________ Краткое ионно-молекулярное уравнение реакции: __________________________________________________________________ Произведение растворимости: ________________________________________ Опыт 2. Реакции идущие с образованием слабых электролитов Молекулярное уравнение реакции: __________________________________________________________________ Полное ионно-молекулярное уравнение реакции: __________________________________________________________________ Краткое ионно-молекулярное уравнение реакции: __________________________________________________________________ Константа диссоциации слабого электролита __________________________________________________________________ Опыт 3. Гидролиз солей различного типа Уравнение диссоциации 1-й соли _____________________________________ Основание и кислота, образовавшие соль: __________________________________________________________________ Гидролиз идет по ___________________________________________________ Ионное уравнение гидролиза: ________________________________________ Молекулярное уравнение гидролиза __________________________________________________________________ 2 ступень гидролиза (если есть) ______________________________________ __________________________________________________________________ 3 ступень гидролиза (если есть) _______________________________________ __________________________________________________________________ Реакция среды, рН среды ____________________________________________
Уравнение диссоциации 2-й соли _____________________________________ Основание и кислота, образовавшие соль: __________________________________________________________________ Гидролиз идет по ___________________________________________________ Ионное уравнение гидролиза: ________________________________________ Молекулярное уравнение гидролиза __________________________________________________________________ 2 ступень гидролиза (если есть) ______________________________________ __________________________________________________________________ 3 ступень гидролиза (если есть) _______________________________________ __________________________________________________________________ Реакция среды, рН среды ____________________________________________
Вывод:____________________________________________________________ ____________________________________________________________________________________________________________________________________
Лабораторная работа № 5
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Цель работы: освоение методики составления уравнений окислительно-восстановительных реакций методом электронного баланса, установление возможности их протекания. Важнейшие понятия: окислительно-восстановительные реакции, степень окисления, процесс окисления и восстановления, окислитель и восстановитель, окислительно-восстановительный потенциал, ЭДС реакции. Следует уметь: определять степень окисления элемента в соединении, находить окислитель и восстановитель, описывать процессы окисления и восстановления, уравнивать окислительно-восстановительные реакции по методу электронного баланса, рассчитывать ЭДС реакции, исходя из значений потенциалов; прогнозировать возможность протекания окислительно-восстановительной реакции.
Экспериментальная часть
Работа выполняется по вариантам: 1.
2. Al + NaOH + H2O → Na[Al(OH)4] + H2; 3. Zn + HCl (р-р)→ ZnCl2 + H2; 4.
5.
В пробирку внесите по 3-4 капли растворов исходных веществ (или кусочек металла). Отметьте изменение окраски раствора, выпадение осадка или выделение газа. Составьте электронные уравнения полуреакций окисления и восстановления, проверьте электронный баланс, полученные коэффициенты расставьте в молекулярном уравнении. Рассчитайте ЭДС реакций, воспользовавшись значениями окислительно-восстановительных потенциалов (Приложение, табл. 5). Сделайте вывод о возможности протекания реакции. ОТЧЕТ ПО ЛАБОРАТОРНОЙ РАБОТЕ №5
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Цель работы: выполнение окислительно-восстановительных реакций, освоение методики составления уравнений окислительно-восстановительных реакций методом электронного баланса, установление возможности их протекания.
КРАТКИЕ ТЕОРЕТИЧЕСКИЕ ОСНОВЫ РАБОТЫ
Степень окисления это ______________________________________________ ____________________________________________________________________________________________________________________________________ Окислительно-восстановительные реакции протекают ___________________ __________________________________________________________________ Окислительно-восстановительные реакции отличаются от реакций обмена __________________________________________________________________ Окислитель ________________________________________________________ Процесс окисления _________________________________________________ __________________________________________________________________ Восстановитель ____________________________________________________ Процесс восстановления _____________________________________________ __________________________________________________________________ Приведите примеры типичных окислителей: ____________________________ __________________________________________________________________ Приведите примеры типичных восстановителей: ________________________ __________________________________________________________________ Окислительно-восстановительная способность веществ количественно характеризуется ______________________________________________________ Для теоретического предсказания возможности протекания окислительно-восстановительной реакции нужно ____________________________________ __________________________________________________________________ Приведите формулу, по которой рассчитывается ЭДС реакции __________________________________________________________________ Лабораторная работа № 6
ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
Цель работы: познакомиться с процессами взаимного превращения химической и электрической энергий на примере работы гальванического элемента и процессов электролиза. Важнейшие понятия: электрод, типы электродов, стандартный электродный потенциал, гальванический элемент, электродвижущая сила элемента, напряжение гальванического элемента, электролиз, катодный и анодный процессы, электрохимический эквивалент, выход по току. Следует уметь: определять тип электрода, составлять электрохимические схемы элементов на основе значений стандартных электродных потенциалов, записывать электродные процессы, рассчитывать равновесный потенциал по уравнению Нернста, электродвижущую силу элемента, связывать ЭДС реакции со свободной энергией Гиббса, записывать процессы электролиза водных растворов и расплавов электролитов, проводить количественные расчеты на основе законов Фарадея.
Экспериментальная часть
Опыт 1. Гальванические элементы Работа выполняется по вариантам
Соберите гальванический элемент из двух металлических электродов, согласно вариантам. Металлические стержни тщательно зачистите наждачной бумагой и погрузите в стаканчики с растворами их солей. Места спая не должны касаться раствора. Соедините стаканчики жидкостным электролитическим мостиком. Подсоедините гальванический элемент к вольтметру и запишите показания прибора. Рассчитайте теоретическую ЭДС гальванического элемента, исходя из значений равновесных электродных потенциалов, рассчитанных по уравнению Нернста. Величины стандартных электродных потенциалов приводятся в таблице 4 (Приложение). Рассчитайте стандартную ЭДС, используя значение свободной энергии Гиббса токообразующей реакции: Сравните полученные значения. Сделайте вывод. Объясните, почему напряжение гальванического элемента меньше его ЭДС.
Опыт 2. Электролиз водных растворов солей а) Электролиз раствора иодида калия Чистый электролизёр заполните раствором иодида калия, угольные электроды погрузите в раствор электролита, соединив их с источником постоянного тока. В прикатодное пространство добавьте 1-2 капли фенолфталеина. Как изменяется окраска индикатора при прохождении постоянного тока? Объясните появление интенсивно-желтой окраски раствора в прианодном пространстве. Какие вещества образовались в прикатодном пространстве? Напишите уравнения электродных процессов и общее уравнение электролиза в молекулярной форме.
б)Электролиз раствора сульфата меди Чистый электролизёр заполните раствором сульфата меди, угольные электроды погрузите в раствор электролита, соединив их с источником постоянного тока. Какое вещество выделяется на катоде? Составьте уравнения электродных процессов. Сделайте вывод об особенности электролиза водных растворов.
ОТЧЕТ ПО ЛАБОРАТОРНОЙ РАБОТЕ №6
ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
Цель работы: познакомиться с процессами взаимного превращения химической и электрической энергий на примере работы гальванического элемента и процессов электролиза.
КРАТКИЕ ТЕОРЕТИЧЕСКИЕ ОСНОВЫ РАБОТЫ
Электрод – это _____________________________________________________ __________________________________________________________________ Электроды 1-го рода – это ___________________________________________ Электроды 2-го рода – это ___________________________________________ Инертные электроды ________________________________________________ Электродный потенциал – это ________________________________________ __________________________________________________________________ Гальванический элемент – это ________________________________________ ____________________________________________________________________________________________________________________________________ Потенциал анода __________________________________ потенциала катода. Анодный процесс __________________________________________________ Катодный процесс __________________________________________________ Уравнение Нернста __________________________________________________________________ ЭДС гальванического элемента _______________________________________ Стандартная ЭДС гальванического элемента рассчитывается по формуле __________________________________________________________________ Напряжение ГЭ ______________ его ЭДС, т.к. __________________________ ____________________________________________________________________________________________________________________________________ __________________________________________________________________ Электролиз – это ___________________________________________________ __________________________________________________________________ Особенностью электролиза водных растворов является __________________ ____________________________________________________________________________________________________________________________________ Электрод будет активным когда ______________________________________ __________________________________________________________________ Первый закон Фарадея: _____________________________________________ __________________________________________________________________ Второй закон Фарадея: ______________________________________________ __________________________________________________________________ Только электролизом расплавов можно получить металлы со _____________ __________________________________________________________________ Выход по току – это ________________________________________________ __________________________________________________________________
Опыт 1. Гальванические элементы
Стандартные потенциалы анода и катода: ______________________________ Схема ГЭ: _________________________________________________________ Электродные процессы: _____________________________________________ __________________________________________________________________ Токообразующая реакция: ___________________________________________ По уравнению Нернста потенциал катода: ______________________________
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 473; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.210.71 (0.018 с.) |


 =
=  ,
, , а γ2 =
, а γ2 =  .
.
 и
и ;
; ;
; ;
; ;
;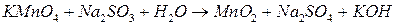 ;
; ;
; (конц.)
(конц.) 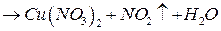 ;
; = 64,98 кДж/моль;
= 64,98 кДж/моль; 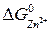 = –147,21 кДж/моль;
= –147,21 кДж/моль;  = –77,74 кДж/моль.
= –77,74 кДж/моль.


