
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Цель работы: определение точной концентрации приготовленного раствора гидроксида натрия титрованием его 0,1 М раствором серной кислоты.
КРАТКИЕ ТЕОРЕТИЧЕСКИЕ ОСНОВЫ РАБОТЫ
Раствором называется ____________________________________________________________________________________________________________________________________
Концентрация раствора определяется ____________________________________________________________________________________________________________________________________ Способы выражения концентрации растворов: 1._________________________________________________________________2._________________________________________________________________3._________________________________________________________________4._________________________________________________________________ 5._________________________________________________________________
Титрование – это ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Титрованный раствор – это __________________________________________________________________
Опыт 1. Приготовление раствора гидроксида натрия заданной нормальной концентрации.
Нормальная концентрация Сн определяется ______________________________________________________________________________________________________________________________________________________________________________________________________и измеряется_______________________________________________________
Молярная масса эквивалента МЭ сложного вещества рассчитывается по формуле __________________________________________________________________и измеряется_______________________________________________________
МЭ гидроксида натрия = _____________________________________________
Масса NaOH, необходимая для приготовления 0,5 л 0,05 н раствора m = __________________________________________________________________
Опыт 2. Определение точной концентрации приготовленного раствора титрованием его серной кислотой известной концентрации.
Используемая при титровании реакция: __________________________________________________________________
Точка эквивалентности ____________________________________________________________________________________________________________________________________устанавливается с помощью ______________________________________________________________________________________________________________________________________________________________________________________________________
Метиловый оранжевый в щелочном растворе окрашен ___________________ в кислом растворе окрашен __________________________________________
Таблица 3.1
Cреднее значение объема кислоты = По формуле
Вывод: ____________________________________________________________________________________________________________________________________
Лабораторная работа № 4
РЕАКЦИИ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Цель работы: проведение реакций ионного обмена, изучение процесса гидролиза солей различного типа. Важнейшие понятия: электролиты, электролитическая диссоциация, степень и константа диссоциации, сильные и слабые электролиты, произведение растворимости, гидролиз соли, степень и константа гидролиза, ионное произведение воды, водородный показатель. Следует уметь: записывать уравнения диссоциации сильных и слабых электролитов, выражение константы диссоциации слабого электролита, сравнивать величину константы диссоциации с силой электролита, записывать молекулярное и ионно-молекулярное уравнения обменного взаимодействия в растворах электролитов, выражать процесс гидролиза с помощью молекулярного и ионно-молекулярного уравнений, объяснять влияние температуры, концентрации соли, введения одноименного иона на степень гидролиза.
Экспериментальная часть
Опыт 1. Реакции в растворах электролитов, идущие с образованием труднорастворимого вещества
Работа выполняется по вариантам.
В пробирку внесите по 5-7 капель растворов исходных веществ. Отметьте цвет образовавшихся осадков. Запишите уравнения реакций ионного обмена в растворах электролитов в молекулярном и ионно-молекулярном виде, а также произведение растворимости труднорастворимого вещества. Таблица растворимости солей и оснований в воде, а также значения констант произведения растворимости находятся на стр. 37, 39 (Приложение, табл. 1, 3). Опыт 2. Реакции, идущие с образованием слабых электролитов Работа выполняется по вариантам.
В пробирку внесите по 5-7 капель растворов исходных веществ (или на кончике шпателя несколько кристалликов твердого вещества). Определите, какие вещества образовались в пробирках. Напишите молекулярные и ионно-молекулярные уравнения реакций. Для этого воспользуйтесь таблицей констант диссоциации слабых кислот и оснований (Приложение, табл. 2).
Опыт 3. Гидролиз солей различного типа Работа выполняется по вариантам.
В пробирку внесите несколько кристалликов соответствующей соли, добавьте дистиллированной воды. С помощью бумажки универсального индикатора определите реакцию среды, сравнивая её окраску с индикаторной шкалой. Запишите уравнения гидролиза в молекулярном и ионно-молекулярном виде, учитывая специфику гидролиза многозарядных ионов.
ОТЧЕТ ПО ЛАБОРАТОРНОЙ РАБОТЕ № 4 РЕАКЦИИ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Цель работы: проведение реакций ионного обмена, изучение процесса гидролиза солей различного типа.
КРАТКИЕ ТЕОРЕТИЧЕСКИЕ ОСНОВЫ РАБОТЫ
Диссоциация это ___________________________________________________ ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Электролитами называются вещества _________________________________ __________________________________________________________________ К электролитам относятся ___________________________________________ Назовите характер проводимости в растворах электролитов: __________________________________________________________________ Степенью диссоциации называется ___________________________________ ____________________________________________________________________________________________________________________________________ К слабым электролитам относятся ____________________________________ Количественной характеристикой диссоциации слабых электролитов является ________________________________________________________________ Введение в раствор одноименного иона смещает ионное равновесие _______ __________________________________________________________________ Произведение растворимости - ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Условием выпадения осадка является __________________________________ ____________________________________________________________________________________________________________________________________ Для сравнения растворимости осадков ________________________________ ____________________________________________________________________________________________________________________________________ Реакции ионного обмена идут необратимо до конца, если 1. ________________________________________________________________ 2. ________________________________________________________________ 3. ________________________________________________________________ 4. ________________________________________________________________ Гидролизом называется _____________________________________________ ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Соль подвергается гидролизу по катиону, если она образована ____________ основанием, _________________ кислотой. Соль подвергается гидролизу по аниону, если она образована _____________ основанием, _________________ кислотой. Соль гидролизуется по катиону и по аниону, если она образована __________ основанием, _________________ кислотой. Соль не подвергается гидролизу, если она образована ____________ основанием, ________________ кислотой. Количественными характеристиками гидролиза являются ________________
____________________________________________________________________________________________________________________________________ Чтобы усилить гидролиз соли нужно __________________________________ __________________________________________________________________ Водородный показатель (рН) рассчитывается по формуле_________________ Реакция среды в зависимости от рН____________________________________ __________________________________________________________________
Опыт 1. Реакции в растворах электролитов, идущие с образованием труднорастворимого вещества. Молекулярное уравнение реакции: __________________________________________________________________ Полное ионно-молекулярное уравнение реакции: __________________________________________________________________ Краткое ионно-молекулярное уравнение реакции: __________________________________________________________________ Произведение растворимости: ________________________________________ Опыт 2. Реакции идущие с образованием слабых электролитов Молекулярное уравнение реакции: __________________________________________________________________ Полное ионно-молекулярное уравнение реакции: __________________________________________________________________ Краткое ионно-молекулярное уравнение реакции: __________________________________________________________________ Константа диссоциации слабого электролита __________________________________________________________________ Опыт 3. Гидролиз солей различного типа Уравнение диссоциации 1-й соли _____________________________________ Основание и кислота, образовавшие соль: __________________________________________________________________ Гидролиз идет по ___________________________________________________ Ионное уравнение гидролиза: ________________________________________ Молекулярное уравнение гидролиза __________________________________________________________________ 2 ступень гидролиза (если есть) ______________________________________ __________________________________________________________________ 3 ступень гидролиза (если есть) _______________________________________ __________________________________________________________________ Реакция среды, рН среды ____________________________________________
Уравнение диссоциации 2-й соли _____________________________________ Основание и кислота, образовавшие соль: __________________________________________________________________ Гидролиз идет по ___________________________________________________ Ионное уравнение гидролиза: ________________________________________ Молекулярное уравнение гидролиза __________________________________________________________________ 2 ступень гидролиза (если есть) ______________________________________ __________________________________________________________________ 3 ступень гидролиза (если есть) _______________________________________ __________________________________________________________________ Реакция среды, рН среды ____________________________________________
Вывод:____________________________________________________________ ____________________________________________________________________________________________________________________________________
Лабораторная работа № 5
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Цель работы: освоение методики составления уравнений окислительно-восстановительных реакций методом электронного баланса, установление возможности их протекания. Важнейшие понятия: окислительно-восстановительные реакции, степень окисления, процесс окисления и восстановления, окислитель и восстановитель, окислительно-восстановительный потенциал, ЭДС реакции. Следует уметь: определять степень окисления элемента в соединении, находить окислитель и восстановитель, описывать процессы окисления и восстановления, уравнивать окислительно-восстановительные реакции по методу электронного баланса, рассчитывать ЭДС реакции, исходя из значений потенциалов; прогнозировать возможность протекания окислительно-восстановительной реакции.
Экспериментальная часть
Работа выполняется по вариантам: 1.
2. Al + NaOH + H2O → Na[Al(OH)4] + H2; 3. Zn + HCl (р-р)→ ZnCl2 + H2; 4.
5.
В пробирку внесите по 3-4 капли растворов исходных веществ (или кусочек металла). Отметьте изменение окраски раствора, выпадение осадка или выделение газа. Составьте электронные уравнения полуреакций окисления и восстановления, проверьте электронный баланс, полученные коэффициенты расставьте в молекулярном уравнении. Рассчитайте ЭДС реакций, воспользовавшись значениями окислительно-восстановительных потенциалов (Приложение, табл. 5). Сделайте вывод о возможности протекания реакции. ОТЧЕТ ПО ЛАБОРАТОРНОЙ РАБОТЕ №5
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Цель работы: выполнение окислительно-восстановительных реакций, освоение методики составления уравнений окислительно-восстановительных реакций методом электронного баланса, установление возможности их протекания.
КРАТКИЕ ТЕОРЕТИЧЕСКИЕ ОСНОВЫ РАБОТЫ
Степень окисления это ______________________________________________ ____________________________________________________________________________________________________________________________________ Окислительно-восстановительные реакции протекают ___________________ __________________________________________________________________ Окислительно-восстановительные реакции отличаются от реакций обмена __________________________________________________________________ Окислитель ________________________________________________________ Процесс окисления _________________________________________________ __________________________________________________________________ Восстановитель ____________________________________________________ Процесс восстановления _____________________________________________ __________________________________________________________________ Приведите примеры типичных окислителей: ____________________________ __________________________________________________________________ Приведите примеры типичных восстановителей: ________________________ __________________________________________________________________ Окислительно-восстановительная способность веществ количественно характеризуется ______________________________________________________ Для теоретического предсказания возможности протекания окислительно-восстановительной реакции нужно ____________________________________
__________________________________________________________________ Приведите формулу, по которой рассчитывается ЭДС реакции __________________________________________________________________
|
||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 430; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.36.30 (0.075 с.) |



 , где
, где  – концентрация щелочи,
– концентрация щелочи,  - концентрация кислоты, рассчитайте нормальную концентрацию щелочи.
- концентрация кислоты, рассчитайте нормальную концентрацию щелочи. ;
; ;
; ;
; ;
;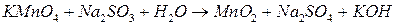 ;
; ;
; (конц.)
(конц.) 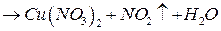 ;
;


