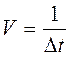Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Изучение зависимости скорости химической реакции от концентрации реагирующих веществ и температурыСодержание книги
Поиск на нашем сайте ЦЕЛЬ: Изучить влияние концентрации и температуры на скорость химического процесса. Оборудование: Мерные пробирки -2 шт; штатив с пробирками - 1шт.; секундомер - 1 шт. Реактивы: Раствор серной кислоты-0,2 моль/л; раствор тиосульфата натрия (Na2S2О3)-0,2 моль/л; водадистиллированная. ОПЫТ № 1. Зависимость скорости реакции от концентрации Зависимость скорости химической реакции от концентрации реагирующих веществ может быть изучена на примере взаимодействия тиосульфата натрия с серной кислотой: Na2S2O3 + Н2S04 ® Na2S04 + H2SO3 + S ¯ Методика эксперимента: Для изучения зависимости скорости химической реакции от концентрации реагирующих веществ приготовить 3 пробирки, в которые налить различные (обозначенные в таблице 1) объемы раствора тиосульфата натрия. К каждому из приготовленных растворов пользуясь мерной пробиркой при перемешивании прилить дистиллированную воду, а затем по 2,0 мл 0,2 моль/л раствора серной кислоты. Отметить и записать в таблицу 1 время, за которое после добавления серной кислоты в пробирке наблюдалось образование осадка коллоидной серы (появление мути). Проделать опыты с различными количествами тиосульфата натрия (отмеченными в таблице 1). Быстро вымыть использованные пробирки. На основе полученных Вами экспериментальных данных рассчитать скорость химической реакции и построить на миллиметровой бумаге зависимость скорости реакции от концентрации тиосульфата натрия V = f[С].
Таблица 1
Рис.1 Зависимость скорости реакции от концентрации Na2S2O3
Сделать вывод о характере зависимости скорости реакции от концентрации. Вывод:
______________________________________________________________________________________________________________________________________ ___________________________________________________________________ Опыт № 2. Влияние температуры на скорость химической реакции Пользуясь мерными пробирками, слить в 3 пробирки по 2 мл 0,2 моль/л раствора серной кислоты и по 3 мл дистиллированной воды, а в 3 другие - налить по 2 мл 0,2 моль/л раствора тиосульфата натрия. Две пробирки (одна с H2S04, а другая с Nа2S2О3) поместить на водяную баню, температура воды в которой не выше 25° С. Через 3 минуты содержимое пробирок слить вместе, отметить время с момента слияния растворов до начала помутнения содержимого нагреваемой пробирки. Опыт с последующей парой пробирок проводить при температуре на 10° С выше предыдущей (например, 35°С), отсчитывая время до момента помутнения раствора. Опыт с последней парой проводить при температуре на 20°С выше первоначальной (например, при 45° С). Аналогично фиксировать окончание реакции. Данные внести в таблицу 2. Построить на миллиметровой бумаге график зависимости скорости реакции от температуры. Таблица 2
Рис.2 Зависимость скорости реакции от температуры Сделать вывод о характере зависимости скорости реакции от температуры. Вывод:
______________________________________________________________________________________________________________________________________ ______________________________________________________________________________________________________________________________________ Вопросы к защите работы: 1. Во сколько раз следует увеличить концентрацию водорода, чтобы скорость реакции N2 + 3Н2 ————— > 2NH3, возросла в 1000 раз?
___________________________________________________________________ ___________________________________________________________________
2. Влияет ли изменение концентрации реагирующих веществ на: а) скорость реакции;
б) константу скорости реакции.
3. Как изменится скорость реакции при увеличении температуры от 20°С до 80°С при температурном коэффициенте, равном 2?
___________________________________________________________________ ___________________________________________________________________
Занятие 1.2.1. Химия биогенных элементов. Химия биогенных элементов S-блока. Лабораторная работа № 5 Химические свойства S-элементов, их применение в медицине Цель: Познакомиться с химическими свойствами S-элементов, определяющих их биологическую значимость и применение в медицине. Оборудование и реактивы: 1% раствор NaHCO3, 1% раствор Na2B4O7, 1% раствор NaCl, концентрированный раствор NaOH, 0,01 М раствор KMnO4, 3% раствор H2O2, 1% раствор NaOH, 5% раствор CH3COOH, желудочный сок,10% раствор СаСl2, 10% раствор BaCl2, 10% раствор H2SO4, MgO твердый, CaSO4´1/2 H2O (гипс), фосфатный буферный раствор, щавелевая кислота (НООС-СООН), стеариновая кислота, 5% раствор фторида натрия, фенолфталеин, белок, картофель.
|
||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 236; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.005 с.) |

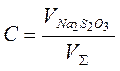 V S = V(Na2S2O3)+V(H2O)+ V (H2SO4)
V S = V(Na2S2O3)+V(H2O)+ V (H2SO4)