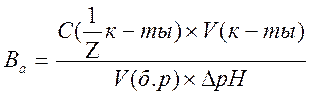Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение осмотической концентрации и изотонического коэффициента раствора электролитаСодержание книги
Поиск на нашем сайте
Цель: Приобрести навыки физико-химических измерений и обработки результатов эксперимента на примере криометрического определения осмотической концентрации и изотонического коэффициента 5%-ного раствора натрия сульфата. Оборудование: Прибор для криометрических измерений. Термометр для измерения температуры в области ее отрицательных значений с ценой деления 0,1 К. Реактивы: Дистиллированная вода, лед колотый (снег), натрий хлорид технический, исследуемый раствор. Выполнение эксперимента: Получите у лаборанта прибор для криометрических определений. Прибор (рис. 1) состоит из широкой стеклянной пробирки 1, закрытой пробкой, в которую вставлены термометр 2 и металлическая мешалка 3. Пробирку помещают в толстостенный стакан 4, в котором готовят охлаждающую смесь.
Приготовьте охлаждающую смесь из 3 ч. снега или льда и 1 ч. NaCl. Поместите смесь в сосуд 4. Измерьте термометром температуру охлаждающей смеси. Она должна быть около -5°С. Охлаждающая смесь должна заполнять стакан примерно на 3/4 его объема.
В пробирку 1 налейте такой объем дистиллированной воды, чтобы полностью покрыть резервуар термометра, закройте пробирку пробкой с термометром и мешалкой и поместите пробирку в стакан с охлаждающей смесью. Непрерывно помешивая воду мешалкой 3 (старайтесь не касаться мешалкой термометра), следите за изменением температуры. Следите, чтобы термометр не касался дна и стенок пробирки 1. Обычно температура опускается немного ниже точки замерзания воды, затем начинается кристаллизация, выделяется энергия и столбик ртути или спирта резко поднимается вверх и затем застывает на значении температуры кристаллизации воды (около 0°С). Отметьте температуру замерзания воды, запишите ее в журнал с точностью, которую позволяет зафиксировать используемый вами термометр. Выньте пробирку из охлаждающей смеси и, подогревая ее рукой, полностью растворите образовавшиеся кристаллы льда. Снова опустите пробирку в охлаждающую смесь и повторите определение температуры замерзания воды. Получите у преподавателя склянку с анализируемым раствором и запишите в журнал данные о растворе. Сполосните пробирку 1 анализируемым раствором и заполните ее раствором так же, как и при измерении температуры замерзания воды. Закройте пробирку пробкой, вставьте в нее термометр и мешалку (предварительно и то и другое должно быть сполоснуто анализируемым раствором). Определите температуру начала замерзания раствора, как определяли температуру замерзания воды. Все измерения запишите в лабораторный журнал. После работы разберите прибор для криоскопических измерений. Вылейте раствор из пробирки 1. Сполосните водопроводной и дистиллированной водой. Вымойте стакан 4. Обработка результатов эксперимента: Рассчитайте моляльную концентрацию анализируемого раствора. По экспериментально найденному понижению температуры замерзания раствора по сравнению с температурой замерзания воды рассчитайте реальную осмотическую концентрацию ионов в растворе. Найдите изотонический коэффициент раствора, как частное от деления действующей концентрации ионов (ib) на концентрацию вещества (b). Сравните найденное значение с максимальным для раствора данного вещества. Объясните возможные причины отклонений. Расчёты: _________________________________________________________________________________________________________________________________________________________________________________________________________ _________________________________________________________________________________________________________________________________________________________________________________________________________ _________________________________________________________________________________________________________________________________________________________________________________________________________ _________________________________________________________________________________________________________________________________________________________________________________________________________ _________________________________________________________________________________________________________________________________________________________________________________________________________ _________________________________________________________________________________________________________________________________________________________________________________________________________ _________________________________________________________________________________________________________________________________________________________________________________________________________ _________________________________________________________________________________________________________________________________________________________________________________________________________ _________________________________________________________________________________________________________________________________________________________________________________________________________ _________________________________________________________________________________________________________________________________________________________________________________________________________ Выводы: _________________________________________________________________________________________________________________________________________________________________________________________________________ _________________________________________________________________________________________________________________________________________________________________________________________________________ Вопросы к защите работы: 1. Приведите примеры растворов, для которых изотонический коэффициент может иметь максимальное значение, равное 2. ______________________________________________________________________________________________________________________________________ ___________________________________________________________________ 2. При какой температуре будет закипать 5% раствор Na2S04? _________________________________________________________________________________________________________________________________________________________________________________________________________ _________________________________________________________________________________________________________________________________________________________________________________________________________ 3. Оцените осмотическое давление анализируемого раствора при 37°С.
______________________________________________________________________________________________________________________________________ _________________________________________________________________________________________________________________________________________________________________________________________________________
Занятие 1.1.4. ТЕМА: Протолитические реакции. Буферные растворы. ЦЕЛЬ: На основе теории кислотно-основных равновесий уяснить сущность протолитических процессов, протекающих в организме, механизмов действия буферных систем организма, их взаимосвязь и роль в поддержании кислотно-основного гомеостаза. Лабораторная работа №3 Свойства буферных растворов ЦЕЛЬ: Приобрести навыки в приготовлении буферных смесей с определенным значением рН; изучить некоторые свойства буферных растворов. Оборудование: Штатив с пробирками, бюретки-3 шт., пипетки вместимостью 2 и 10 мл, конические колбы вместимостью 50 мл. Реактивы: Растворы уксусной кислоты (0,1 и 1 моль/л), натрия ацетата (0,1 и 0,01 моль/л), НС1 (0,1 и 0,01 моль/л), NaOH (0,1 моль/л), 0,9%-ный NaCI; раствор универсального индикатора или универсальная индикаторная бумага и цветные таблицы для определения рН по окраске универсального индикатора. Выполнение эксперимента. Опыт 1. Приготовление буферных смесей с различным значением рН.
В три одинаковые пробирки налейте из бюретки растворы уксусной кислоты (С = 0,1 моль/л) и натрия ацетата той же концентрации в объемах, указанных в таблице 1. Таблица 1
Прибавьте к каждому раствору по 3 капли раствора универсального индикатора. Сравните окраску растворов с окраской в специальной цветной таблице, прилагаемой к универсальному индикатору, при различных значениях рН. Запишите в таблицу 1 значения рН для каждого из растворов. Рассчитайте рН и также запишите их в таблицу.
___________________________________________________________________
Сравните действительные значения рН растворов с расчетными, сделайте выводы. Растворы сохраните для проведения следующих опытов.
Выводы:
______________________________________________________________________________________________________________________________________
Опыт 2. Влияние разбавления на рН буферной смеси.
Возьмите две чистые пробирки и отберите в них из пробирки № 2 пипеткой 1,0 и 2,0 мл буферного раствора. Разбавьте отобранные растворы водой в 10 и 5 раз соответственно. Прибавьте в разбавленные растворы по 3 капли раствора универсального индикатора. Сравните окраску в этих пробирках с окраской исходного раствора и с окраской в цветной таблице для универсального индикатора. Изменяется ли рН при разведении буферного раствора? Сделайте выводы. Выводы:
______________________________________________________________________________________________________________________________________
Опыт 3. Действие на буферные растворы кислот и щелочей.
Возьмите 3 чистые пробирки. В одну из них отберите пипеткой 5,0 мл буфера, приготовленного в опыте 1 в пробирке № 3. В другую чистую пробирку налейте 5 мл дистиллированной воды, в 3-ю - 5 мл 0,9%-ного раствора NaCI. В пробирки с водой и NaCI прибавьте по 3 капли раствора универсального индикатора. Для записи результатов наблюдений составьте таблицу №2: Запишите в таблицу исходные значения рН растворов, определенные по окраске универсального индикатора. Прибавьте в пробирки по 1,00 мл раствора НС1 (С=0,01 моль/л). Как изменяется окраска растворов в пробирках? Запишите новые значения рН растворов. Затем прибавьте в эти же пробирки по 1,0 мл 0,1 моль/л раствора НС1. Запишите также полученные значения рН растворов. Таблица №2
Проделайте опыт, аналогичный опыту 3 с той лишь разницей, что в качестве исследуемого ацетатного буфера используйте буферный раствор, приготовленный в опыте 1 в пробирке № 1. К 5 мл буфера, воды и раствора NaCI прибавьте по 1,0 мл раствора NaOH вначале с концентрацией 0,01 моль/л, а затем с концентрацией 0,1 моль/л. Запишите также полученные значения рН растворов в таблицу №3 Таблица №3
Сформулируйте выводы из опыта, основанные на наблюдениях. Выводы:
______________________________________________________________________________________________________________________________________ Опыт 4. Определение буферной емкости. Для записи результатов опыта составьте таблицу по форме: Из пробирки с раствором буферной смеси №2 отберите пипеткой в титровальную колбу 2,00 мл буфера и титруйте раствором кислоты до явного изменения окраски раствора. Запишите объем кислоты и значение рН раствора, которое определите, сравнивая окраску раствора с цветной таблицей для универсального индикатора. Повторите опыт еще 2 раза. Затем то же самое проделайте с раствором №3. Рассчитайте значение буферной емкости анализируемых растворов по формуле:
Все данные запишите в таблицу 4. Таблица 4
Расчёты: ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Сравните полученные результаты, сделайте выводы. Выводы: ______________________________________________________________________________________________________________________________________ __________________________________________________________________ Вопросы к защите работы 1. Приведите примеры буферных систем с рН больше или меньше 7 при равных концентрациях кислоты и сопряженного основания. ______________________________________________________________________________________________________________________________________ 2. В каком направлении изменится рН буферной системы NH4Cl/NH3 при добавлении NH4Cl?
______________________________________________________________________________________________________________________________________ 3. Какой из двух буферных растворов характеризуется меньшим значением рН: а) NaH2P04 / Na2НР04 б) NH4Cl / NН3 - если в обоих случаях соотношение [кислота] / [соль ] одинаково? ______________________________________________________________________________________________________________________________________ ___________________________________________________________________ 4. Как изменится буферная емкость при разведении буферов? Изменится ли при этом рН? ______________________________________________________________________________________________________________________________________ ___________________________________________________________________ Занятие 1.1.5. ТЕМА: Химическая кинетика и катализ. ЦЕЛЬ: На основе законов кинетики химических реакций научится рассчитывать основные кинетические параметры и экспериментально изучит влияние различных факторов на скорость реакции.
Лабораторная работа №4
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 238; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.120.112 (0.01 с.) |

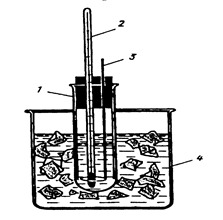 Рисунок 1
Рисунок 1