
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Яким є порядок діаметра атома. Наведіть порівняння, які дозволяють уявити, наскільки молекули (атоми) є малими.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Сучасні методи вимірювання дають змогу визначити розміри молекул і атомів, які приблизно однакові для молекул кожної речовини і мають той самий порядок Молекули і атоми настільки малі, що уявити їх розміри модна тільки порівнянням. Так, атом заліза у стільки разів менший за волоський горіх, у скільки горіх менший за Місяць. Якщо збільшити молекулу води до розмірів головки шпильки, то сама головка за такого самого збільшення була б більша за найвищу гору Землі – Джомолунгму. 6. Відносна атомна маса речовини
Відносна атомна маса вимірюється в атомних одиницях маси 7. Атомна одиниця маси – дорівнює
8. Наведіть порівняння, які дозволяють уявити, наскільки молекули є численними. В 1 г води міститься 9. Кількість речовини – це відношення кількості молекул
Кількість речовини можна також визначити відношенням маси тіла маси речовини з якої воно виготовлене 10. 1 моль – це така кількість речовини, яка містить стільки само атомів, молекул чи інших структурних елементів, скільки атомів міститься в 0,012кг вуглецю С-12. Очевидно, що в 1 молі будь-якої речовини міститься однакова кількість атомів і молекул. 11. Стала Авогадро
12. Молярна маса Щоб визначити молярну масу достатньо масу молекули речовини
13. Як пов’язані відносна молекулярна
14. Густина
Густину речовини можна визначити якщо масу її молекули Концентрацію
15. Концентрація
16. Фізичні явища, що є доказом взаємодії молекул: виникнення сил пружності внаслідок деформації тіла.
17. Експериментальні факти, що підтверджують взаємодію між молекулами: a) Два свинцеві відполіровані циліндри при стискуванні злипаються настільки сильно, що витримують підвішування до них тягаря в декілька кілограмів; b) Утворення на різальних інструментах «наросту» металу, який ріжеться; c) Виготовлення деталей методом порошкової металургії: d) Якщо заповненні полу свинцеву кулю водою і заварити її, а потім почати стискати, то вода почне просочуватись крізь стінки кулі. 18. Природа сил міжмолекулярної взаємодії: електромагнітна природа. 19. Відстані на яких проявляються сили міжмолекулярної взаємодії: вони короткодіючі і суттєво залежать від відстані між молекулами (сили притягання 20.
21. Основні агрегатні стани речовини: твердий, рідкий і газоподібний. 22. Фазовий перехід речовини у фізиці означає таку трансформацію внутрішньої структури речовин, при якій відбувається різкий стрибок певної фізичної характеристики системи, викликаний малою зміною іншої характеристики. Розрізняють фазові переходи першого і другого роду. Різні фази тієї самої речовини можуть знаходитися у рівновазі, стикаючись одна з одною. Подібна рівновага спостерігається лише в обмеженому інтервалі температур. Температури, при яких речовина переходить з однієї фази у іншу називають температурою переходу (перетворення). Загалом розрізняють три температури переходу, які залежать від тиску (перша – найменше) а) температура плавлення; б) температура пароутворення; в) температура сублімації (возгонки). За умови, що зовнішній тиск є нормальним (760 мм.рт.ст.) і залишається сталим говорять про: а) точку плавлення при переході з твердої фази у рідку або про точку затвердіння для зворотного переходу; б) точку кипіння при переході рідини у газ (пару) або про точку зрідження (конденсації) для зворотного переходу; в) точку сублімації (возгонки) при переході тіла у газоподібний стан (в деяких випадках такий перехід можливий за нормального тиску).
Перехід речовини з однієї фази в іншу супроводжується поглинанням або виділенням енергії, яка називається теплотою фазового перетворення. Переходи, які супроводжуються поглинанням або виділенням теплоти, називають фазовими переходами першого роду. Під час фазових переходів речовини першого роду змінюється порядок розташування молекул в речовині, характер їх руху та сили міжмолекулярної взаємодії. 23. Твердий стан речовини Молекули й атоми твердих тіл розташовані в певному строгому порядку дуже близько одна від одної. Вони так міцно зв’язані між собою, що можуть лише коливатися біля положень рівноваги в яких рівнодійна сил міжмолекулярної взаємодії притягання і відштовхування рівна нулю. Тому тверді тіла зберігають свою форму і об’єм. 24. Рідкий стан речовини У рідинах зберігається тільки ближній порядок у розташуванні молекул і взаємодія між молекулами слабша, ніж у твердих тілах, але все ж таки вона є доволі сильною, тому молекули втримуються одна біля одної і як наслідок рідини зберігають свій об’єм. Відстань між молекулами більша ніж в твердих тілах і взаємодія між молекулами не настільки велика як в твердих тілах, тому молекули рідини не тільки здійснюють коливальний рух біля положень рівноваги, але й час від часу можуть перепригувати з одного положення в інше, саме цим пояснюється головна властивість рідини – текучість, тобто здатність текти і не зберігати свою форму. 25. Газоподібний стан речовини У газах відстані між молекулами у тисячі разів більші, ніж у рідинах, відповідно відсутній будь-який порядок у розташуванні молекул газу. Молекули газів вільно рухаються, здійснюючи безладний тепловий рух і переміщуються на значні відстані, тому що молекули слабко притягуються одна до одної. Як наслідок гази не зберігають ні форми ні об’єму. 26. Ідеальний газ – це газ, в якому молекули можна вважати матеріальними точками, а силами притягання й відштовхування між молекулами можна знехтувати. Це модель МКТ, тобто в природі ідеального газу не існує. Реальний газ набуває властивостей ідеального при значному розрідженні, коли середня відстань між молекулами набагато більша за їх розміри.
27. Макроскопічні параметри ідеального газу – це параметри, які характеризують систему як одне ціле і їх можна безпосередньо виміряти: тиск, об’єм, температура, густина 28. Мікроскопічні параметри ідеального газу – це параметри, які характеризують систему з точки зору її внутрішноьї будови, тобто параметри які характеризують окремо взяту молекулу газу: маса, швидкість молекул, їх кінетична енергія. 29. Тиск газу спричинений ударами об стінку посудини великої кількості молекул, які передають їй свій імпульс. 30. Середня квадратична швидкість
31.
32. Основне рівняння МКТ встановлює зв’язок між мікроскопічним та макроскопічними параметрами системи.
Якщо скористатись формулами для густини речовини
33. Теплова рівновага – стан при якому всі тіла мають однакову температуру. З часом будь-яка система переходить стан теплової рівноваги. 34. Температура
Температура є макроскопічним параметром термодинамічної системи, оскільки характеризує середньостатистичне значення кінетичної енергії молекул.
35. Зв’язок між середньою кінетичною енергії руху атомів і молекул речовини
36. Стала Больцмана
37. Зв’язок між тиском
38. Шкала Кельвіна (абсолютна температурна шкала) введена з міркувань того, що температура є мірою середньої кінетичної енергії руху атомів і молекул речовини і, оскільки мінімальна можлива швидкість поступального руху молекул (а відповідно і кінетична енергія) рівна нуль, то й і мінімальна можлива температура теж має дорівнювати нулю. Ця температура називається абсолютним нулем температури. Зміна температури за шкалою Цельсія така сама як і за шкалою Кельвіна, тобто 39. Шкала Цельсія – вводиться з міркувань, що за
40. Співвідношення, що визначають зв’язок між температурним шкалами Цельсія і Кельвіна
41. Рівняння стану ідеального газу (рівняння Менделєєва – Клапейрона) встановлює взаємозв’язок між макроскопічними параметрами системи тиском
42. Універсальна газова стала
43. Рівняння стану ідеального газу (рівняння Клапейрона) встановлює взаємозв’язок між макроскопічними параметрами системи тиском
44. Ізопроцес – процес зміни стану газу за незмінному одному з параметрів системи. 45. Ізотермічний процес - процес зміни стану газу при незмінній температурі. 46. Закон Бойля – Маріотта: для газу сталої маси при незмінній температурі добуток тиску на об’єм є величиною сталою.
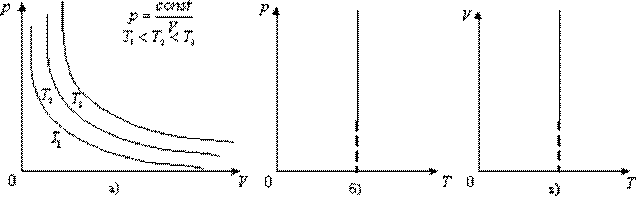
47. Графіки ізотермічного процесу – ізотерми.
Графічно залежність тиску газу від об'єму при умові T = const можна зобразити у вигляді кривої - ізотерми в координатах p, V і прямих ліній в координатах p, T та V, T
48. Ізобарний процес – процес зміни стану газу за незмінного тиску. 49. Закон Гей – Люссака: для газу сталої маси при незмінному тиску відношення об’єму газу до його температури є величиною сталою.
Закон Гей – Люссака: за сталого тиску відносна зміна об’єму газу сталої маси прямо пропорційна зміні температури
|
|||||||||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 742; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.189.14.251 (0.012 с.) |

 .
. - відношення маси атома
- відношення маси атома  даної речовини до
даної речовини до  маси атома вуглецю
маси атома вуглецю  :
:

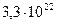 молекул. Це число величезне. Воно незмірно більше за кількість склянок води, яка міститься у всіх морях, океанах, річках.
молекул. Це число величезне. Воно незмірно більше за кількість склянок води, яка міститься у всіх морях, океанах, річках. у даному тілі до кількості атомів
у даному тілі до кількості атомів  в 0,012 кг вуглецю С-12.
в 0,012 кг вуглецю С-12.
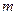 до молярної
до молярної

 помножити на сталу Авогадро
помножити на сталу Авогадро 

 – фізична величина, що дорівнює масі речовини в одиниці об’єму і визначається відношенням маси тіла
– фізична величина, що дорівнює масі речовини в одиниці об’єму і визначається відношенням маси тіла  .
.
 речовини
речовини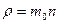

 , сили відштовхування
, сили відштовхування  ). Сила взаємодії практично відсутня, коли молекули знаходяться на відстанях, що в кілька разів перевищують їх розміри.
). Сила взаємодії практично відсутня, коли молекули знаходяться на відстанях, що в кілька разів перевищують їх розміри. Графік залежності сил міжмолекулярної взаємодії двох молекул від відстані між цими молекулами. Залежність сил взаємодії молекул F від відстані між ними можна зобразити графічно, вважаючи сили відштовхування додатними, а сили притягання — від'ємними. Нехай одна з молекул знаходиться в початку координат, а друга — на деякій відстані г, від неї. Між ними діє дуже мала сила взаємного притягання і ще менша сила відштовхування. В міру зближення молекул спочатку швидше зростає сила притягання, а потім — сила відштовхування. На відстані r0, що становить приблизно суму радіусів молекул, сила притягання дорівнює силі відштовхування. Ця відстань OВ = г0 відповідає положенню стійкої рівноваги молекул і називається рівноважною. При дальшому зближенні молекул (r < r0) сила відштовхування переважає силу притягання. На графіку показано також залежність рівнодійної сил взаємодії двох частинок від відстані між ними. Ця сила дорівнює алгебраїчній сумі сил відштовхування і притягання. Кожна ордината кривої взаємодії, яка відповідає будь-якій відстані r, є результатом алгебраїчного додавання ординат двох перших кривих. Крива зміни сили взаємодії молекул показує, що при відстанях між частинками r > r0 переважають сили взаємного притягання, а при r < r0 — сили відштовхування. Це пояснює виникнення сил пружності під час деформації тіл.
Графік залежності сил міжмолекулярної взаємодії двох молекул від відстані між цими молекулами. Залежність сил взаємодії молекул F від відстані між ними можна зобразити графічно, вважаючи сили відштовхування додатними, а сили притягання — від'ємними. Нехай одна з молекул знаходиться в початку координат, а друга — на деякій відстані г, від неї. Між ними діє дуже мала сила взаємного притягання і ще менша сила відштовхування. В міру зближення молекул спочатку швидше зростає сила притягання, а потім — сила відштовхування. На відстані r0, що становить приблизно суму радіусів молекул, сила притягання дорівнює силі відштовхування. Ця відстань OВ = г0 відповідає положенню стійкої рівноваги молекул і називається рівноважною. При дальшому зближенні молекул (r < r0) сила відштовхування переважає силу притягання. На графіку показано також залежність рівнодійної сил взаємодії двох частинок від відстані між ними. Ця сила дорівнює алгебраїчній сумі сил відштовхування і притягання. Кожна ордината кривої взаємодії, яка відповідає будь-якій відстані r, є результатом алгебраїчного додавання ординат двох перших кривих. Крива зміни сили взаємодії молекул показує, що при відстанях між частинками r > r0 переважають сили взаємного притягання, а при r < r0 — сили відштовхування. Це пояснює виникнення сил пружності під час деформації тіл. -величина, що визначається як квадратний корінь середнього значення квадрату швидкості молекул
-величина, що визначається як квадратний корінь середнього значення квадрату швидкості молекул
 Визначення швидкості руху молекул газу вперше здійснив у 1920 році німецький фізик Отто Штерн. Прилад складався з двох жорстко з’єднаних коаксіальних циліндрів, по осі яких натягувалася покрита сріблом платинова дротина. Внутрішній циліндр А мав дуже вузький проріз (щілину) вздовж твірної. У приладі створювався високий вакуум. Платинова дротина нагрівалась електричним струмом і при досить високій температурі з поверхні дротини випаровувалось срібло. Всередині внутрішнього циліндра утворювався одноатомний газ срібла. Частина атомів срібла потрапляли через щілину у простір між циліндрами і осідала на поверхні зовнішнього циліндра, утворюючи шар у вигляді вузької смужки, ширина якої приблизно дорівнювала ширині щілини. Якщо привести циліндри в обертання з кутовою швидкістю
Визначення швидкості руху молекул газу вперше здійснив у 1920 році німецький фізик Отто Штерн. Прилад складався з двох жорстко з’єднаних коаксіальних циліндрів, по осі яких натягувалася покрита сріблом платинова дротина. Внутрішній циліндр А мав дуже вузький проріз (щілину) вздовж твірної. У приладі створювався високий вакуум. Платинова дротина нагрівалась електричним струмом і при досить високій температурі з поверхні дротини випаровувалось срібло. Всередині внутрішнього циліндра утворювався одноатомний газ срібла. Частина атомів срібла потрапляли через щілину у простір між циліндрами і осідала на поверхні зовнішнього циліндра, утворюючи шар у вигляді вузької смужки, ширина якої приблизно дорівнювала ширині щілини. Якщо привести циліндри в обертання з кутовою швидкістю 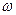 , то за час
, то за час 
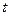 , поки молекула пролетить відстань від внутрішнього циліндра до зовнішнього, циліндри повернуться на деякий кут
, поки молекула пролетить відстань від внутрішнього циліндра до зовнішнього, циліндри повернуться на деякий кут 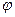 і молекула потрапить не в те місце, куди потрапляла при нерухомих циліндрах, а зміститься на деяку відстань
і молекула потрапить не в те місце, куди потрапляла при нерухомих циліндрах, а зміститься на деяку відстань  (див. рис.) тоді швидкість руху молекул
(див. рис.) тоді швидкість руху молекул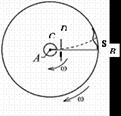


 , то останнє рівняння можна переписати наступним чином:
, то останнє рівняння можна переписати наступним чином:
 – фізична величина, що є мірою середньої кінетичної енергії руху атомів і молекул речовини; величина. Що характеризує ступінь нагрітості тіла.
– фізична величина, що є мірою середньої кінетичної енергії руху атомів і молекул речовини; величина. Що характеризує ступінь нагрітості тіла.
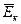 та її температурою
та її температурою 
 -фізична величина, що показує на скільки зміниться середня кінетична енергія молекули речовини при зміні її температури на 1К
-фізична величина, що показує на скільки зміниться середня кінетична енергія молекули речовини при зміні її температури на 1К
 і температурою
і температурою 
 .
. приймається температура при якій відбувається танення льоду, а за
приймається температура при якій відбувається танення льоду, а за  - температура кипіння води.
- температура кипіння води.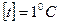

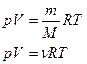
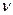 - кількість речовини,
- кількість речовини,  - універсальна газова стала
- універсальна газова стала






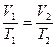
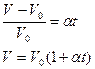
 - температурний коефіцієнт об’ємного розширення газу
- температурний коефіцієнт об’ємного розширення газу


