
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава V. Третий закон термодинамики.
Недостаточность I и II законов термодинамики Для расчета химического сродства. Использование первого и второго законов термодинамики для расчетов химического сродства связано с решением дифференциальных уравнений. Их интегрирование приводит к появлению констант интегрирования, значения которых не могут быть найдены. Например, при расчете химического сродства по уравнению изотермы химической реакции (4.92) появляется необходимость интегрирования уравнений изобары или изохоры (4.95, 4.96). При этом появляется неопределенная const интегрирования:
где поэтому окончательно:
В полученное уравнение входят теплоемкости веществ, участвующих в реакции в зависимости от температуры вплоть до Т, а также тепловой эффект химической реакции при одной из температур в интервале, включающем Т. Теплоемкости и тепловые эффекты являются термическими величинами. Их измерения производятся в калориметрах различных типов. Наиболее сложным является определение константы равновесия реакции, т. к. ее расчет невозможен в силу неопределенности const. Расчет сродства возможен и по уравнению (4.56):
где
интегрирование которого приводит к следующему результату:
где величина const не определена. Таким образом, решение основной задачи химической термодинамики - расчета величины химического сродства наталкивается на недостаточность первого и второго законов термодинамики. Выход из этой неопределенности можно искать в двух направлениях. Во-первых, можно находить значение const эмпирическим путем, о чем уже говорилось выше. Но создание соответствующей целям измерения аппаратуры, особенно для изучения высокотемпературных металлургических реакций, связано с большими трудностями, а кроме того, достижение равновесия во многих случаях требует длительного времени. Развитие химической промышленности и металлургии в начале века потребовало многочисленных данных для расчета химического сродства, причем только на основании сравнительно простых измерений термических величин. Поэтому потребовалось отыскание общего, дополнительного к обоим законам термодинамики начального условия, позволяющего находить значения константы интегрирования, не прибегая к прямому эксперименту. Эту задачу впервые решил В. Нернст в 1906 г. Его работы, а также работы М. Планка привели к введению новых теорем и постулатов, составивших содержание третьего начала термодинамики.
Тепловая теорема Нернста. Обобщенное уравнение Гиббса - Гельмгольца в дифференциальной форме записи имеет вид (4.42):
После умножения правой и левой его частей на
или
После интегрирования:
или в более удобной форме записи:
Урвнение (5.4) - интегральная форма записи уравнения Гиббса - Гельмгольца.
Для выбора правильной А - кривой достаточно найти одно значение А1 при какой-либо Т1, отличной от нуля. Это тот эмпирический путь, условия реализации которого были описаны ранее. Теорема Нернста позволяет сделать правильный выбор более общим способом. Им было установлено на основании многочисленных экспериментальных данных, что в конденсированных системах Q - кривая и А - кривая сливаются вблизи абсолютного нуля температуры (тепловая теорема Нерста).
Конденсированными называются системы, состоящие из чистых совершенно однородных твердых кристаллических тел, не образующих между собой растворов. Для дальнейшего использования теоремы Нернста ее необходимо выразить в аналитической форме. Слияние двух кривых определяется слиянием их касательных, т. е. равенством пределов их производных при Т
Для отыскания значения общего предела производных, следует вновь обратиться к уравнению Гиббса - Гельмгольца, переписанному в виде:
При Т0 = 0 выражение (5.6) обращается в неопределенность, так как А0 = Q0 и
Знаменатель этого выражения равен единице, а числитель, согласно (5.5), обращается в ноль. Поэтому:
и согласно тому же (5.5):
Итак, общая касательная кривых Q и А = f (T) параллельна температурной оси (рис. 5.1), что и определяет правильность выбора А = f (T) - кривой. В дальнейшем теорема Нернста была обоснована более строгим образом, независимо от принципа максимальной работы. Кроме того, было также показано, что жидкости не следует причислять к конденсированным телам, к которым теорема Нернста точно применима.
|
|||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 291; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.187.178 (0.008 с.) |
 ,
,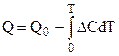 ,
,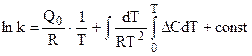 .
. G =
G =  , (5.1)
, (5.1)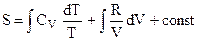 , (5.2)
, (5.2) .
. :
:
 . (5.3)
. (5.3)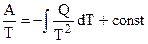
 . (5.4)
. (5.4) Уравнение (5.4) неоднозначно, т. к. в него входит const, значение которой ничем не ограничено. Поэтому в координатном поле “энергия - температура”, вместо одной кривой А = f (T), получается семейство кривых, отличающихся значением const. В то же время зависимость Q= f (T) однозначна и представлена единственной кривой (рис. 5.1).
Уравнение (5.4) неоднозначно, т. к. в него входит const, значение которой ничем не ограничено. Поэтому в координатном поле “энергия - температура”, вместо одной кривой А = f (T), получается семейство кривых, отличающихся значением const. В то же время зависимость Q= f (T) однозначна и представлена единственной кривой (рис. 5.1). 0 и значений функций:
0 и значений функций: и А0 = Q0. (5.5)
и А0 = Q0. (5.5) . (5.6)
. (5.6) . Для ее раскрытия необходимо найти отношение пределов производных от числителя и знаменателя:
. Для ее раскрытия необходимо найти отношение пределов производных от числителя и знаменателя: .
. (5.7)
(5.7) (5.8)
(5.8)


