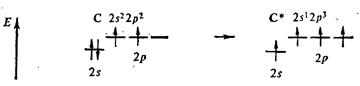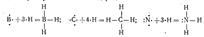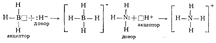Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вопрос № 3. Валентность. Различные трактовки понятия валентность в современной химии. Валентные возможности атомов с позиции МВС. Постоянная и переменная валентность.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Под валентностью подразумевается свойство атома данного элемента присоединять или замещать опре- деленное число атомов другого элемента. Мерой валентности поэтому может быть число химических связей, образуемых данным атомом с другими атомами. Таким образом, в настоящее время под валентностью химического элемента обычно понимается его способность (в более узком смысле — мера его способности) к образованию химических связей. В представлении метода валентных связей численное значение валентности соответствует числу ковалентных связей, которые образует атом. Образование молекулы водорода из атомов можно представить следующим образом (точка означает электрон, черта — пару элект-ронов): Н∙ + ∙Н =Н: Н или Н∙ + ∙Н = Н – Н Поскольку пребывание двух электронов в поле действия двух ядер энергетически выгоднее, чем нахождение каждого электрона в поле своего ядра, в образовании ковалентных связей могут принимать участие все одноэлектронные облака. Например, атомы кислорода и азота могут соединяться с двумя и тремя (соответственно) одновалентными атомами водорода: В ряде случаев число непарных электронов увеличивается в результате возбуждения атома, вызывающего распад двухэлектронных облаков на одноэлектронные. Например, атом углерода в основном состоянии имеет два непарных электрона (2s22p2), а при возбуждении одного из 2s-электронов в 2p-состояние возникают четыре непарных электрона: Вследствие этого атом углерода может соединяться, например, с четырьмя атомами фтора (2s22p5), имеющими по одному непарному электрону: Возбуждение атомов до нового валентного состояния требует затраты определенной энергии, которая компенсируется энергией, выделяемой при образовании связей. Валентные возможности элементов. Имея в виду оба описанные выше механизма образования ковалентной связи, рассмотрим валентные возможности атомов бора, углерода и азота. Это элементы 2-го периода, и, следовательно, их валентные электроны распределяются по четырем орбиталям внешнего слоя: одной 2s- и трем 2р-. Поскольку у бора и углерода имеются энергетически близкие свободные 2p-орбитали, при возбуждении эти элементы могут приобрести новые электронные конфигурации. В соответствии с числом непарных электронов атомыВ, С и Nмогут образовать соответственно три, четыре и три ковалентные связи, например с атомами водорода:
Атом бора имеет свободную орбиталь, поэтому в молекуле ВН3 дефицит электронов. В молекуле же Н3N при атоме азота имеется неподеленная (несвязывающая) электронная пара. Таким образом,молекула ВН3 может выступать как акцептор, а молекула Н3N, наоборот,— как донор электронной пары. Иными словами, центральные атомы той и другой молекулы способны к образованию четвертой ковалентной связи по донорно-акцепторному механизму. Простейший донор электронной пары—гидрид-ион Н-. Присоединение отрицательного гидрид-иона к молекуле ВН3 приводит к образованию сложного (комплексного) иона ВН4- с отрицательным зарядом: Простейший акцептор электронной пары — протон Н-; его присоединение к молекуле Н3N тоже приводит к образованию комплексного иона NH4+, но уже с положительным зарядом: Из сопоставления структурных формул молекулы СН4 и комплексных ионов ВН4- и H3N4+ видно, что атомы бора, углерода и азота в этих соединениях четырехвалентны. Следует отметить, что в ионах ВН4- и H3N4+ все четыре связи равноценны и неразличимы, следовательно, в ионах заряд делокализован (рассредоточен) по всему комплексу. Рассмотренные примеры показывают, что способность атома образовывать ковалентные связи обусловливается не только одноэлектронными, но и двухэлектронными облаками или соответственно наличием свободных орбиталей.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 449; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.201.92 (0.008 с.) |

 Многие элементы в своих соединениях проявляют постоянную валентность. Но есть элементы, обладающие переменной валентностью (таблица). Водород, натрий и калий во всех соединениях одновалентны, кислород, кальций и магний проявляют постоянную валентность равную двум (П). Медь, железо и некоторые другие элементы могут менять свою валентность. Их называют элементами с переменной валентностью. Она зависит от природы и условий взаимодействия элементов в соединении. Например, при сгорании угля на воздухе образуется диоксид углерода (СО2), а при недостаточном поступлении воздуха - монооксид углерода (СО). В первом соединении углерод четырехвалентен, а во втором - двухвалентен.
Многие элементы в своих соединениях проявляют постоянную валентность. Но есть элементы, обладающие переменной валентностью (таблица). Водород, натрий и калий во всех соединениях одновалентны, кислород, кальций и магний проявляют постоянную валентность равную двум (П). Медь, железо и некоторые другие элементы могут менять свою валентность. Их называют элементами с переменной валентностью. Она зависит от природы и условий взаимодействия элементов в соединении. Например, при сгорании угля на воздухе образуется диоксид углерода (СО2), а при недостаточном поступлении воздуха - монооксид углерода (СО). В первом соединении углерод четырехвалентен, а во втором - двухвалентен.