Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Патогенез стрессорных повреждений сердца и предупреждение их при помощи адаптацииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Природу стрессорных повреждений и принципиальную возможность их предупреждения целесообразно рассмотреть на двух конкретных и достаточно важных примерах — стрессорного по-
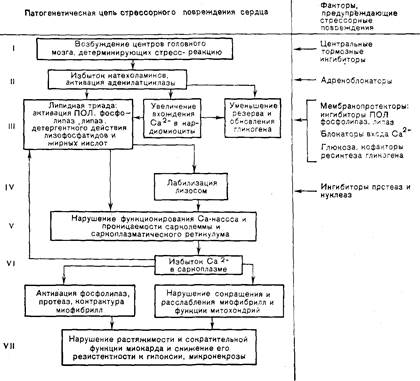
вреждения сердца и стрессорных нарушений противоопухолевого иммунитета. Стрессорное повреждение сердца при длительном эмоционально-болевом стрессе явилось в последнее десятилетие предметом комплексных физиологических, биохимических и цитологических исследований, которые освещены в специальных обзорах и монографиях [Меерсон Ф. 3., 1983 а; 1984]. На схеме 2 обобщены эти данные о патогенезе стрессорного повреждения сердца, они показывают, что при стрессорных ситуациях возбуждение высших вегетативных центров, детерминирующих стрессорную реакцию, составляет I звено процесса и приводит к многократному увеличению действующей на сердце концентрации катехоламинов и активации аденилатциклазы (II звено). Это влечет за собой три наиболее существенных изменения, составляющих, на наш взгляд, ключевое, III звено процесса, а именно увеличение вхождения в кардиомиоциты Са2+, мобилизацию и уменьшение резерва гликогена и, наконец, реализацию липидной триады. Последняя, как показано на схеме 2, слагается из активации ПОЛ, активации фосфолипаз, липаз и детергентного действия жирных кислот. Именно липидная триада составляет наиболее вероятную осно- ву повреждения лизосомальных мембран, в результате которого из лизосом освобождаются протеолитические ферменты (IV звено). В результате эффекта липидной триады, действия лизосомальных ферментов и нарушений в системе гликолиза развиваются повреждения мембран сарколеммы, саркоплазматического ретикулума, ответственных за перенос Са2+, нарушается функционально-болевого воздействия, т. е. по времени они также совсарколеммы для Са2+ и возникает избыток этого катиона в саркоплазме (V звено). Одновременно под влиянием свободнорадикальных продуктов ПОЛ возникают разрывы в молекулах ядерной ДНК, которые в большинстве ядер устраняются посредством репарации, а в немногих приводят к разрушению ДНК и гибели клеток. В дальнейшем в результате нарушения работы кальциевого насоса нарастает избыток Са2+ в саркоплазме кардиомиоцитов. Это важное изменение имеет два следствия. Во-первых, он может активировать совокупность процессов, составляющих липидную триаду, и таким образом замыкает порочный круг, углубляющий повреждение миокарда. Во-вторых, избыток Са2+ обладает самостоятельным повреждающим действием — вызывает внутри клеток развитие комплекса изменений (кальциевая триада), слагающегося из контрактуры миофибрилл, нарушения функции митохондрий, перегруженных кальцием, и активации миофибриллярных протеаз и митохондриальных фосфолипаз; это усугубляет повреждение (VI звено). В результате возникают необратимая контрактура и некробиоз отдельных групп кардиомиоцитов и выраженные, но вполне обратимые нарушения сокращения и расслабления сердца в целом (VII звено). При оценке этой схемы следует учитывать по меньшей мере три обстоятельства. Во-первых, доказанные экспериментально и представленные в схеме нарушения метаболизма, структуры и функции были обнаружены после того, как стрессорная ситуация миновала; они представляют собой не просто реакцию на стрессор, а относительно стойкие последствия повреждения, возникшего во время стресса. Этот факт в совокупности с обширными клиническими данными о роли эмоционального стресса в этиологии заболеваний системы кровообращения дает основания полагать, что именно такие относительно стойкие нарушения метаболизма и функции, сохраняющиеся после того, как сам процесс миновал, и накапливающиеся от одного стрессорного эпизода к другому, могут играть роль в постепенном развитии тяжелых форм так называемого первичного некоронарогенного кардиосклероза и хронической сердечной недостаточности, которые нередко возникают у людей, не страдавших ранее заболеваниями системы кровообращения. Во-вторых, данные многих исследований свидетельствуют, что представленная патогенетическая цепь реализуется не только в кардиомиоцитах, но также в миоцитах артерий и артериол и составляет вероятную основу стойкого спазма этих сосудов. Такой контрактурный по своему существу спазм играет, как теперь показано, определенную роль в типичных для клиники стрессорных нарушениях коронарного, мозгового, периферического кровообращения и в развитии стрессорных повреждений, а именно язвенных повреждений слизистой желудка. Эти язвы теперь однозначно оцениваются как результат переваривания ишемических некрозов слизистой, вызванных стойким спазмом артериол. Третье следствие связано с обнаруженным в экспериментах фактом, что основные звенья рассматриваемой патогенетической цепи реализуются не только в системе кровообращения, но также и в других органах. Это прежде всего относится к такому ключевому звену стрессорного повреждения, как активация ПОЛ, чрезмерное усиление которого играет важную роль в повреждениях клеточных мембран. В экспериментах Е. Д. Богдановой и соавт. (1981) выяснилось, что такого рода активация ПОЛ закономерно возникает при эмоционально-болевом стрессе в головном мозге и сопровождается появлением в крови антител против мозговой ткани; исследованиями А. А. Шведовой и соавт. (1982) установлено, что активация ПОЛ играет решающую роль в механизме глубоких нарушений функции и метаболизма сетчатки, которые наблюдаются при использовании, модели эмоционально-болевого стресса. Наконец, показано, что активация ПОЛ, определяемая путем измерения содержания его продуктов в выдыхаемом воздухе, возникает не только у животных при нашей модели стресса, но закономерно развивается при стрессорной ситуации у людей [Прилипко Л. Л. и др., 1982]. Таким образом, рассматриваемое представление не частная принадлежность сердца и сосудов, не принадлежность частной экспериментальной модели, а имеет общее значение для патогенеза стрессорных повреждений организма. В связи с этим существенное значение приобретают перечисленные в правой части схемы 2 факторы, при помощи которых в экспериментах нашей лаборатории [Меерсон Ф. 3., 1984] было осуществлено избирательное ингибирование раздельно каждого из звеньев патогенетической цепи стрессорного повреждения сердца. Можно видеть, что ингибирование возбуждения центров головного мозга, детерминирующих стресс-реакцию, например, с помощью γ-оксимасляной кислоты (ГОМК) или β-эндорфина, блокада индералом адренорецепторов сердца, через которые реализуется эффект катехоламинов, блокада липидной триады ингибиторами перекисного окисления липидов, фосфолипаз и липаз, ингибирование лизосомных ферментов и блокада вхождения Са2+ в клетки — эти пять групп факторов могут предупредить или ограничить стрессорные повреждения. Знаменательно, что все эти факторы представлены естественными, эндогенными метаболитами стресс-лимитирующих систем и современными фармакологическими препаратами — аналогами таких метаболитов или активаторами их синтеза и блокаторами их распада. Значение этого обстоятельства мы сможем оценить в дальнейшем при рассмотрении представления о стресс-лимитирующих системах организма. Возможность предупреждения стрессорного повреждения сердечной мышцы при помощи предварительной адаптации к достаточно мягким стрессорным воздействиям впервые была доказана в наших экспериментах на изолированном предсердии предварительно адаптированных, а затем подвергнутых тяжелому стрессорному воздействию животных [Меерсон Ф. 3., Каткова Л. С. и др., 1983]. При изучении сократительной функции изолированного предсердия, как и в прежних экспериментах, было показано, что длительный иммобилизационный стресс вызывает значительное снижение растяжимости миокарда — его постстрессорную ригидность и одновременно приводит к депрессии развиваемой предсердием силы сокращения. Эти параметры сократительной функции оказались сниженными в 2—2,5 раза. Соответственно возникла депрессия кривой Старлинга. Выяснилось также, что адаптация к коротким стрессорным воздействиям вызывала небольшое снижение параметров сократительной функции предсердия и умеренную депрессию кривой Старлинга, т. е. имела определенную физиологическую «цену». Вместе с тем длительный стресс не приводил у адаптированных животных к снижению растяжимости, основных параметров сократительной функции и существенной депрессии кривой Старлинга. В дальнейших наших экспериментах изучался вопрос, как долго после завершения курса коротких стрессорных воздействий сохранялась отмеченная «цена» адаптации, и как долго сохранялся основной — защитный эффект адаптации. Установлено, что на 5-е сутки после завершения адаптации «цена» ее, т. е. некоторое снижение параметров сократительной функции предсердия, не проявляется, а защитный эффект сохранен в полной мере, к 10-м суткам защитный эффект уменьшается и становится недостоверным. При дальнейшем развитии исследований представлялось важным подобрать оптимальный режим адаптации к коротким стрессорным воздействиям, при котором «цена» адаптации ничем не проявляется, а ее защитный эффект является полным, и затем сравнить защитный эффект адаптации для сердца и других отделов системы кровообращения, которые более уязвимы при тяжелых стрессорных воздействиях. Одним из такиих отделов является воротная вена, у которой под влиянием длительного иммобилизационного стресса сила сокращения снижается в 3—5 раз [Меерсон Ф. 3., 1983 б]. В соответствии с этим были предприняты эксперименты, в которых сопоставлялся защитный эффект двух режимов адаптации — интенсивного и щадящего, а повреждающий эффект длительного 6-часового иммобилизационного стресса оценивали по величине депрессии сократительной функции изолированной воротной вены, которую регистрировали в условиях изометрического режима сокращения. Режим интенсивной адаптации был таким же как в предыдущих опытах, т. е. — ежедневные одноча- совые стрессорные воздействия в течение 2 нед. При выборе режима щадящей адаптации исходили из того, что в основе долговременной адаптации к самым различным факторам и, в частности, к стрессорным воздействиям лежит явление памяти, в частности памяти мозга [Меерсон Ф. 3., 1981], которая нередко может вырабатываться с большей эффективностью при отставленных друг от друга во времени повторных воздействиях, чем при более частых [Deutsch J., 1971]. Поэтому в процессе щадящей адаптации короткие стрессорные воздействия применялись не ежедневно, а через день и не 14, а всего 6 раз. При изучении влияния интенсивного режима адаптации установлены три положения. Первое положение заключается в том, что длительный иммобилизационный стресс вызывает снижение интенсивности сократительной функции миокарда в 2 раза, а воротной вены — в 3,5 раза. Это подтверждает данные, полученные нами при использовании другой модели стресса [Меерсон Ф. 3., Манухина Е. Б., Пинелис В. Г., 1983], и свидетельствует о меньшей по сравнению с миокардом резистентности гладкой мускулатуры воротной вены к повреждающему действию стресса. Второе положение состоит в том, что интенсивная адаптация имеет «цену», т. е. вызывает заметное снижение сократительной функции миокарда и воротной вены. При этом интересно отметить, что «цена» адаптации по развиваемому напряжению для вены составляет 44%, а для предсердия 24%, т. е. оказывается для вены почти вдвое большей. Это является еще одним свидетельством большей уязвимости воротной вены к стрессу по сравнению с миокардом. Третье положение заключается в том, что стресс не вызывает достоверных повреждений органов животных, адаптированных к коротким стрессорным воздействиям; предварительная адаптация обладает достоверным защитным эффектом. При изучении щадящего режима адаптации оказалось, что в этом случае адаптация не вызывает какого-либо снижения сократительной функции как сердца, так и воротной вены, т. е. не имеет заметной физиологической «цены». Сократительная функция изучаемых объектов животных, подвергнутых стрессу в течение 6 ч на фоне предварительной щадящей адаптации, достоверно не отличается от контроля. Защита является практически полной, длительный стресс при таком режиме адаптации даже у высокочувствительной к его повреждающему действию воротной вены вызвал лишь недостоверное снижение показателей сократительной функции. Высокий защитный эффект адаптации к стрессорным воздействиям распространяется не только на сердце и вены, он охватывает все звенья системы кровообращения. Об этом свидетельствуют исследования М. П. Горизонтовой и А. М. Чернуха (1976) по влиянию коротких стрессорных воздействий на микроциркуляцию. Поскольку активация перекисного окисления липидов является ключевым звеном патогенеза стрессорного повреждения, на следующем этапе исследований изучали интенсивность этого процесса в миокарде при стрессе и адаптационной защите. Выяснилось, что длительный 6-часовой иммобилизационный стресс привел к увеличению более чем в 3 раза содержания гидроперекисей липидов и шиффовых оснований в сердечной мышце, т. е. активации ПОЛ. Предварительная адаптация к коротким стрессорным воздействиям сама по себе не влияла на ПОЛ. Вместе с тем на фоне такой адаптации длительный иммобилизационный стресс не вызывал какой-либо активации ПОЛ. Тот факт, что предварительная адаптация к коротким стрессорным воздействиям блокирует ключевое звено цепи стрессорного повреждения — активацию ПОЛ — давал основание предполагать, что такая адаптация может предупреждать типичное для стресса повреждение мембран клеток сердечной мышцы. Традиционным критерием для оценки такого рода повреждений является количество клеточных ферментов, которые высвобождаются миокардом изолированного сердца в коронарный кровоток в стационарных условиях аэробной перфузии. Установлено, что для сердца контрольных животных выход изучавшихся ферментов в коронарный проток сравнительно невелик. Длительный иммобилизационный стресс привел к увеличению в 2—3 раза выхода аспартаттрансаминазы, малатдегидрогеназы, лактатдегидрогеназы и РНКазы в коронарный проток. Адаптация к коротким стрессорным воздействиям сама по себе не оказывала влияния на этот процесс и вместе с тем на фоне адаптации стресс вызывал значительно меньшие увеличения выхода ферментов. Таким образом, адаптация к коротким стрессорным воздействиям действительно предупреждает активацию ПОЛ и клеточные повреждения, возникающие в сердечной мышце при длительном стрессе. Этот факт явился основанием для предположения, что предварительная адаптация может в той или иной мере предупредить нарушения внутриклеточных ферментных систем и, в частности, системы обеспечения биоэнергетики, возникающие обычно под влиянием длительного стресса. В связи с этим было изучено влияние предварительной адаптации на возникающее при стрессе снижение содержания гликогена и нарушение дыхания и окислительного фосфорилирования в митохондриях [Меерсон Ф. 3., Малышев В. В. и др., 1986]. В этих экспериментах учитывали, что метаболические и структурные нарушения в органах-мишенях прогрессируют до тех пор, пока продолжается первая, наиболее выраженная, фаза стрессреакции, до снижения концентрации кортикостерона в плазме и пика эозинофилов, завершающего эозинопению. Поскольку у крыс эта фаза завершается через 40—45 ч после прекращения эмоционально-болевого стрессорного воздействия, содержание гликогена определяли через 45 ч. Для защиты сердца применяли интенсивный и щадящий режимы адаптации. На первом этапе эксперимента выяснилось, что через 45 ч после эмоционально-болевого стрессорного воздействия основные параметры дыхания и фосфорилировання выделенных из миокарда митохондрий оказываются сниженными на 40—50%, а содержание гликогена уменьшено на 35—40%. Опыты показали, что предварительная адаптация к коротким стрессорным воздействиям особенно в ее щадящем, близком к оптимальному, режиме предупреждает стрессорное нарушение функции митохондрий и намечающееся истощение резерва гликогена [Голубева Л. Ю., Меерсон Ф. 3., 1986; Меерсон Ф. 3., Малышев В. В. и др., 1986]. На основе этих данных был оценен эффект предварительной адаптации на функцию изолированных желудочков сердца [Меерсон Ф. 3., Долгих В. Т. и др., 1985]. Выяснилось, что в изолированных сердцах, взятых от животных, перенесших иммобилизационный стресс, при частотах стимуляции 120 и 300 импульсов в минуту наблюдалась депрессия развиваемого давления. При навязывании частоты 300 сокращений в минуту сердце этих животных реагировало неполным расслаблением — развивался дефект, который в контроле отсутствовал. Более высокой частоты сокращений сердца перенесших стресс животных не усваивали. Адаптация к повторным коротким стрессорным воздействиям не оказывала влияния на сократительную функцию изолированных сердец, но вместе с там у животных, которые были подвергнуты стрессорному воздействию после адаптации, отмеченные выше нарушения не развивались, т. е. адаптация к коротким неповреждающим стрессорным воздействиям предупреждала нарушения сократительной функции сердца, возникающие после длительного стресса. Оценивая изложенное, надо иметь в виду, что адаптация к стрессорным ситуациям предупреждает не только стрессорные повреждения сердца. Это состояние повышенной резистентноети к стрессорным воздействиям характеризует организм в целом и соответственно обеспечивает предупреждение самых различных стрессорных повреждений. Так, во всех рассмотренных выше сериях длительный иммобилизационный стресс вызывал развитие язвенных поражений слизистой желудка, причем средняя длина язвенных повреждений в расчете на один желудок составляла от 7 до 16 мм. Предварительная адаптация к стрессорным ситуациям достоверно уменьшала степень этих повреждений. У адаптированных животных после длительного стресса средняя длина язв составляла от 3,5 до 6 мм (р<0,005), т. е. была примерно вдвое меньше, чем у незащищенных крыс. Еще более показательным примером защитного эффекта адаптации является предупреждение стрессорного нарушения некоторых звеньев системы иммунитета. Стрессорное нарушение противоопухолевого иммунитета и его предупреждение при помощи предварительной адаптации1 Роль стресс-реакции в этиологии второй по значению группы неинфекционных болезней человека, а именно в этиологии опухолей давно уже привлекала внимание благодаря эмпирическому опыту клиники, который получил затем отражение в систематических эпидемиологических исследованиях. В полном соответствии с этим эксперименты последнего десятилетия свидетельствуют, что тяжелый и достаточно длительный стресс, активирующий рост имплантированных опухолей [Solomon G. et al., 1974; Sklar L. et al., 1981], подавляет вместе с тем важные звенья физиологической системы иммунитета. Так, показано стрессорное снижение функции наиболее важного звена противоопухолевого иммунитета, а именно Т-лимфоцитов. Это выражается в уменьшении реакции оластной трансформации на различные мутагены [Keller S. et al., 1981], в уменьшении литической активности цитотоксических Т-лимфоцитов [Monjan A. et al., 1977] по отношению к соответствующим опухолевым клеткам-мишеням, в снижении литической активности К-клеток, а также в существенной депрессии функции цитотоксических макрофагов [Kores S., 1980]. В этих многообразных исследованиях по стрессорной депрессии противоопухолевого иммунитета до недавнего времени полностью отсутствовали данные о влиянии стресса на весьма важное звено системы естественной противоопухолевой резистентноети, а именно на активность нормальных киллеров. Между тем, эта категория иммунокомпетентных клеток обладает чрезвычайно важным в биологическом плане отличием, а именно способностью лизировать широкий спектр клеток-мишеней, и в первую очередь опухолевых. Причем, этот цитолитический эффект осуществляется в условиях, когда в организме еще не успели сформироваться эффективные специфические клеточные и гуморальные механизмы, направленные на уничтожение или ограничение данной конкретной опухоли. Таким образом, защитный эффект нормальных киллеров оказывается наиболее срочной мерой противоопухолевой защиты организма, и эта популяция клеток естественной цитотоксичности занимает одно из главных мест в физиологической системе противоопухолевого иммунитета [Herberman R., 1983]. В последние годы была выполнена серия исследований, в которых изучено влияние длительного эмоционально-болевого и иммобилизационного стресса на активность нормальных киллеров и впервые продемонстрирована возможность предупреждения стрессорной депрессии такой активности с помощью предварительной адаптации к коротким стрессорным воздействиям [Меерсон Ф. 3., Сухих Г. Т., Каткова Л. С. и др., 1984]. 1Меерсон Ф 3., Сухих Г. Т. Вести. АМН СССР, 1985, № 8, с. 23—29.
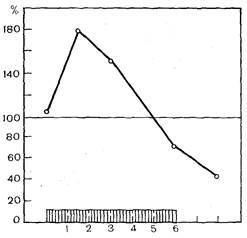
При проведении этих исследований мы должны были учитывать описанные выше основные закономерности стресс-реакции организма. Первая из этих закономерностей заключается в том, что изменения в любых органах-мишенях при стресс-реакции зависят от длительности стрессорного воздействия. На рис. 7 представлены результаты измерения активности нормальных киллеров, которые оценивали в условиях in vitro по выходу радиоактивного хрома из клеток-мишеней YAC-1, лизированных нормальными киллерами, которые находились в популяции спленоцитов. Во всех случаях клетки-эффекторы были взяты через 2 ч после стрессорного воздействия. Видно, что после короткого стрессорного воздействия длительностью 1—1,5 ч, наблюдалась отнюдь не депрессия, а увеличение активности нормальных киллеров более чем в 2 раза, т. е. стресс реализовывал свою эволюционно-детерминированную роль. По мере удлинения стрессорного воздействия до 3 ч активность нормальных киллеров оказалась повышенной, но в меньшей мере. И наконец, при значительном увеличении длительности стресса до 6 ч мы наблюдали выраженную депрессию активности нормальных киллеров по сравнению с контролем, которая, очевидно, является одним из вероятных механизмов снижения резистентности организма к бластоматозному росту. Вторая закономерность стресс-реакции состоит в том, что изменения, возникающие после стрессорного воздействия в самых различных органах-мишенях, зависят от времени, прошедшего после прекращения такого воздействия. Известно, что за ранней, хорошо известной катаболической фазой стресса после однократного стрессорного воздействия закономерно развивается более длительная анаболическая фаза, т. е. генерализованная постстрессорная активация синтеза нуклеиновых кислот и белков, которая потенцирует реализацию самых различных адаптационных реак- ций организма, в том числе и реакции иммуногенеза. При изучении динамики активности нормальных киллеров селезенки через различные сроки после завершения однократного стрессорного воздействия в течение 6 ч было показано, что в ближайшие 3 сут после этого длительного тяжелого стрессорного воздействия наблюдается выраженная депрессия активности нормальных киллеров. В дальнейшем эта активность восстанавливается до нормы, а к 7—8-м суткам превышает норму более чем в 2 раза. Далее эта постстрессорная активация систем естественных киллеров постепенно исчезает и активность их приближается к контрольному уровню. При изучении механизмов главного обнаруженного феномена — стрессорной депрессии активности нормальных киллеров — следовало учесть, что интерферон и индукторы его синтеза играют решающую роль в регуляции активности данной популяции иммунокомпетентных клеток. Поэтому представлялось вероятным, что обнаруженная депрессия активности этих клеток как-то связана с угнетением биосинтеза интерферона. Исследования показали, что после 6-часового иммобилизационного стресса наблюдается снижение содержания интерферона в сыворотке крови и активности нормальных киллеров в селезенке. При этом максимальное снижение осуществляется через сутки после стрессорного воздействия, затем происходит постепенное восстановление, причем интерферон восстанавливается раньше, чем активность нормальных киллеров. В фазе постстрессорной активации биосинтеза содержание интерферона и активность нормальных киллеров превышают контрольный уровень. Существенно, что такую же динамику при стрессе имеет не только сывороточный интерферон, но и γ-интерферон, который, по существу, является основным регулятором активности нормальных киллеров. Дальнейшая задача исследования заключалась в том, чтобы защитить систему нормальных киллеров и предупредить стрессорную депрессию ее активности. Таблица 7. Активность нормальных киллеров при длительном стрессе (М±m)
Явление стрессорной депрессии важного звена системы противоопухолевого иммунитета не является экспериментальным феноменом, оно доказано после экстремальных, по существу своему стрессорных, ситуаций у человека. Так, например, в ближайшие 2 суток — после спуска космонавтов с орбиты — доказана выраженная депрессия нормальных киллеров [Константинова И. В. и др., 1983]. Поэтому понятно, что выяснение возможности профилактики данного нарушения с помощью предварительной адаптации к коротким неповреждающим стрессорным воздействиям имеет принципиальное значение. При решении этой задачи мы опирались на упомянутую закономерность, которая состоит в том, что основные органы-мишени, повреждаемые при тяжелом стрессе, можно защитить, если предварительно адаптировать организм ж коротким стрессорным воздействиям. В табл. 7 представлена противоопухолевая активность нормальных киллеров. Видно, что длительный иммобилизационный стресс почти в 3 раза снижает активность нормальных киллеров в организме мышей. Адаптация к повторным коротким стрессорным ситуациям сама по себе не влияет на эту активность, но в значительной мере или полностью предупреждает ее депрессию, вызываемую длительным стрессом. В целом эти данные соответствуют развитому выше представлению, что реализуемая самим организмом адаптация к стрессорным ситуациям — мощный фактор самозащиты, в основе которого должны лежать конкретные системные, клеточные и молекулярные механизмы. Изложенное говорит о том, что защитное действие адаптации к коротким стрессорным воздействиям распространяется на самые различные органы и системы: сердце, желудок, воротную вену, противоопухолевую систему иммунитета. Данное действие нельзя объяснять только местными изменениями в определенных органах. Защитный эффект адаптации может реализоваться как на уровне высших нейрогуморальных регуляторных механизмов, так и на уровне органов-мишеней. ГЛАВА 4. Очевидно, что для понимания природы адаптации к стрессорным ситуациям и ее защитных эффектов необходимо рассмотреть нейрогормональные и клеточные регуляторные изменения, развивающиеся в организме при повторных етрессорных воздействиях.
|
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 739; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.018 с.) |