
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Системы естественной профилактики стрессорных поврежденийСодержание книги
Поиск на нашем сайте
Многочисленные эксперименты последних десятилетий показали, что процесс адаптации к повторяющемуся воздействию стрессоров сопровождается уменьшением реакций гипофизарноадреналовой системы при сохранении ее повышенной фоновой активности. Это не связано с истощением функциональных возможностей надпочечников. В основе подобной адаптации лежит активация нейроэндокринных механизмов, ограничивающих чрезмерное возбуждение высших адренергических центров и выход рилизинг-факторов, которые стимулируют секрецию АКТГ. Таким образом, предот- вращается увеличение содержания катехоламинов и кортикостерона в крови, действующих на органы-мишени, и уменьшается вероятность стрессорных повреждений. Выяснилось, что сами кортикостероиды через рецепторы гиппокампа частично тормозят вышеуказанные механизмы стимуляции. Однако роль «основных ограничителей» выполняют центральная и периферическая стресслимитирующие системы. Центральная система включает следующие составляющие: 1. ГАМКергическая система: γ-аминомасляная кислота (ГАМК), образующаяся из глутамата, - это тормозной медиатор в стрессреализующих системах гипоталамуса, вместе со своим метаболитом - γ-оксимасляной кислотой (ГОМК) тормозит чрезмерное возбуждение адренергической и гипофизарно-адреналовой систем (представлена почти в 60% синапсов ЦНС). Следует отметить, что метаболическая цепь, образующая ГАМК-систему, имеется не только в головном мозгу, где она выполняет тормозную функцию, но и в других органах, выполняющих при стрессе роль мишеней катехоламиновой и глюкокортикоидной атаки. 2. Опиатергическая: а) эндорфины, выделяемые гипоталамусом, таламусом, клетками аденогипофиза и АРUD1-системой; б) энкефалины (образуются нейронами коры больших полушарий, гипоталамуса, серого вещества сильвиева водопровода, задних рогов спинного мозга; мозговым слоем надпочечников). Опиаты вырабатываются даже Т-лимфоцитами. Их действие опосредуется через пять видов опиатных рецепторов. Они обусловливают аналгезию и эйфорию, уменьшают тревожность, стимулируют аппетит, формируют чувство удовольствия и радости при утолении голода, нормализуют и даже снижают артериальное давление, препятствуют стрессорной активации сердечной деятельности, угнетают секрецию желудка и моторику желудочно-кишечного тракта, тормозят синтез глюкокортикоидов и катехоламинов, но повышают выработку СТГ и пролактина. Опиаты не только стимулируют функции цитотоксических лимфоцитов и образование антител, но и препятствуют другим проявлениям стрессорного иммунодефицита. 1 APUD - аббревиатура из первых букв англ. слов: amines - амины, precursor - предшественник, uptake - усвоение, поглощение, decarboxylation - декарбоксилирование; синоним диффузная нейроэндокринная система - система клеток, способных к выработке и накоплению биогенных аминов и (или) пептидных гормонов. 3. Дофаминергическая: нейроны черной субстанции, вентральной покрышки, полосатого тела и самого гипоталамуса подавляют механизмы стресса, однако есть и косвенные данные о стимулирующей роли дофаминергических нейронов ядер шва в развитии стресса. Роль серотонинергической системы в ограничении стресс-реакций спорна. В настоящее время имеются данные об ее активирующей роли при стрессе (так как при стимуляции серотонинэргических нейронов усиливается выделение вазопрессина и кортиколиберина). Значительную роль в подавлении чрезмерных реакций стресса играет шишковидное тело. Эпифиз стимулирует продукцию эндогенных опиатов, и его недостаточность у пожилых людей снижает стресс-резистентность организма, с возрастом также уменьшается секреция эпифизарного мелатонина, являющегося активатором антиоксидантной системы организма. Мелатонин и норадреналин, вырабатываемый нейронами центра удовольствия в гипоталамусе, ингибируют запуск механизмов стресса. Кроме того, мелатонин и серотонин ответственны за циркадный ритм секреции кортиколиберина - стартового гормона стресса. Периферическая стресс-лимитирующая система включает в себя: 1. Простагландины (Е и А), которые влияют на гладкую мускулатуру, снижают артериальное давление, ограничивают диурез и тормозят ульцерогенный эффект глюкокортикоидов и катехоламинов. Особенно активны в качестве вазодилататоров простагландины А, поскольку они практически единственные циркулируют в крови. Простагландины ограничивают липолитическое действие катехоламинов и уменьшают выход в кровь свободных жирных кислот. Кроме того, простагландины Е тормозят выход норадреналина из пресинаптических терминалей и уменьшают его уровень, снижая возбуждение симпатической системы. При этом сами катехоламины стимулируют образование простагландинов, действуя через β-адренорецепторы и повышая образование цАМФ. Существует и второй путь, при котором увеличенная концентрация катехоламинов активирует калликреин-кининовую систему и образующийся брадикинин через фосфолипазу А1 высвобождает арахидоновую кислоту, из которой синтезируются простагландины. Таким образом, адренергическая стимуляция тканей приводит к активации синтеза простагландинов, которые по механизму обратной связи ограничивают действие катехоламинов. Этот механизм важен для предупреждения стрессорных повреждений внутренних органов. 2. Антиоксиданты - это клеточные системы защиты от повреждения свободными радикалами: аскорбиновая кислота; супероксиддисмутаза; каталаза; глутатионпероксидазы и др. Их защитный эффект связан не только с предотвращением активации перекисного окисления липидов (ПОЛ) в органах-мишенях, где реализуется эффект высоких концентраций катехоламинов. Ограничение ПОЛ во время стрессорного воздействия уменьшает степень мобилизации нервных центров и эндокринных желез стресс-реализующей системы. Следует отметить, что ферментные антиоксидантные системы клетки являются индуцибельными, и при повторных активациях ПОЛ их мощность нарастает, что повышает резистентность организма. Если продукция свободных радикалов значительно превышает возможности антиоксидантной защиты клеток, развивается окислительный стресс. При этом возникают существенные сдвиги окислительно-восстановительного (редокс) гомеостаза клеток и организма в целом. Оксидативный стресс и срыв редоксгомеостаза играют важную роль в развитии многих заболеваний: нейродегенеративных, злокачественных новообразований, сахарного диабета 1 типа, атеросклероза, ревматоидного артрита, ВИЧинфекции и др. 3. Стрессорные белки, или белки теплового шока (heat shock protein - HSP, с молекулярной массой от 110 до 8 кДа), участвуют в организации изменений теплорегуляции и адаптивном ответе клетки на воздействие различных стрессоров. Экспрессия данных белков специфична не только для тепловой травмы. Она может быть индуцирована воспалением, инфекцией, гипоксией, тяжелыми металлами и другими повреждающими агентами. Показано, что активность генов, кодирующих синтез Hsp, повышается под влиянием радикалов кислорода, некоторых цитокинов и др. В настоящее время известны 6 семейств HSP, участвующих в разнообразных механизмах защиты клеток от повреждений. Наиболее высокомолекулярные Hsp взаимодействуют с рецепторами стероидных гормонов, предохраняя клетки от избыточной стимуляции при стрессе. HSP-шапероны (от англ. shape - форма), центральным компонентом которых является HSP-70 (молекулярная масса 70кДа), поддерживают нативную конформацию белков, предохраняют область ядра от мутаций, стабилизируют цитоскелет, повышая устойчивость клетки к механическому повреждению, препят- ствуют агрегации и денатурации белков в условиях стресса. После кратковременного стресса белки теплового шока из группы 15-30 кДа повышают резистентность клеток к гипоксии и аутолизу и таким образом предохраняют ее от некроза. Низкомолекулярные HSP (убиквитины - вездесущие) являются рецепторами для специфических протеаз и способствуют удалению поврежденных белковых молекул, прикрепляясь к ним. HSP стабилизируют уровень восстановленного глутатиона и подавляют окислительное повреждение белков, липидов и нуклеиновых кислот; модулируют включение апоптоза (HSP-70 подавляет сигнальные пути активации апоптоза, убиквитины, напротив, индуцируют программу клеточной смерти); изменяют интенсивность процессов пролиферации и дифференцировки клеток и др. Несмотря на то что стресс лежит в основе множества заболеваний, по мнению Г. Селье, нет смысла его избегать, так как «стресс - это аромат и вкус жизни и избежать его может лишь тот, кто ничего не делает... Мы не должны, да и не в состоянии избегать стресса. Полная свобода от стресса означала бы смерть». Без некоторого уровня стресса никакая активная деятельность невозможна. Стресс может быть не только вреден, но и полезен организму (эустресс), он мобилизует его возможности, повышает устойчивость к отрицательным воздействиям (инфекциям, кровопотере и др.), может приводить к облегчению течения и даже полному исчезновению многих заболеваний (язва, аллергия, бронхиальная астма, ишемическая болезнь сердца и др.). Стрессу, а точнее, его негативным последствиям, особенно подвержены одинокие люди или те, кто испытывал недостаток родительской любви в детстве. Поэтому Г. Селье рекомендовал «зарабатывать» любовь близких и стараться создавать вокруг себя дружественное окружение. Исследования показывают, что чувства социальной привязанности, любви значительно повышают устойчивость людей к стрессовым факторам. Следует учитывать гендерные и возрастные особенности выраженности стресс-синдрома. Например, у детей стресс-реактивность организма ослаблена, что учитывается в педиатрической практике. При старении организма отмечается снижение адаптивных резервов эндокринной системы, гиперинсулинемия, снижение толерантности к углеводам, повышение интенсивности перекисного окисления липидов и другие изменения, характерные для хронического стресса, что дало основание академику В. Фролькису обозначить данное состояние как «стресс-возраст-синдром». В старческом возрасте снижается количество глюкокортикоидных рецепторов во многих тканях-мишенях, что отражается на эффективности стрессорной реакции у пожилого человека. Женщины реагируют на стресс сильнее (по количеству стрессорных гормонов в крови) и быстрее, чем мужчины, но их организм более приспособлен к стрессорным ситуациям, что частично объясняется влиянием эстрогенов и большей тренированностью. Так сложилось в природе, что особи женского пола чаще подвержены стрессу ввиду их заботы о потомстве (защита, добыча пищи). Физиологическая беременность сопровождается высоким уровнем кортикостероидов в крови матери, но плод защищен от них плацентарными ферментами, которые частично инактивируют эти гормоны. Однако индуцированный хронический гестационный стресс (иммобилизация, гипоксия, физическое напряжение, голодание и др.) с самого начала беременности способен задержать нормальное развитие плода. В результате создаются предпосылки для метаболических нарушений, сердечно-сосудистой и другой патологии во взрослой жизни, что подтверждено экспериментальными и эпидемиологическими исследованиями. По некоторым экспериментальным данным, уже со второго триместра беременности плод сам способен реагировать на стрессирование материнского организма, что приводит к так называемому синдрому пренатального стресса. У взрослых потомков стрессированных матерей он проявляется нарушениями стресс-реактивности нейроэндокринной системы, репродуктивных функций, обмена веществ и поведения. В частности, у самцов снижается половая активность и формируется гомосексуальное поведение. Ряд клинических наблюдений подтверждает эти выводы, поэтому чрезвычайно важно соблюдать охранительный режим беременной женщины. Критериями уровня стресса в клинической практике и при проведении экспериментальных исследований являются такие показатели, как содержание в крови и моче глюкокортикоидных гормонов, катехоламинов и их метаболитов, интенсивность хемилюминесценции крови, содержание в ней продуктов перекисного окисления липидов и др. РЕАКЦИИ ОСТРОЙ ФАЗЫ К настоящему времени сформировалось представление о группе механизмов, обозначенных как реакции острой фазы (cм. также главу 10 и раздел 14.4.6). Само название свидетельствует о том, что они развиваются при повреждении в острый период и особенно в тех случаях, когда повреждение приводит к активации иммунитета, системы крови и развитию воспаления. Во всех этих случаях усиливается освобождение группы цитокинов, образующихся при развитии местной воспалительной реакции. Провоспалительные цитокины (интерлейкины (IL) 1, IL-6, IL-8, фактор некроза опухолей (TNF) α и др.) образуются многими клетками, среди которых наибольшую роль играют макрофаги. Эти цитокины, действуя на клетки-мишени разных органов, изменяют их функцию (рис. 4-3). В случае если местная воспалительная реакция оказывается недостаточной, подключаются общие реакции организма. Таким образом, реакция острой фазы представляет собой активацию группы неспецифических защитных механизмов (рис. 4-4). Белки острой фазы Важнейший аспект острой фазы - радикальное изменение биосинтеза белков в печени. Понятие «белки острой фазы» объединяет до 30 белков плазмы крови, так или иначе участвующих в воспа-
лительном ответе на повреждение. Концентрация белков острой фазы существенно зависит от стадии, течения заболевания и массивности повреждения, что определяет ценность этих тестов для диагностики. Регуляция и контроль синтеза белков острой фазы. Развитие острой фазы инициируется и регулируется рядом медиаторов: цитокинами, анафилоксинами, факторами роста и глюкокортикоидами. Некоторые из них выделяются непосредственно в очаге воспаления активированными макрофагами, нейтрофилами, лимфоцитами, фибробластами и другими клетками и могут оказывать как местное, так и общее воздействие. Регуляция синтеза белков острой фазы - сложный многофакторный механизм, отдельный для каждого белка. Каждый из цитокинов выполняет уникальную независимую функцию. Они обеспечивают своего рода коммуникационную сеть. В общих чертах можно представить, что цитокины действуют как первичные стимуляторы генной экспрессии, глюкокортикоиды и факторы роста являются модуляторами действия цитокинов. Как правило, концентрация белков острой фазы меняется в течение первых 24-48 ч. Классически острая фаза длится несколько дней, что указывает на защитную, гомеостатическую природу этого важного ответа. Однако цикл может быть пролонгирован при продолжении действия повреждающих факторов или при нарушении механизмов контроля и регуляции. При нарушении механизмов регуляции острой фазы повреждение тканей может продолжаться и привести к развитию последующих осложнений, например, сердечно-сосудистых заболеваний, болезней накопления, аутоиммунных заболеваний, коллагенозов и др. Характеристика и классификация белков острой фазы. Особенностью большинства белков острой фазы являются их неспецифичность и высокая корреляция концентрации в крови с активностью и стадией патологического процесса. Это выгодно отличает белки острой фазы от таких показателей, как СОЭ, количество лейкоцитов и сдвиг лейкоцитарной формулы. В связи с этим наиболее эффективно использовать тесты на белки острой фазы для мониторинга течения заболеваний и контроля лечения. В то же время диагностическая значимость этих тестов в силу их неспецифичности может быть весьма ограниченной. Концентрация разных белков в условиях повреждения и воспаления варьирует в широких пределах (рис. 4-5). К «главным» белкам острой фазы у человека относят С-реактивный белок и амилоидный А-белок сыворотки крови. Как и все белки острой фазы, они синтезируются в печени под влиянием интерлейкинов. Уровень этих белков при повреждении возрастает быстро (в первые 6-8 ч) и значительно (в 20-100 раз, в отдельных случаях - в 1000 раз). Вторую группу составляют белки, концентрация которых при патологии может увеличиваться в 2-5 раз. Тесты на а1-антитрипсин, a-кислый гликопротеин (орозомукоид), гаптоглобин, фибриноген имеют очевидную информативность при многих заболеваниях.
Индивидуальной оценки требует интерпретация результатов измерения концентрации церулоплазмина, C3- и С4-компонента комплемента, уровень которых увеличивается на 20-60% от исходного и в ряде случаев не превышает диапазона вариаций нормальных концентраций этих белков в плазме крови здорового человека. К так называемым нейтральным реактантам острой фазы относятся белки, концентрация которых может оставаться в пределах нормальных значений, однако они принимают участие в реакциях острой фазы воспаления. Это а2-макроглобулин, гемопексин, амилоидный Р-белок сыворотки крови, иммуноглобулины. Содержание «негативных» реактантов острой фазы может снижаться на 30-60%. Наиболее диагностически значимыми из этой группы белков являются альбумин, трансферрин, апоА1- липопротеин, преальбумин. Уменьшение концентрации отдельных белков в острой фазе воспаления может быть обусловлено снижением синтеза, увеличением потребления, изменением их распределения в организме. С-реактивный белок является наиболее чувствительным маркером повреждения при остром воспалении, сепсисе. Именно поэтому измерение уровня С-реактивного белка широко применяется для определения тяжести и контроля эффективности терапии бактериальных и вирусных инфекций, ревматических болезней, онкологических заболеваний. Определение содержания С-реактивного белка используется также для оценки риска возникновения и прогрессирования сердечно-сосудистых заболеваний (табл. 4-1), патологии беременности, послеоперационных и трансплантационных осложнений. Таблица 4-1. Риск развития сосудистых осложнений в зависимости от концентрации С-реактивного белка (СРБ) в сыворотке крови
Для определения и наблюдения за течением хронических процессов желательно следить за изменением концентрации сразу нескольких более медленно реагирующих белков - а1-кислого гликопротеина, а1-антитрипсина. Использование только одного из маркеров воспаления рискованно, так как у разных больных возможен дисгармоничный острофазный ответ. В частности, в начальной стадии острого воспаления характерно снижение содержания белков, обладающих антипротеазной активностью (а1-антитрипсин, а2-макроглобулин), что связано с высоким их потреблением. В последующем отмечается повышение их концентрации, связанное с увеличением синтеза этих белков. Снижение уровня ингибиторов протеиназ при септическом шоке или остром панкреатите является плохим прогностическим признаком. Повышенное потребление гаптоглобина, С3-компонента комплемента, фибриногена может указывать на наличие сопутствующего патологического процесса, помимо воспаления. Одновременное определение нескольких белков позволяет оценить стадию острой фазы, а также реакцию, связанную с эффектами гормонов, в частности кортикостероидов и эстрогенов (табл. 4-2). Таблица 4-2. Оценка стадии реакции острой фазы
1. В печени происходит усиление синтеза белков острой фазы и их выделение в кровь. К ним относятся: С-реактивный белок, гаптоглобин, компоненты комплемента, церулоплазмин, фибриноген и др. С-реактивный белок специфически связывается с широким кругом веществ, образующихся при повреждении клеток тканей и микробов. В таком виде он может активировать комплемент, усиливать фагоцитоз, а иногда и воспаление. Гаптоглобин - гликопротеин, взаимодействует с гемоглобином (например, при гемолизе) с образованием комплекса, обладающего пероксидазной активностью. Комплекс фагоцитируется и разрушается в клетках мононуклеарной фагоцитарной системы с высвобождением моле- кул железа, которые с помощью трансферрина крови переносятся в костньгй мозг. Церулоплазмин блокирует свободнорадикальное окисление. 2. В костном мозгу стимулируется развитие нейтрофилов, что приводит к нейтрофилии. Усиливается их хемотаксис и активируется образование этими клетками лактоферрина. Последний связывает в крови железо, снижая его концентрацию. Это имеет защитное значение, так как железо является ростовым фактором для ряда микроорганизмов и даже для некоторых опухолевых клеток. 3. Активируются центры теплорегуляции в гипоталамусе. Здесь IL-1 действует как эндогенный пироген (см. гл. 11). 4. Стимулируется катаболизм белков в мышцах. Образующиеся аминокислоты поступают в печень, где они используются для синтеза белков острой фазы и для глюконеогенеза. 5. Активируются Т- и В-лимфоциты. Все перечисленные эффекты, как и некоторые другие, вызываются IL-1, поэтому образование IL-1 является ведущим патогенетическим звеном, включающим группу приспособительных реакций. ШОК Шок (от англ. shock - удар) - остро развивающийся синдром, характеризующийся резким уменьшением капиллярного (обменного, нутритивного) кровотока в различных органах, недостаточным снабжением кислородом, неадекватным удалением из ткани продуктов обмена и проявляющийся тяжелыми нарушениями функций организма. Шок необходимо отличать от коллапса (от лат. collator - падать, спадать), так как иногда одно и то же состояние обозначают то как шок, то как коллапс, например кардиогенный коллапс и кардиогенный шок. Это связано с тем, что в обоих случаях происходит падение артериального давления. Коллапс представляет собой острую сосудистую недостаточность, характеризующуюся резким снижением артериального и венозного давления, уменьшением массы циркулирующей крови. Кроме того, при коллапсе и шоке сознание затемняется с последующим его выключением на поздних стадиях. Однако между этими двумя состояниями имеются и принципиальные различия: 1. При коллапсе процесс развивается с первичной недостаточностью вазоконстрикторной реакции. При шоке в связи с активацией симпатоадреналовой системы вазоконстрикция, напротив, резко выражена. Она же и является начальным звеном развития нарушений микроциркуляции и обмена веществ в тканях, получивших название шок-специфических (рис. 4-6), которых нет при коллапсе. Например, при острой кровопотере развивается геморрагический коллапс, который может трансформироваться в шок. 2. При шоке, особенно травматическом, наблюдаются две стадии развития: возбуждения и угнетения. При этом в стадии возбуждения артериальное давление повышается. При коллапсе стадия возбуждения отсутствует. По этиологии различают следующие виды шока: 1) геморрагический; 2) травматический; 3) дегидратационный; 4) ожоговый; 5) кардиогенный; 6) септический; 7) анафилактический.
Естественно, что патогенез каждого вида шока имеет свои особенности развития, свои ведущие звенья. В зависимости от характера действующей причины и особенностей развивающегося повреждения основными ведущими патогенетическими звеньями становятся: гиповолемия (абсолютная или относительная), болевое раздражение, инфекционный процесс на стадии сепсиса. Их соотношение и выраженность при каждом виде шока различны. Вместе с тем в механизмах развития всех видов шока можно выделить и общее звено. Им становится последовательное включение компенсаторно-приспособительных механизмов двух типов: 1. Вазоконстрикторный тип характеризуется активацией симпатоадреналовой и гипофизарно-надпочечниковой систем. Гиповолемия абсолютная (потеря крови) или относительная (снижение минутного объема крови и венозного возврата к сердцу) приводит к снижению артериального давления крови и раздражению барорецепторов (рис. 4-7), что через центральную нервную систему активирует указанный приспособительный механизм. Болевое раздражение, как и сепсис, стимулирует его включение. Результатом
активации симпатоадреналовой и гипофизарно-надпочечниковой систем является выброс катехоламинов и кортикостероидов. Катехоламины вызывают сокращение сосудов, имеющих выраженную α-адренорецепцию: главным образом кожи, почек, органов брюшной полости. Нутритивный кровоток в этих органах резко ограничивается. В коронарных и мозговых сосудах преобладают β-адренорецепторы, поэтому эти сосуды не сокращаются. Происходит так называемая централизация кровообращения, т.е. сохранение кровотока в жизненно важных органах - сердце и мозгу, поддерживается давление в крупных артериальных сосудах. Именно в этом заключается биологическое значение включения первого типа компенсаторно-приспособительных механизмов. Однако резкое ограничение перфузии кожи, почек, органов брюшной полости вызывает их ишемию. Возникает гипоксия. 2. Вазодилататорный тип включает механизмы, развивающиеся в ответ на гипоксию и направленные на ликвидацию ишемии. В ишемизированных и поврежденных тканях происходят распад тучных клеток, активация протеолитических систем, выход из клеток ионов калия и др. Образуются вазоактивные амины, полипептиды и другие биологически активные вещества, вызывающие расширение сосудов, повышение их проницаемости и нарушение реологических свойств крови. Результатом избыточного образования вазоактивных веществ является неадекватность вазодилататорного типа компенсаторноприспособительных механизмов. Это приводит к нарушению микроциркуляции в тканях за счет снижения капиллярного и усиления шунтового кровотока, изменения реакции прекапиллярных сфинктеров на катехоламины и увеличения проницаемости капиллярных сосудов. Меняются реологические свойства крови, возникают «порочные круги». Это и есть шок-специфические изменения микроциркуляции и обменных процессов (см. рис. 4-6). Результатом этих нарушений являются выход жидкости из сосудов в ткани и уменьшение венозного возврата. На уровне сердечно-сосудистой системы формируется «порочный круг», ведущий к уменьшению сердечного выброса и снижению артериального давления. Болевой компонент приводит к угнетению рефлекторной саморегуляции сердечно-сосудистой системы, усугубляя развивающиеся нарушения. Течение шока переходит в следующую, более тяжелую стадию. Возникают расстройства функции легких («шоковое легкое»), почек, свертывания крови. При каждом виде шока степень активации симпатоадреналовой и гипофизарно-надпочечниковой систем, а также характер, количество и соотношение различных видов образующихся биологически активных веществ различны, что отражается на быстроте и степени развития микроциркуляторных нарушений в различных органах. Развитие шока зависит также от состояния организма. Все факторы, вызывающие его ослабление (период реконвалесценции, частичное голодание, гипокинезия и др.), будут способствовать развитию шока. И напротив, благоприятные условия труда, быта, физическая нагрузка тормозят его возникновение. Каждый вид шока имеет особенности в своем развитии. Геморрагический шок. Возникает при наружных (ножевое, пулевое ранения, аррозивные кровотечения из желудка при язвенной болезни, опухолях, из легких при туберкулезе и др.) или внутренних (гемоторакс, гемоперитонеум) кровотечениях в условиях минимального травмирования тканей. Ведущими звеньями патогенеза геморрагического шока являются гиповолемия, гипоксия и (во многих случаях) болевое раздражение. Травматический шок. Возникает при тяжелых травмах органов брюшной и грудной полостей, опорно-двигательного аппарата, сопровождающихся даже минимальными кровопотерями. Увеличение кровопотери в этих случаях утяжеляет развитие шока. В его течении выделяют эректильную и торпидную стадии. В эректильной стадии отмечаются речевое и двигательное возбуждение, бледность кожных покровов, тахикардия, временное повышение кровяного давления. Эти признаки в значительной мере связаны с активацией симпатоадреналовой системы. Эректильная стадия переходит в торпидную. Клиническая картина этой стадии была описана в 1864 г. выдающимся отечественным хирургом Н.И. Пироговым: «С оторванной рукой или ногой лежит такой окоченелый на перевязочном пункте неподвижно. Он не кричит, не вопит, не жалуется, не принимает ни в чем участия и ничего не требует: тело холодное, лицо бледное, как у трупа; взгляд неподвижен и обращен вдаль; пульс, как нитка, едва заметен под пальцем и с частыми перемежками. На вопросы окоченелый или вовсе не отвечает, или только про себя чуть слышно шепотом, дыхание тоже едва приметно. Рана и кожа почти нечувствительные». Описанные признаки свидетельствуют о продолжающейся активации симпатоадреналовой системы (бледная, холодная кожа, тахикардия) и об угнетении функции центральной нервной системы (сознание затемнено, хотя полностью и не выключено, угнетение болевой чувствительности). Ведущими патогенетическими звеньями травматического шока являются болевое раздражение и развивающаяся гиповолемия. Дегидратационный шок возникает при значительной дегидратации организма в связи с потерей жидкости и электролитов при неукротимой рвоте, диарее, а также при выраженных экссудативных плевритах, илеусе, перитоните, когда происходит перераспределение жидкости с ее выходом из сосудистого русла в соответствующие полости. Таким образом, основным патогенетическим фактором дегидратационного шока является гиповолемия. Ожоговый шок. Возникает при обширньгх и глубоких ожогах, охватывающих более 15% поверхности тела, а у детей и пожилых лиц - даже при меньших площадях. При этом уже в первые 12-36 ч резко увеличивается проницаемость капилляров, особенно в зоне ожога, что ведет к значительному выходу жидкости из сосудов в ткани. Большое количество отечной жидкости, главным образом в месте повреждения, испаряется. При ожоге 30% поверхности тела у взрослого теряется с испарением влаги до 5-6 л в сутки, а объем циркулирующей крови падает на 20-30%. Ведущими патогенетическими факторами ожогового шока являются гиповолемия, болевое раздражение и повышение проницаемости сосудов. Кардиогенный шок. Возникает чаще всего как одно из тяжелых осложнений острого инфаркта миокарда. По данным ВОЗ, развивается у 4-5% больных в возрасте до 64 лет. Большую роль в развитии кардиогенного шока играет величина пораженной части миокарда. Считается, что он всегда развивается при поражении 40% массы миокарда и более. Может возникать и при меньших объемах повреждения миокарда в случаях присоединения дополнительных осложнений, например аритмиях. Возможно развитие этого вида шока и при отсутствии инфаркта в случаях механических препятствий для наполнения или опорожнения желудочков, при тампонаде сердца, внутрисердечных опухолях. Кардиогенный шок проявляется болью, вплоть до ангинозного состояния, артериальной гипотензией (хотя в отдельных случаях артериальное давление сохраняется нормальным), активацией симпатоадреналовой системы и акроцианозом. Ведущими патогенетическими звеньями в развитии кардиогенного шока являются болевое раздражение, нарушение сократительной функции и ритма сердца. Выраженность и сочетание этих звеньев в каждом случае кардиогенного шока различны, что дает основание для выделения разных форм этого осложнения. Результатом нарушения сократительной функции является уменьшение сердечного выброса и как следствие - снижение сердечного индекса. Развивается гиповолемия. Присоединение аритмии усугубляет этот процесс. Септический (эндотоксиновый) шок. Возникает как осложнение сепсиса. Отсюда название «септический». Поскольку главным повреждающим фактором являются эндотоксины микроорганизмов, этот шок называют также эндотоксиновым. При введении животным эндотоксинов в определенных дозах у них возникают изменения, аналогичные таковым при септическом шоке у человека. Наиболее частой причиной сепсиса являются грамотрицательные микроорганизмы (кишечная палочка, клебсиелла и др.), а также стрептококки, стафилококки, пневмококки и многие другие микроорганизмы. Особенность сепсиса заключается в том, что он развивается на фоне существующего инфекционного заболевания или первичного септического очага, из которого в организм поступают микроорганизмы и их токсины (холангит или пиелонефрит с обструкцией выводящих путей, перитонит и др.). В связи с этим сепсис нельзя рассматривать как отдельную нозологическую единицу. Это особое состояние (ответ) организма, которое может развиться при многих инфекционных процессах и заболеваниях. Условием его развития является недостаточность противоинфекционной защиты организма, включающей неспецифические и специфические (иммунные) механизмы. При обычном развитии инфекционного процесса на первом этапе включаются главным образом неспецифические защитные механизмы, наивысшее развитие которых проявляется в виде реакции острой фазы (см. раздел 4.2). Их включение осуществляется секрецией макрофагами и рядом других клеток группы провоспалительных цитокинов (IL-1 и IL-6, TNF-α). Эти же цитокины совместно с IL-3, IL-12, IL-15 подключают иммунные механизмы защиты. При успешном очищении организма от чужеродных антигенов усиливается образование противовоспалительных цитокинов (IL-4, IL-10, IL-11, IL-13, трансформирующий фактор роста - TGF-β, антагонисты IL-1 и TNF), снижается образование провоспалительной группы цитокинов, нормализуется функция неспецифических и иммунных механизмов. При нарушении баланса между про- и противовоспалительными цитокинами нарушается функционирование различных защитных механизмов, что ведет к развитию сепсиса. Одним из механизмов его развития является несоответствие микробной нагрузки возможностям фагоцитарной системы, а также эндотоксиновая толерантность моноцитов в связи с избыточным образованием противовоспалштельных цитокинов - TGF-β, IL-10 и простагландинов группы Е2. Чрезмерная продукция макрофагами TNF-α, IL-1 и IL-6 сп
|
||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-20; просмотров: 315; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.48.237 (0.021 с.) |

 Рис. 4-3. Общая схема реакций острой фазы
Рис. 4-3. Общая схема реакций острой фазы Рис. 4-4. Реакции острой фазы воспаления
Рис. 4-4. Реакции острой фазы воспаления Рис. 4-5. Динамика изменения концентрации белков острой фазы в плазме крови после травмы, ожога, хирургического вмешательства (в процентах от исходного уровня): 1 - С-реактивный белок, амилоидный А-белок сыворотки; 2 - а1-антитрипсин, а1-кислый гликопротеин, гаптоглобин, фибриноген; 3 - С3- и С4-компоненты комплемента, С1-ингибитор, церулоплазмин; 4 - альбумин, преальбумин, трансферрин, фибронектин, апоА-липопротеин
Рис. 4-5. Динамика изменения концентрации белков острой фазы в плазме крови после травмы, ожога, хирургического вмешательства (в процентах от исходного уровня): 1 - С-реактивный белок, амилоидный А-белок сыворотки; 2 - а1-антитрипсин, а1-кислый гликопротеин, гаптоглобин, фибриноген; 3 - С3- и С4-компоненты комплемента, С1-ингибитор, церулоплазмин; 4 - альбумин, преальбумин, трансферрин, фибронектин, апоА-липопротеин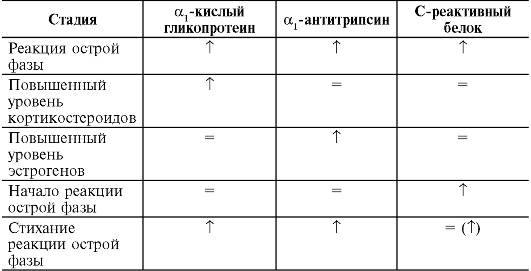 Основными при действии кортикостероидов и эстрогенов являются следующие эффекты:
Основными при действии кортикостероидов и эстрогенов являются следующие эффекты: Рис. 4-6. Шок-специфические нарушения микроциркуляции и обмена
Рис. 4-6. Шок-специфические нарушения микроциркуляции и обмена Рис. 4-7. Некоторые звенья патогенеза шока
Рис. 4-7. Некоторые звенья патогенеза шока


