
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Адаптивный иммунитет вырабатывается в процессе жизни индивида и представляет собой специфическую защитную реакцию организма на конкретный чужеродный агент (антиген) с участием лимфоцитов.Содержание книги
Поиск на нашем сайте В его основе лежит способность лимфоцитов распознавать антигены и организовывать их деструкцию, в то время как врожденный иммунитет не дифференцирует антигены и реализуется в отношении любого антигена вне зависимости от его природы. Кроме того, для формирования адаптивного иммунитета сначала необходима предварительная обработка (процессинг) «несвоего», после чего происходит его распознавание и деструкция; факторы врожденного иммунитета (фагоциты, система комплемента и др.) распознают «чужое» в исходной, необработанной форме («паттерны»). Отказ одного или нескольких компонентов иммунной системы может приводить к развитию иммунодефицитов и утрате способности к защите от «несвоего». Расстройства регуляции в функционировании данной системы обусловливают аутоиммунные и аллергические заболевания (на основе I, II, III, IV и V типов гиперчувствительности), частые, тяжелые, затяжные и рецидивирующие инфекции, рост опухолей. Важность самого существования иммунной системы иллюстрируется появлением в последние 20 лет новой болезни - СПИДа (синдрома приобретенного иммунодефицита), при которой выявляются различные варианты нарушений со стороны иммунной системы. Антигены - это генетически чужеродные вещества, вызывающие иммунный ответ. Общее число различных антигенов оценивается числом 1018. Основными свойствами антигена, определяющими его иммуногенность, т.е. способность вызывать иммунный ответ, являются макромолекулярность (молекулярная масса не менее 10 кДа) и генетическая чужеродность. Полные антигены - это макромолекулярные соединения (в основном белки и белоксодержащие соединения). Молекула полного антигена состоит из двух частей - информационной и несущей. Информационная часть (низкомолекулярные антигенные детерминанты, эпитопы) определяет специфичность антигена, несущая (макромолекулярный белок) - способствует проникновению антигена в организм. Неполные антигены (или гаптены) - это низкомолекулярные небелковые антигены (лекарственные препараты, вирусы и др.), которые имеют в своем составе только информационную часть. Изолированная информационная часть сама по себе не является иммуногенной, т.е. не способна индуцировать иммунный ответ, но обладает конкретной специфичностью - свойством вступать в реакции взаимодействия с предсуществующими (ранее образованными при предыдущих контактах) антителами и лимфоцитами. Гаптены приобретают иммуногенность лишь в соединении с белками-носителями организма. Антитело (иммуноглобулин) - это один из типов молекул иммунной системы. Антитела и антигенраспознающие рецепторы могут связывать соответствующие антигены. Паттерны связываются паттернраспознающими молекулами (toll-подобными рецепторами1 и др.). Лимфоциты являются главными клетками иммунной системы. Посуществу, иммунная система - это иерархическая совокупность лимфоидных клеток (1013). Существуют T-, B- и NK-лимфоциты. Т-клетки дифференцируются в тимусе и играют ключевую роль во всех направлениях специфического иммунного ответа. В-лимфоциты дифференцируются в костном мозгу, являются предшественниками плазмоцитов - антителопродуцентов. NK-клетки (натуральные или естественные киллеры) участвуют в неспецифической цитотоксичности по отношению к внутриклеточно расположенным патогенам. Остальные клетки (макрофаги, дендритные клетки, нейтрофилы, эозинофилы, базофилы, тучные клетки и др.) также участвуют во многих иммунных процессах, но их участие скорее опосредованное, т.е. они привлекаются лимфоцитами для реализации функций иммунной (лимфоидной) системы. Функции иммунной системы: 1. Защита от «несвоего» (инфекция, трансплантат). 2. Элиминация модифицированного «своего»: трансформированных (в том числе опухолевых), инфицированных, поврежденных, стареющих клеток. 3. Регуляция роста и развития клеток и тканей. 1 Факторы врожденного иммунитета распознают консервативные, присущие только микроорганизмам и отсутствующие у позвоночных (от мыши до человека) молекулярные структуры, обозначаемые в современной литературе термином «патогенассоциированные молекулярные структуры» (patogen associated molecular patterns - PAMP). Эти структуры распознаются специальными рецепторами - паттернраспознающими рецепторами (pattern recognition receptors - PRRs). PRRs (растворимые, внутриклеточные, мембраносвязанные) рассматриваются как носители эволюционной памяти многоклеточных организмов о «своем» и «несвоем», обеспечивающие экстренный неспецифический ответ на чужеродный агент. Разновидностью мембраносвязанных PPRs являются toll-подобные рецепторы (TLRs). TLRs экспрессированы на многих клетках: дендритных клетках, макрофагах, моноцитах, нейтрофилах, В-, Т-лимфоцитах и др. Результатом связывания TLRs с лигандами микроорганизмов (или их продуктов) является активация в TLR-несущих клетках цитоплазматических адапторных молекул (MyD88 и др.), киназ (МАРК), ядерного фактора транскрипции (NF-kB), опосредующих индукцию генов адгезивных молекул, цитокинов и, как следствие, развитие воспаления. PAMP, распознаваемые TLRs, описаны у многих грамположительных и грамотрицательных бактерий, вирусов, грибов и простейших. Главными «партнерами» иммунной системы являются центральная нервная система, эндокринная система и печень, которые наиболее важны для обеспечения регуляции гомеостаза. Функциональная организация иммунной системы может быть рассмотрена на органном, клеточном и молекулярном уровнях. Существуют два типа органов иммунной системы - центральные (или первичные) и периферические (или вторичные). К центральным органам иммунной системы относятся костный мозг и тимус. К периферическим органам иммунной системы относятся: 1. Лимфатические узлы, лимфатические протоки и селезенка. 2. Лимфоидная ткань, ассоциированная со слизистыми оболочками (Mucous-Associated Lymphoid Tissue - MALT), которая расположена на пяти уровнях. Первые два уровня - евстахиева труба (Tube-Associated Lymphoid Tissue - TALT) и носоглотка (NasalAssociated Lymphoid Tissue - NALT) - представлены различными миндалинами; следующий уровень - бронхи (Bronchus-Associated Lymphoid Tissue - BALT) и грудные железы (у женщин); четвертый уровень - верхние отделы желудочно-кишечного тракта (GutAssociated Lymphoid Tissue - GALT) - содержат лимфоидную ткань желудка и пейеровы бляшки тонкого кишечника; пятый уровень - это нижние отделы желудочно-кишечного тракта и мочеполовая система - аппендикс, солитарные фолликулы толстого кишечника и лимфоидная ткань мочеполовой системы. 3. Лимфоидная ткань, ассоциированная с кожей (Skin-Associated Lymphoid Tissue - SALT). Центральные органы являются местом лимфопоэза, т.е. образования и антигеннезависимого созревания лимфоцитов. В костном мозгу находятся ранние клетки-предшественницы Т- и В-лимфоцитов (преТ- и преВ-клетки), В-лимфобласты созревают из преВ-клеток, размножаются и дифференцируются в В-лимфоциты. Тимус - орган, в котором Т-лимфобласты размножаются и дифференцируются в Т-лимфоциты. В периферических органах происходит контакт Т- и В-лимфоцитов с антигеном и иммуногенез - антигензависимый этап созревания лимфоцитов. Этот процесс называется иммунным ответом. Его сутью является создание «армии» (клонов) специфически реагирующих лимфоцитов и специфических антител, которые осуществляют эффекторные реакции по уничтожению конкретного антигена. Существуют Т-клеточный и В-клеточный (гуморальный) пути иммунного ответа. Большой вклад в развитие иммунологии от Edward Jenner до наших дней внесли L. Pasteur, И.И. Мечников, P. Ehrlich, Н.Ф. Гамалея, F. McFarlane Burnet, N.K. Jerne, Р.В. Петров, S. Tonegawa, Р.М. Хаитов и др. Клетки иммунной системы Все клетки, относящиеся к иммунной системе и привлекаемые ею для обеспечения эффекторных реакций, в функциональном отношении условно разделяют на четыре группы. 1. Антигенпрезентирующие клетки: макрофаги, дендритные клетки типов 1 и 2, В-лимфоциты. 2. Регуляторные клетки: T-индукторы, Т-хелперы типов 1, 2 и 3, естественные регуляторные Т-клетки. 3. Эффекторные клетки: плазматические клетки (дифференцирующиеся из В-лимфоцитов), цитотоксические Т-клетки с фенотипом CD8+ (или T-киллеры); эффекторные Т-клетки воспаления с фенотипом CD4+ (или Т-лимфоциты, ответственные за гиперчувствительность замедленного типа); нейтрофилы, эозинофилы, базофилы, тучные клетки, натуральные киллеры (NK-клетки), макрофаги. 4. Клетки памяти: Т-клетки памяти с фенотипом CD8+; Т-клетки памяти с фенотипом CD4+; долгоживующие плазматические клетки; В-клетки памяти. Номенклатура CD («Cluster of Differentiation»), которая была разработана нобелевскими лауреатами (1984) G.J.F. Kohler (Швейцария) и C. Milstein (Аргентина/Великобритания), основана на моноклональной технологии. Она позволяет идентифицировать клетки в соответствии с их происхождением, стадией дифференцировки, функциональным состоянием и т.д. (см. табл. 7-1). Данная технология, без сомнения, оказалась революционной в иммунологических и смежных областях исследований. Лимфоциты как главные клетки иммунной системы имеют отличительные особенности: 1. Постоянная «патрульная» рециркуляция по кровотоку, лимфотоку, межтканевым пространствам и секретам. 2. Способность распознавать, т.е. взаимодействовать со «своим» и «чужим» по принципу «лиганд - рецептор». Taблица 7-1. Главные идентификационные CD-маркеры клеток иммунной системы
3. Клональная (или групповая) организация (McF. Burnet) и способность формировать сетевые элементы (N.K. Jerne). 4. Способность к непрерывным реаранжировкам в своем геноме в любом возрасте в связи с потребностями формирования специфического ответа на патоген. 5. Умение запоминать антигены и обеспечивать в будущем экспрессный высокоэффективный антигенспецифический ответ. Клон - это группа лимфоцитов, коммитированных к определенному антигену. До встречи с этим антигеном каждый лимфоцит клона называют наивным. По-видимому, в человеческом организме исходно существуют десятки миллионов клонов Т- и В-лимфоцитов. После контакта с соответствующим антигеном и в результате иммунного ответа коммитированный лимфоцит становится праймированным. Молекулы иммунной системы Для осуществления необходимых функций клетки иммунной системы имеют сложную молекулярную организацию своих рецепторов и способны к выработке целого ряда молекул. 1. Антигенпредставляющие, антигенраспознающие и антигенсвязывающие молекулы. Набор этих молекул уникален для каждого организма, для каждого лимфоцитарного клона и для каждого специфического иммунного ответа. К ним относятся: • свободные иммуноглобулины: IgM, IgG, IgA, IgE, IgD; • антигенпредставляющие молекулы: лейкоцитарные антигены главного комплекса гистосовместимости (human leukocyte antigens - HLA I и II) и молекулы CD1 (a, b, c, d, e); • иммуноглобулиновые рецепторы В-клеток для распознавания и связывания антигена (B cellular receptors - BCR); • рецепторы Т-клеток для распознавания и связывания антигена (T cellular receptors - TCR); 2. Адгезивные молекулы опосредуют взаимодействия между клетками и лигандами при непосредственном контакте: • суперсемейство иммуноглобулиноподобных молекул; • интегрины; • селектины; • муцины; • суперсемейство рецепторов к факторам некроза опухоли и фактору роста нервов - TNF/NGF (или молекулы, опосредующие апоптоз); • линк-семейство (компоненты экстрацеллюлярного матрикса). 3. Иммуноцитокины являются гормонами иммунной системы, действующими чаще с пара- и аутокринным, реже - с эндокринным эффектами: • интерлейкины (interleukins - ILs); • колониестимулирующие факторы (colony-stimulating factors - CSFs); • интерфероны (interferons - IFNs); • факторы некроза опухоли (tumor necrosis factors - TNFs); • трансформирующие факторы роста (transforming grows factors - TGFs); • хемокины и др. 4. Сборная группа различных медиаторов воспаления включает белки комплемента, белки острой фазы, простаноиды и лейкотриены, протеолитические ферменты и др. Иммуноглобулины (immunoglobulin - Ig) M, G, A, E и D являются эффекторными молекулами гуморального иммунного ответа. Молекула иммуноглобулина является гликопротеином; белковые цепи включают сотни aминокислотных последовательностей; углеводный компонент составляет до 12%. Молекула IgG (рис. 7-1) состоит из двух идентичных легких (light - L) и двух идентичных тяжелых (heavy - H) цепей (chains). Легкие цепи бывают двух типов: χ и λ, а тяжелые - пяти: μ, γ, α, ε и δ. Легкие и тяжелые цепи содержат повторяющиеся гомологичные последовательности и об-
разуют своеобразные домены (клубки или глобулы). Существуют константные (constant) (CL, CH1, CH2 и CH3) и вариабельные (variable) домены (VL и VH). Гипервариабельные области вариабельных доменов формируют антигенсвязывающие сайты (активные центры). Участок CL-CH1 определяет различия амонокислотных последовательностей у индивидуумов одного и того же вида. Антигенсвязыгаающие сайты и область CL-CH1 входят в состав так называемых Fab (fragment antigen-binding)-фрагментов (их 2), ответственных за связывание антигена, а участки CH2-CH2 и СН3- СН3 формируют Fc (fragment crystalline)-фрагмент, отвечающий за неспецифические эффекторные функции. Например, область CH2-CH2 участвует в фиксации и активации компонентов комплемента, а область СН3-СН3 - в фиксации антител к клеткам. Между Fab- и Fc-фрагментами тяжелых цепей имеется шарнирная область, обеспечивающая гибкость молекулы антитела. IgM являются эволюционно наиболее древними антителами и составляют 5-10% всех иммуноглобулинов. Они являются также первыми антителами новорожденных, не проникают через плаценту. вырабатываются только при первичном иммунном ответе. Они появляются в крови в начале иммунного ответа и затем замещаются IgG. служат основными рецепторами для распознавания антигенов на поверхности зрелых В-лимфоцитов. В сыворотке крови существуют в виде пентамеров (т.е. имеют 5 мономерных субъединиц). связывают комплемент и активируют его по классическому пути. На IgG в сыворотке крови человека приходится около 75% от общего числа иммуноглобулинов. Вырабатываются они как при первичном, так и при вторичном иммунном ответе вслед за IgM. IgG способны проникать в ткани, через плаценту, связывать комплемент и активировать его по альтернативному пути. Каждая молекула IgG состоит из 2 легких и 2 тяжелых цепей. У человека имеется 4 подкласса IgG, различающихся последовательностью аминокислот в тяжелой цепи. IgA составляют 7-15% общего количества сывороточных иммуноглобулинов. IgA содержатся в секретах (слюне, слезной жидкости, секретах желудочно-кишечного и мочеполового тракта, слизистой носа и грудной желез), где они находятся в виде секреторного IgA - sIgA - димера, состоящего из 2-х соединенных между собой молекул IgA и гликопротеина, называемого секреторным компонентом (СК). СК образуется в эпителиальных клетках и предохраняет молекулу IgA от расщепления. выходят из кровотока и проникают через эпителиальный слой, соединяясь с СК. Образовавшийся sIgA отщепляется от поверхности эпителиальной клетки и поступает в секреты, где реализует свою защитную функцию - предотвращает проникновение антигена с внешних поверхностей в ткани. Содержание IgE в сыворотке крови является наиболее низким - около 0,003%. Они накапливаются главным образом в слизистых оболочках и коже, где за счет своего Fс-фрагмента фиксируются на поверхности тучных клеток, базофилов и эозинофилов. При связывании антигена с IgE происходит дегрануляция этих клеток и выброс в кровь биологически активных веществ. Защитная роль IgE до сих пор не выяснена, однако установлено повышение сывороточной концентрации иммуноглобулинов данного типа при инфекциях и аллергических состояниях. IgD также содержатся в сыворотке в небольших количествах. IgD экспрессируются на поверхностной мембране В-лимфоцитов, формируя вместе с антигенраспознающий В-клеточный рецептор (BCR). Химическая природа антител была подробно изучена нобелевскими лауреатами (1972) G.M. Edelman (США) и R.R. Porter (Великобритания). Каждый В-лимфоцит экспрессирует В-клеточный антигенраспознающий рецептор (BCR), который состоит из мономерных IgM и IgD, имеет клональную гетерогенность и ассоциирован с молекулами CD79a и CD79 b, необходимыми для проведения сигнала внутрь клетки. Наряду с этими молекулами имеется также корецепторный комплекс (CD19, CD21(CR2), CD81), предназначенный для распознавания HLA II. Каждый Т-лимфоцит экспрессирует Т-клеточный антигенраспознающий рецептор ab TCR), который состоит из двух цепей - a и β, и имеет один из корецепторов - CD4 (у Т-хелперов) или CD8 (у цитотоксических Т-лимфоцитов). Эти инвариантные корецепторы CD4 и CD8 необходимы для распознавания соответственно HLA II или HLA I. Каждая цепь TCR подобно молекуле иммуноглобулина имеет вариабельный и константный домены, что обеспечивает клональную гетерогенность антигенраспознающих рецепторов. Еще одна молекула (CD3) тесно ассоциирована c TCR и служит для проведения сигнала внутрь клетки. CD3 состоит из 5 инвариантных белков (ε, γ, δ, ξ, η). Другой тип антигенраспознающего рецептора - γδTCR - экспрессируется на небольшой субпопуляции Т-клеток. Эти γδT-клетки, роль которых пока до конца не исследована, по-видимому, функционируют подобно NK-клеткам, однако они также имеют определенную клональную гетерогенность. Синтез и экспрессия на мембране лимфоцитов TCR и ВCR происходят во время лимфопоэза, т.е. при отсутствии антигена. Каждый лимфоцит экспрессирует только один вариант антигенсвязывающего рецептора, т.е. каждый лимфоцит предназначен для распознавания и связывания только одного конкретного антигена. Молекулы гистосовместимости были открыты нобелевскими лауреатами (1980) В. Benacerraf (США), J. Dausset (Франция) и G.D. Snell (США). Эти молекулы играют решающую роль во многих иммунных процессах, включая загрузку антигенных пептидов и их презентацию. Молекулы HLA разделяются на класс I (A, B, C, E, F, G) и класс II (DR, DP, DQ) в зависимости от их структуры и функции. Экспрессия HLA I имеет место почти на всех клетках (за исключением синцитиотрофобласта), выполняя функцию взаимной информации клеток внутри организма об аутологичности; экспрессия HLA II обнаруживается исключительно на клетках иммунной системы: B-лимфоцитах, макрофагах, эндотелиоцитах, активированных Т-клетках и др. Молекула HLA I (рис. 7-2) состоит из трехдоменной α-цепи и β2-микроглобулина, связь между которыми стабилизируется калнексином. Между доменами α1 и α2 имеется желобок, предназначенный для загрузки антигена. После того как антиген загружается, происходит высвобождение β2-микроглобулина, возможно, за счет конформационных изменений. Имеется около 180 генов с более чем 500 аллелями (на хромосоме 6), кодирующих синтез молекул HLA I, что обеспечивает их видоспецифический и индивидуальный полиморфизм. Молекула HLA II состоит из двух димеров - α и β. Вариабельные домены α1 и β1 формируют желобок для загрузки антигена. В целом β-цепи HLA-DR, DP, DQ характеризуются меньшей гетерогенностью; известно более 300 аллельных продуктов HLA II (более 20 генов, кодирующих HLA II, также находятся на хромосоме 6). Для контроля укладки при синтезе, протекции, транспорте и загрузке антигенных пептидов на HLA служат особые молекулы - шапероны (калнексин, кальретикулин, инвариантная цепь Ii и др).
Не-HLA молекулы CD1 (a, b, c, d, e), которые состоят по аналогии с HLA I из α-цепи и β2-микроглобулина, также вовлечены в процессы загрузки антигенов, но небелковой природы (фосфолипиды, липополисахариды). Имеется связь между наследованием некоторых генов HLA и высоким риском развития определенных болезней. Например, более 90% пациентов с анкилозирующим спондилоартритом, тяжелой аутоиммунной патологией позвоночника имеют ген HLA-B27. Поскольку HLA определяет гистосовместимость, необходимо, чтобы у донора и реципиента при трансплантации органа или ткани было соответствие по HLA. Карта пациента по HLA называется «Jull house» («полный дом») и включает данные относительно двух аллелей каждого вида молекул (например, HLA-A, HLA-B, HLA-DR и др.). Сенсибилизация белками HLA в прошлом (при гемотрансфузиях, трансплантациях или беременности) может приводить к острому отторжению пересаживаемого трансплантата или тромбоцитопении при переливании крови, поэтому необходимо обязательное тестирование на наличие антител против HLA. Типирование HLA может служить дополнительным критерием для диагностики таких болезней, как анкилозирующий спондилоартрит, диабет, целиакия, гемохроматоз, псориаз и нарколепсия, при которых известна высокая степень связи с определенными гаплотипами HLA. ИММУННЫЙ ОТВЕТ Иммунный ответ - это процесс взаимодействия клеток иммунной системы, который индуцируется антигеном и приводит к образованию эффекторных клеток и молекул, уничтожающих данный антиген. Иммунный ответ является всегда специфическим, но не изолированным процессом, который протекает только в периферических органах иммунной системы. Как правило, он сопровождается такими неспецифическими реакциями, как фагоцитоз, активация комплемента, NK-клеток и т.д. Стадии иммунного ответа В начальных стадиях иммунного ответа участвуют, по крайней мере, три вида клеток: макрофаг (или дендритная клетка), Т- и В-лимфоцит. В целом все клетки, вовлеченные в этот процесс, могут быть разделены, как указывалось выше, на антигенпредставляющие, регуляторные, эффекторные и клетки памяти. Имеются 2 магистральных пути иммунного ответа: 1. Клеточный иммунный ответ (T-клеточный).
|
||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-20; просмотров: 467; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.62 (0.011 с.) |

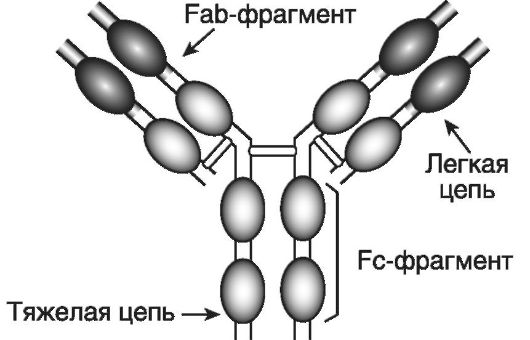 Рис. 7-1. Структура молекулы IgG. Молекула IgG состоит из двух идентичных легких и двух идентичных тяжелых цепей, которые образуют три фрагмента: два Fab (антисвязывающие сайты) и один Fc (неспецифические эффекторные функции). Цепи укладываются таким образом, что возникают «клубки» - домены, которые могут быть вариабельными или константными
Рис. 7-1. Структура молекулы IgG. Молекула IgG состоит из двух идентичных легких и двух идентичных тяжелых цепей, которые образуют три фрагмента: два Fab (антисвязывающие сайты) и один Fc (неспецифические эффекторные функции). Цепи укладываются таким образом, что возникают «клубки» - домены, которые могут быть вариабельными или константными Рис. 7-2. Структура белков гистосовместимости (HLA I и HLA II) и шапероны. Молекула HLA I состоит из α-цепи (три домена) и β2-микроглобулина ф2-МГ). Молекула HLA II содержит две цепи: α (два домена) и β (тоже два домена). Шапероны (кальретикулин, тапазин, Ii-цепь и др.) - это белки, ответственные за правильную укладку белковых молекул; в частности, шапероны обеспечивают протекцию «желобков» молекул HLA до момента загрузки на них антигенных пептидов
Рис. 7-2. Структура белков гистосовместимости (HLA I и HLA II) и шапероны. Молекула HLA I состоит из α-цепи (три домена) и β2-микроглобулина ф2-МГ). Молекула HLA II содержит две цепи: α (два домена) и β (тоже два домена). Шапероны (кальретикулин, тапазин, Ii-цепь и др.) - это белки, ответственные за правильную укладку белковых молекул; в частности, шапероны обеспечивают протекцию «желобков» молекул HLA до момента загрузки на них антигенных пептидов


