Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Предупреждение аритмий и фибрилляции сердца при помощи адаптации к стрессорным ситуациям, физическим нагрузкам и высотной гипоксииСодержание книги
Поиск на нашем сайте При изучении возможностей адаптационной и химической защиты сердца от аритмогенных эффектов стресса, ишемии, кардиосклероза мы использовали различные модели и при этом наряду с другими применяли два основных приема: измерение порога
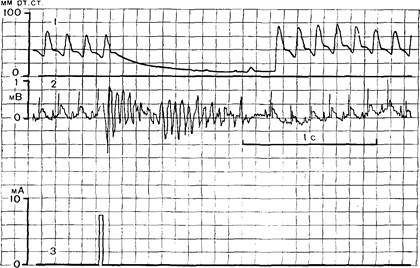
Рис. 16. Определение электрического порога фибрилляции сердца. 1 — давление в сонной артерии; 2 — ЭКГ; 3 — регистрация раздражающего импульса. фибрилляции сердца и определение резистентности автоматизма сердца и его эктопической активности посредством раздражения периферического отрезка блуждающего нерва. Рис. 16 иллюстрирует примененную нами методику определения порога фибрилляции сердца. Видно, что преждевременный одиночный импульс, подававшийся в верхушку сердца от стимулятора, запускавшегося зубцом R ЭКГ, вызывает у животных транзиторную фибрилляцию сердца, сопровождающуюся снижением АД. Порог фибрилляции, т. е. сила тока, достаточная для того, чтобы вызвать фибрилляцию, — показатель, характеризующий вероятность возникновения фибрилляции сердца и возможной смерти от фибрилляции. На рис. 17 представлен другой прием, использованный для оценки электрической стабильности сердца, который заключается в том, что нормальный автоматизм синусного узла тормозят, раздражая блуждающий нерв. У контрольных животных на фоне вагусной брадикардии, которая видна в верхней части рисунка, экстрасистолы возникают крайне редко. А у животных с экспериментальным инфарктом или постинфарктным кардиосклерозом при тех же условиях наблюдается выраженная экстрасистолия; это видно на нижней кардиограмме. На первом этапе исследований Л. М. Белкиной и С. С. Дюсеновым совместно с нами было изучено влияние стресса на порог фибрилляции сердца и его реактивность к тормозному действию
блуждающего нерва, а также оценено влияние предварительной адаптации к стрессу на стрессорное падение порога фибрилляции сердца и устойчивость его автоматизма. Иммобилизационный стресс в этих опытах создавался у крыс-самцов линии Вистар путем фиксации животных в положении на спине на 10 ч. Выяснилось, что через 2 ч после завершения стрессорного воздействия порог фибрилляции снизился более чем в 2 раза и оставался уменьшенным в течение последующих 2 сут с незначительной тенденцией к восстановлению в конце этого периода. Одновременно под влиянием стресса наблюдалось существенное повышение чувствительности синусного водителя ритма к тормозному действию блуждающего нерва. Это явление оказалось достаточно четко выраженным лишь через 12 и 24 ч после стрессорного воздействия, а затем к концу 2-х суток претерпела обратное развитие. Так, через 12 ч это снижение устойчивости автоматизма сердца к тормозному влиянию блуждающего нерва проявилось, во-первых, снижением на 1/3 пороговой силы тока, которая при раздражении блуждающего нерва вызывала вагусную брадикардию; во-вторых, в том, что частота сердечных сокращений при раздражении током, равным 2 порогам, снизилась до 177 в минуту против 308 сокращений в минуту в контроле и, наконец, в-третьих, в том, что среднее давление при этом снизилось до 71 мм рт. ст. против 111 мм рт. ст. в контроле.
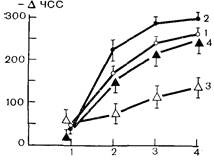
Рис. 18 позволяет сопоставить динамику постстрессорного падения порога фибрилляции и постстрессорного увеличения тормозящего вагусного эффекта на сердце. Видно, что оба явления достигают максимума одновременно — через 12—24 ч после прекращения стрессорного воздействия. Очевидно, что в условиях целого организма снижение порога фибрилляции сердца при одновременном снижении способности синусного узла противостоять тормозному влиянию блуждающего нерва может существенно увеличить вероятность появления гетерогенных очагов возбуждения, а как следствие — аритмий и фибрилляции сердца. Далее исследовали возможность предупреждения этих явлений с помощью адаптации к коротким стрессорным воздействиям. Данные, представленные в табл. 12 и на рис. 19, отражают результаты этих опытов. Из табл. 12 следует, что адаптация полностью предотвратила падение порога фибрилляции сердца, вызываемое 10-часовым иммобилизационным стрессом: у адаптированных животных через 12 ч после стресса не наблюдается какого-либо снижения порога фибрилляции. Кривые на рис. 19 показывают, что защитный эффект адаптации также четко реализуется применительно к вагусному торможению автоматизма сердца. Так, при раздражении блуждающего нерва током, равным 3 пороговым величинам, у контрольных животных частота сокра- Таблица 12. Порог фибрилляции и частота сердечных сокращений после длительного стресса (M±m)
щений падает более чем в 2 раза. Через 12 ч после длительного стрессорного воздействия отрицательный хронотропный эффект вагуса значительно увеличен: частота сердечных сокращений снижается в 3,3 раза. Адаптация сама по себе резко уменьшает отрицательный хронотропный эффект блуждающего нерва: частота сокращений снижается всего на 25 %. Одновременно эта адаптация полностью предупреждает постстрессорное увеличение отрицательного хронотропного эффекта блуждающего нерва. Таким образом, постепенная, недлительная адаптация к коротким иммобилизационным стрессорным воздействиям, предупреждающая стрессорные нарушения метаболизма и функции сердца, предотвращает вместе с тем постстрессорное снижение порога фибрилляции сердца и обнаруженное нами постстрессорное снижение устойчивости автоматизма синусного узла к тормозящему действию блуждающего нерва. Оценивая этот результат, следует иметь в виду, что стресс является неизбежным спутником острого инфаркта миокарда и одной из причин нарушения электрической стабильности сердца при этом состоянии. Поэтому представлялось вероятным, что подавляющее стресс-реакцию воздействие, а именно предварительная адаптация, может ограничить нарушения электрической стабильности сердца не только при стрессе, но и при инфаркте. На основе этого соображения было исследовано влияние острого инфаркта, воспроизводимого по Г. Селье, на порог фибрилляции сердца, устойчивость его автоматизма к тормозящему действию блуждающего нерва, а затем оценена возможность предупреждения обнаруженных нарушений с помощью рассмотренных выше защитных факторов. Из табл. 13 следует, что через 2 сут после воспроизведения инфаркта частота сердечных сокращений у животных не отлича- Таблица 13. Порог фибрилляции желудочков сердца крыс при предварительной адаптации к коротким стрессорным воздействиям (M ± m)
лась от контроля, а систолическое и диастолическое АД было ниже, чем в контроле на 37 и 24% соответственно. Изучение порога фибрилляции у этих животных показало, что инфаркт более чем
в 3 раза снижает порог фибрилляции желудочков, что согласуется с экспериментальными и клиническими данными других исследователей [Gang E. et al., 1982; McGovern В. et al., 1983]. Данные табл. 13 о защитном действии адаптации приводят к заключению, что адаптация к стрессорным воздействиям сама по себе не влияет на порог фибрилляции и в то же время она в значительной степени предупреждает постинфарктное падение порога фибрилляции. В соответствии с существующими представлениями снижение порога фибрилляции отражает повышенную «готовность» сердца к развитию аритмий. Следовательно, полученные данные указывают, что адаптация существенно уменьшает вероятность возникновения фибрилляции сердца в поздний период острого инфаркта миокарда. Рис. 20 показывает, что наряду со снижением порога фибрилляции в постинфарктный период наблюдалось снижение резистентности автоматизма синусного узла к тормозному действию блуждающего нерва. Этот эффект был особенно выраженным при раздражении силой тока, равной 2—3 порогам. Видно, что сама по себе адаптация уменьшает величину отрицательного хронотропного эффекта блуждающего нерва по сравнению с контролем, а при инфаркте влияние адаптации выражено еще больше. Действительно, при раздражении блуждающего нерва силой в 2 порога частота сердечных сокращений контрольных животных уменьшалась приблизительно на 130, а у адаптированных на 80 ударов в минуту. Для инфарктных животных этот отрицательный хроногропный эффект составил 211, а для животных, у которых до инфаркта проводилась адаптация, — 116 ударов в минуту. Существенно, что при стимуляции блуждающего нерва у 70% животных с инфарктом возникали экстрасистолы, в то время как в контроле они встречались значительно реже — в 18% случаев. Это явление, по-видимому, обусловлено как более глубоким вагусным торможением автоматизма синусного узла в условиях инфаркта, так и возникновением в краевой зоне некроза эктопических очагов возбуждения, которые выявляются при подавлении нормального водителя ритма. Подобные явления были ранее обнаружены другими исследователями [Sherlag В. et al., 1974; El-Sherif N. et al., 1982] и соответственно раздражение блуждающего нерва используется как метод выявления латентных эктопических очагов возбуждения [Penkoske P. et al., 1978; Kaplinsky E. et al., 1981; El-Sherif N. et al., 1982]. В наших экспериментах выяснилось, что предварительная адаптация к коротким стрессорным воздействиям снижает уровень эктопической активности сердца у животных с инфарктом миокарда (табл. 14). Экстрасистолия при Таблица 14. Экстрасистолия при вагусном торможении синусного узла
раздражении блуждающего нерва наблюдалась у 70% неадаптированных животных и лишь у 18% адаптированных крыс с инфарктом. Общее число экстрасистол у адаптированных животных с инфарктом миокарда оказалось сниженным даже по сравнению с животными, не имевшими инфаркта. Известно, что эктопическая активация приводит не только к возникновению экстрасистол, но является необходимым звеном механизма при спонтанной фибрилляции [El-Sherif N. et al., 1982]. Поэтому подавление эктопической автоматии адаптацией означает уменьшение вероятности развития аритмий и фибрилляции сердца в постинфарктный период. Таким образом, полученные результаты показали, что адаптация к коротким стрессорным воздействиям предупреждает постинфарктное снижение порога фибрилляции желудочков и возникновение очагов эктопического возбуждения. Этот фактор повышает устойчивость синусного узла к тормозным влияниям блуждающего нерва. Во всех рассмотренных выше опытах, так же как и в экспериментах большинства других исследователей, окклюзия коронарной артерии и ответные нарушения электрической стабильности сердца происходили в условиях, заведомо далеких от естественных, при наличии наркоза и открытой грудной клетке. Очевидно, что наркоз подавлял стрессорный эффект ишемии, вскрытие грудной клетки осложняло этот эффект и в итоге оценка действия антистрессорных факторов на электрическую стабиль- ность сердца могла быть неоднозначной. Поэтому при дальнейшем развитии работы нарушения сердечного ритма, возникавшие в ответ на острую ишемию, и возможности их предупреждения изучали в условиях бодрствования при закрытой грудной клетке по методу I. Lepran и соавт. (1983), который предусматривает 2 этапа. На первом этапе под наркозом под левую коронарную артерию подводили лигатуру, два конца которой через специальную канюлю выводили под кожу, но не затягивали. На втором этапе спустя 3—5 сут животным, фиксированным без наркоза на спине, делали кожный разрез, находили концы лигатуры и затягивали ее, т. е. осуществляли окклюзию коронарной артерии, на 5 или 20 мин. У незащищенных и защищенных адаптацией к коротким стрессорным воздействиям или ионолом животных определяли частоту возникновения различных аритмий — фибрилляции, желудочковой тахикардии и экстрасистолии, а также оценивали их суммарную длительность. ЭКГ на рис. 21 показывает, что непосредственно после окклюзии коронарной артерии у неадаптированных животных возникает острая ишемия, проявляющаяся во всех случаях резким подъемом интервала S—Т. В дальнейшем, на 5-й минуте, в ответ на ишемию возникают различного типа аритмии — множественные экстрасистолы, желудочковая тахикардия (А) и, наконец, фибрилляция сердца с последующей остановкой (Б). У адаптированных животных непосредственно после окклюзии также возникает ишемия, проявляющаяся подъемом S—Т. Однако в дальнейшем аритмии в ответ на ишемию либо вообще не возникают (Г), либо ограничиваются экстрасистолией (В). Факт, что адаптация никак не влияет на электрокардиографические проявления ишемии, вызванной коронароокклюзией, но в значительной мере предупреждает нарушения ритма, возникающие при такой ишемии, понятен, т. к. ишемия представляет собой первичный результат нарушения транспорта кислорода после пережатия коронарной артерии, а возникающие в ответ на ишемию нарушения ритма являются феноменом регуляторным и соответственно адаптация, мобилизующая, как показано выше, регуляторные стресс-лимитирующие системы, предотвращает этот феномен. Количественные данные этих экспериментов показывают, чтов течение первых 5 мин ишемии у большинства контрольных животных (у 14 из 20) возникали тяжелые аритмии, и в том числе в 6 случаях из 20 — фибрилляция желудочков, которая привела к гибели животных. При этом у 12 из 20 крыс наблюдалась экстрасистолия, а у 10 — желудочковая тахикардия. У адаптированных животных фибрилляция желудочков вообще не возникала, желудочковая тахикардия наблюдалась лишь у 2 крыс, экстрасистолия у 4 крыс из 20. Это различие усугублялось тем, что длительность возникавших аритмий у адаптированых животных была значительно меньше, чем у неадаптированных. Наиболее показательным является сопоставление суммарной длительности аритмий у адаптированных и неадаптированных животных. Эта
величина составляет у неадаптированных 541 с, а у защищенных предварительной адаптацией животных лишь 36 с, т. е. в 17 раз меньше. Таким образом, адаптация к коротким стрессорным воздействиям обладает сильным профилактическим эффектом по отношению к нарушениям электрической стабильности сердца, вызванным стрессом и ишемией; она предупреждает стрессорное снижение порога фибрилляции сердца, повышение эктопической активности и снижение порога фибрилляции при инфаркте миокарда и, наконец, саму фибрилляцию сердца при острой ишемии в условиях бодрствования. Этот обнадеживающий результат естественным образом привел нас к постановке вопроса: может ли адаптация к коротким стрессорным воздействиям устранить уже сформировавшиеся нарушения электрической стабильности в условиях, когда сами повреждающие факторы — стресс и ишемия — давно перестали действовать и налицо остался лишь результат перенесенного инфаркта, а именно: большой постинфарктный кардиосклероз. Действительно, А. В. Сумароковым еще в 1959 г. было установлено, что определенные дозы адреналина, вызывающие у нормальных собак в большинстве случаев лишь быстро проходящую брадикардию, у животных с постинфарктным кардиосклерозом в разные, достаточно отдаленные от операции по созданию инфаркта сроки вызывают пароксизмальную желудочковую тахисистолию и желудочковую экстрасистолию. Для решения этого вопроса адаптацию к коротким иммобилизационным стрессорным воздействиям начинали у животных через 15 сут после создания экспериментального инфаркта миокарда, т. е. в условиях, когда в левом желудочке в основном уже сформировался постинфарктный рубец. Адаптацию продолжали 2 нед, а затем, через 1 мес после воспроизведения инфаркта у адаптированных и неадаптированных животных, в острых опытах оценивали порог фибрилляции и эктопическую активность сердца. Постинфарктный рубец в миокарде левого желудочка в этот период визуально был четко ограничен, масса его оказалась примерно одинаковой у животных обеих серий и колебалась в пределах 151—165 мг. Данные, представленные в табл. 15, показывают, что постинфарктный кардиосклероз не приводил к достоверным изменениям Таблица 15. Порог фибрилляции желудочков при постпнфарктном Кардиосклерозе
Примечание. В каждом варианте было 11 крыс.
частоты сердечных сокращений, но в условиях острых опытов закономерно сопровождался снижением систолического АД на 40—45 мм рт. ст., т. е. больше чем на 25%. Снижение давления не устраняется адаптацией к коротким стрессорным воздействиям. Видно далее, что постинфарктный кардиосклероз закономерно сопровождается падением порога фибрилляции сердца более чем в 2 раза. Это явление полностью устраняется адаптацией к коротким стрессорным воздействиям. Влияние изучавшихся факторов на отрицательно хронотропный эффект блуждающего нерва и эктопическую активность сердца во время вагуснон брадикардии представлено в табл. 16 и 17. Из данных табл. 16 следует, что при пороговой силе раздражения блуждающего нерва оба использованных фактора не оказали Таблица 16. Отрицательный хронотропный эффект блуждающего нерва при постинфарктпом кардиосклерозе
Таблица 17. Эктопическая активность сердца во время вагусной брадикардии при постинфарктном кардиосклерозе
какого-либо влияния на величину отрицательного хронотропного эффекта. Во всех группах частота сокращений при раздражении блуждающего нерва снижалась на 30—40 в мин. При большей силе раздражения, равной 2 и 4 порогам, возникали достоверные различия между группами. Так, при экспериментальном кардиосклерозе наблюдалась определенная тенденция к увеличению отрицательного хронотропного эффекта блуждающего нерва; адаптация к коротким стрессорным воздействиям, напротив, в 1,5— 2 раза уменьшала величину отрицательного хронотропного эффекта у интактных животных и животных с постинфарктным кардиосклерозом. Таким образом, тенденция к увеличению отрицательного хронотропного эффекта блуждающего нерва, наблюдавшаяся при кардиосклерозе, оказывалась устраненной адаптацией. В этих экспериментах раздражение блуждающего нерва различной силы током в течение 30 с не приводило к возникновению экстрасистол у контрольных, а также у адаптированных к коротким стрессорным воздействиям животных. В соответствии с этим в табл. 17 представлены данные об эктопической активности, т. е. о числе экстрасистол у двух серий животных с постинфарктным кардиосклерозом, а именно у животных, не подвергавшихся после воспроизведения инфаркта каким-либо дополнительным воздействиям, и у животных, по отношению к которым была применена после этого экспериментальная терапия посредством адаптации к коротким стрессорным воздействиям. Во всех случаях приведено число экстрасистол, наблюдавшихся при раздражении блуждающего нерва в течение 30 с нарастающей силы током, использованным в наших опытах. Из данных табл. 17 следует, что уже при пороговой силе тока у животных с постинфарктным кардиосклерозом в отличие от контрольных появлялось значительное число экстрасистол — 40 на всю группу обследованных крыс. При силе раздражения, равной 2 порогам, число экстрасистол составляло 65, 3 порогам — 194, 4 порогам — 262. Суммарное число экстрасистол для данной группы животных за все 4 периода раздражения составляло 561. Этот факт, свидетельствующий о повышенной эктопической активности сердца при постинфарктном кардиосклерозе, достаточно известен. Главный результат, вытекающий из материалов табл. 17, заключается в том, что адаптация животных с сформировавшимся постинфарктным кардиосклерозом к коротком стрессорным воздействиям в 3 раза уменьшает эктопическую активность сердца — суммарное число экстрасистол составляет уже не 561, а 166. Защитный эффект адаптации к коротким стрессорным воздействиям несомненно обусловлен тем, что этот фактор в 2 раза уменьшил отрицательный хронотропный эффект раздражения блуждающего нерва (см. табл. 16) и, возможно, зависит от прямого антиаритмического действия стресс-лимитирующих систем, активированных адаптацией. Таким образом, результаты экспериментов однозначно свидетельствуют, что адаптация к коротким стрессорным воздействиям устраняет нарушения электрической стабильности сердца, а именно повышение порога фибрилляции желудочков и усиление эктопической активности, характерные для постинфарктного кардиосклероза. Для понимания этого результата существенно, что в наших экспериментах объектом исследования служили животные, взятые через 1 мес после воспроизведения инфаркта. Таким образом, стресс и ишемия не могли играть какой-либо роли в возникновении обнаруженных нарушений электрической стабильности сердца при постинфарктном кардиосклерозе и соответственно положительный результат экспериментальной терапии не может быть объяснен антиишемическим или антистрессорным эффектом. Снижение порога фибрилляции сердца и усиление эктопической активности при постинфарктном кардиосклерозе связано с существованием в стенке левого желудочка достаточно большого соединительнотканного рубца. Показано, что в самом рубце и особенно в его краевой, пограничной зоне всегда имеются вкрапления кардиомиоцитов, переживших острую ишемию, которые сохраняют биоэлектрическую активность и близкую к норме гистологическую структур/. Установлено, что эти клетки характеризуются сниженным потенциалом покоя, уменьшением амплитуды и скорости нарастания потенциала действия, а также разнонаправленными и значительными изменениями длительности ПД и рефрактерной фазы [Abildskov Т., 1980]. A'priori можно полагать, что этот комплекс изменений составляет основу неравномерного проведения возбуждения в элементах проводящей системы и сократительного миокарда и таким образом может играть роль в формировании reentry и фибрилляции сердца при возникновении преждевременного импульса из эктопического очага. В наших экспериментах такой импульс создавался путем преждевременного электрического раздражения верхушки сердца, и сила его, необходимая для того, чтобы вызвать обратимую фибрилляцию у животных с постинфарктным кардиосклерозом, была в 2 раза меньше, чем в контроле. Это полностью соответствует результатам клинико-физиологических исследований, в которых сохранившиеся клетки пограничной зоны при постинфарктном кардиосклерозе у людей были идентифицированы как место возникновения желудочковой тахикардии у больных хронической ИБС. Главное положение, вытекающее из представленных данных, заключается в том, что экспериментальная терапия с помощью адаптации к коротким стрессорным воздействиям устраняет повышение эктопической активности и нарушения электрической стабильности сердца при постинфарктном кардиосклерозе. Этот регуляторный антиаритмический эффект осуществляется при отсутствии стресса и ишемии. Он с большой долей вероятности может быть оценен как результат повышения активности стресс-лимитирующих систем, действующих на уровне сердца и мозга. Для того чтобы более конкретно представить себе роль изменений, развертывающихся на уровне мозга при адаптации к стрессорным ситуациям, в защитном эффекте такой адаптации следует учитывать приведенные выше данные J. Skinner и соавт. о роли центральных нервных и прежде всего кортикальных механизмов в патогенезе аритмий и фибрилляции сердца. Эти сообщения дают основание полагать, что одно из звеньев кардиопротекторного антиаритмического эффекта адаптации состоит в ограничении возбудимости сенсомоторной и, в частности, фронтальной коры, которая при определенных ситуациях может индуцировать аритмии и фибрилляцию сердца. Для того чтобы оценить реальность защитного действия адаптации к стрессорным ситуациям на кортикальном уровне, М. Ю. Макаровой, О. X. Коштоянцем, Р. И. Кругликовым совместно с нами было изучено влияние такой адаптации на хемореактивные свойства нейронов сенсомоторной коры, т. е. на их чувствительность к ацетилхолину и норадреналину. Крыс в течение 2 нед адаптировали к кратковременным иммобилизационным стрессорным воздействиям. Затем в острых опытах у животных, обездвиженных α-тубокурарином, на черепе крепили миниатюрный микроманипулятор, с помощью которого трехствольный структурированный микроэлектрод погружался на уровень IV—V слоев сенсомоторной коры мозга. Стволы электрода заполняли ЗМ раствором NaCl (регистрирующий электрод), 2М раствором ацетилхолина (рН 4) и 0,2М раствором битартрата норадреналина. Подведение нейромедпаторов к нейронам осуществлялось током фореза 30—40 нА в течение 30 с, сдерживающий ток не превышал 4—5 нА. Импульсную активность регистрировали до (в течение 1,5 мин), во время микроионофореза веществ (30 с) и после подведения веществ (2 мин). Для анализа использовались 60-секундные интервалы записи импульсной активности до и после микроионофоретического подведения веществ. Критерием реакции нейрона на подведение нейромедиаторов служило изменение частоты импульсации нейронов не менее чем на 20%. Всего зарегистрировано 111 нейронов у контрольных и 48 нейронов у животных, адаптированных к стрессорным воздействиям. Результаты этих исследований показали, что по относительному числу активирующихся, ареактивных и тормозящихся при подведении ацетилхолина или норадреналина нейронов адаптированные животные резко отличаются от неадаптированных (контрольных). Так, показано, что относительное число ареактивных нейронов при действии ацетилхолина у адаптированных животных составляло 56±7%, т. е. было увеличено по сравнению с контролем (24±4%) примерно в 2 раза (Р<0,01). Относительное число нейронов, реагирующих на ацетилхолин активацией или торможением, у адаптированных животных было достоверно ниже, чем в контроле на 39—56% (Р<0,05). Так, у них активировалось 25±6% нейронов (при 42±5% в контроле) и тормозилось 15 ± ±5% нейронов (при 34±4% в контроле). Сходные соотношения наблюдались и в реакциях нейронов на подведение норадреналина. Более глубокая оценка влияния адаптации на хемореактивные свойства нейронов требует учета и ряда других показателей: Таблица 18. Особенности реакций нейронов сенсомоторной коры
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 598; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.156 (0.014 с.) |