Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Всасывание продуктов гидролиза белковСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Основным продуктом гидролиза белков являются аминокислоты. Их всасывание в тонком кишечнике, так же как и транспорт через другие клеточные мембраны, осуществляется с помощью специальных транспортных систем (пермиаз) для аминокислот. Транспорт аминокислот является активным и требует необходимого градиента ионов Nа+, создаваемого Nа+/К+-АТФ-азой мембраны эпителия тонкого кишечника. Существует не менее пяти специфических транспортных систем (пермиаз), каждая из которых функционирует для переноса определенной группы близких по строению аминокислот: 1) нейтральных с короткой боковой цепью; 2) нейтральных с длинной боковой цепью; 3) с катионными радикалами; 4) с анионными радикалами; 5) иминокислот (пролина). Аминокислоты этих групп конкурируют за участки связывания с переносчиком соответствующей транспортной системы. При транспорте аминокислот через мембрану кишечного эпителия ион Nа+ входит вместе с ними внутрь клетки, т.е. имеет место симпорт аминокислот и ионов Nа+ специальной системой переносчиков. Натрий вновь «откачивается» из клетки Nа+/К+-АТФ-азой, а аминокислоты остаются внутри клетки. Есть и другая разновидность механизма транспорта аминокислот через мембрану клеток кишечного эпителия и других клеток – g-глутамильный цикл (рис. 1). Перенос аминокислоты совершается в комплексе с глутамильным остатком трипептида глутатиона с помощью специального фермента g-глутамилтрасферазы, который находится в мембране клеток кишечного эпителия. На первом этапе фермент осуществляет присоединение транспортируемой через мем-брану аминокислоты к g-глутамильному остатку глутатиона и одновременный распад уже тетрапептида на два дипептида: g-глу-тамиламинокислоту и цистеинил-глицин. На втором этапе происходит расщепление дипептида g-глутамиламинокислоты с освобождением поступившей аминокислоты и ресинтез затраченной на ее транспорт молекулы глутатиона. Для транспорта одной аминокислоты с помощью g-глутамильного цикла затрачивается 3 АТФ. У новорожденных детей проницаемость слизистой оболочки выше, чем у взрослых, поэтому в кровь могут поступать либо целые, либо частично гидролизованные молекулы белка, что может быть причиной иммунных реакций. Если ребенок получает молозиво, образующееся в первые дни после родов, то может происходить всасывание антител и антитоксинов, что имеет защитное значение. Этому дополнительно способствует присутствие в молозиве ингибитора трипсина.
Рис. 1. g-глутамильный цикл всасывания аминокислот
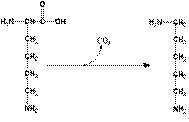
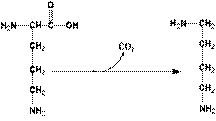
ГНИЕНИЕ БЕЛКОВ В КИШЕЧНИКЕ Около 5% невсосавшихся аминокислот в нижних отделах тонкого и в толстом кишечнике подвергается действию энзимов гнилостной флоры – гниению. В основе гниения лежат реакции декарбоксилирования и дезаминирования с образованием множества продуктов гниения. Кадаверин и путресцин – трупные яды (рис. 2). Обнаруживаются в больших количествах при гастроэнтерите, холере.
Лизин Кадаверин Орнитин Путресцин
Рис. 2. Схема гниения лизина и орнитина
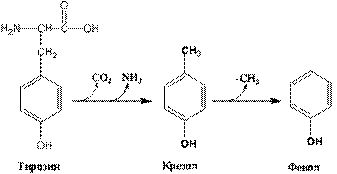
В ходе гниения тирозина и триптофана исходная молекула утрачивает радикал целиком (рис. 3, 4).
Рис. 3. Схема гниения тирозина
Рис. 4. Схема гниения триптофана Продукты гниения аминокислот являются токсичными. Они частично выводятся, а частично всасываются в толстом кишечнике, в последующем обезвреживаются в печени и выводятся с мочой. Для уменьшения количества образующихся продуктов гниения необходимо, чтобы потребление белков соответствовало физиологическому состоянию организма (физическая активность, возраст и т.д.). Кроме того, потребление пищевых волокон (целлюлоза, лигнин, пектин и т.д.) в составе растительных продуктов приводит к подкислению среды в результате их расщепления микрофлорой с образованием кислых продуктов. Кислая среда препятствует процессу гниения. Пищевые волокна улучшают также моторную функцию кишечника, что ускоряет опорожнение толстого кишечника и уменьшает всасывание продуктов гниения.
ОБЩАЯ ХАРАКТЕРИСТИКА КАТАБОЛИЗМА АМИНОКИСЛОТ В процесс катаболизма (распада) вовлекаются только те амии-нокислоты, которые оказались не использованными в ходе реакций синтеза белка или образования других соединений. Катаболизм аминокислот включает два этапа (рис. 5): 1. Дезаминирование, заключающееся в отщеплении аминогруппы в виде аммиака с образованием a-кетокислоты. 2. Катаболизм углеродного скелета аминокислоты, т.е. a-ке-токислоты.
Рис. 5. Схема катаболизма аминокислот
Обязательным этапом катаболизма аминокислот является удаление аминогруппы, т.е. их дезаминирование. Азот аминогруппы выводится у человека в виде мочевины и аммонийных солей. Эти вещества являются конечными продуктами азотистого обмена. Частично аммиак, образующийся при дезаминировании аминокислот, реутилизируется в ходе восстановительного аминирования кетокислот. Углеродные скелеты аминокислот в конечном итоге поступают в ЦТК, где они расщепляются до углекислого газа и воды. Например, при дезаминировании глутамата образуется 2-кетоглутарат, аспартата – оксалоацетат, они являются интермедиатами ЦТК. Катаболизм аланина связан с образованием пирувата, который подвергается окислительному декарбоксилированию с образованием ацетил-КоА, вовлекаемый в ЦТК. Безазотистые углеродные скелеты практически всех протеиногенных аминокислот (за исключением лейцина и лизина) могут служить субстратами глюконеогенеза, т.е. катаболизм некоторой части аминокислот связан с превращением в глюкозу, которая окисляется ради образования энергии. Часть аминокислот, метаболизм которых связан с образованием ацетил-КоА или ацетоацетил-КоА, катаболизируют путем превращения в кетоновые тела или жирные кислоты. К кетогенным аминокислотам относятся фенилаланин, лизин, тирозин, лейцин, изолейцин и триптофан.
ЗАНЯТИЕ 2.
ОБЩАЯ ХАРАКТЕРИСТИКА ПУТЕЙ ОБРАЗОВАНИЯ И ОБЕЗВРЕЖИВАНИЯ АММИАКА
Пути образования аммиака 1) дезаминирование аминокислот 2) распад пуриновых и пиримидиновых оснований 3) гидролиз амидов 4) дезаминирование биогенных аминов Аммиак является высокотоксичным соединением для животных и большинства растений. Особенно к нему чувствительна ЦНС высших животных и человека, на которую он действует как возбуждающий агент, а в повышенных концентрациях как судорожный яд. Образование аммиака в тканях идет непрерывно, но тем не менее он не накапливается в них и его концентрация в крови удерживается на низком уровне (10-20 мкг/100 мл). Аммиак в тканях подвергается связыванию с образованием нетоксичных продуктов, легко выделяемых с мочой. В процессе эволюции наш организм унаследовал 5 основных путей обезвреживания аммиака. 1.Орнитиновый цикл образования мочевины 2.Восстановительное аминирование кетокислот 3.Образование аммонийных солей 4.Синтез креатина (выделяется в виде креатинина с мочой) 5. Образование амидов
ТРАНСАМИНИРОВАНИЕ. Трансаминирование – обратимый перенос аминогруппы с аминокислоты на a-кетокислоту без промежуточного выделения аммиака, в результате чего образуется новая аминокислота и новая кетокислота. Трансаминирование осуществляется пиридоксальзависимыми ферментами – трансаминазами, локализованными как в митохондриях, так и в цитозоле клеток различных органов и тканей. Наиболее активно процесс трансаминирования идет в печени и мышцах. Трансаминированию подвергаются все аминокислоты за исключением пролина, треонина и лизина. В качестве кетокислот, акцептирующих аминогруппу, могут выступать 2-кетоглутарат, оксалоацетат и пируват. Трансаминазы проявляют специфичность по отношению к своей аминокислоте и своей кетокислоте. Ферменты относятся ко второму классу. Наибольшую активность проявляют аланинаминотрансфераза и аспартатаминотрансфераза. Трансаминирование происходит в две стадии. На первой стадии аминокислота взаимодействует с пиридоксальфосфатом в составе фермента, образуя с ним Шиффово основание, отдает ему свою аминогруппу и в результате аминокислота превращается в соответствующую кетокислоту, а пиридоксальфосфат в пиридоксаминофосфат. На второй стадии пиридоксаминофосфат взаимодействует с одной из трех a-кетокислот и передает ей аминогруппу, в результате кетокислота превращается в аминокислоту (2-кетоглутарат в глутамат, оксалоацетат в аспартат, пируват в аланин), пиридоксаминофосфат в пиридоксальфосфат. Процесс является обратимым. Значение трансаминирования: 1.Трансаминирование является первой фазой непрямого дезаминирования. При этом в роли акцептора аминогруппы выступает 2-кетоглутарат, который по ходу реакции превращается в глутамат. Глутамат является единственной аминокислотой, которая может вступать в реакцию окислительного дезаминирования. Таким образом, реакция трансаминирования выполняет функцию своеобразного коллектора, с помощью которого аминогруппы со всех аминокислот собираются на 2-кетоглутарат с образованием глутамата. Поскольку удаление аминогруппы является обязательным условием катаболизма аминокислот эта реакция обеспечивает вовлечение практически всех аминокислот на путь распада. 2.Трансаминирование - один из путей синтеза заменимых аминокислот. 3.Трансаминирование является важнейшим механизмом взаимосвязи обмена различных классов соединений (например, пируват – продукт обмена углеводов в реакции трансаминирования превращается в аланин).
|
||||
|
Последнее изменение этой страницы: 2016-08-12; просмотров: 764; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.196.180 (0.007 с.) |