Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дезаминирование аминокислот. ВосстановительноеСодержание книги
Поиск на нашем сайте
АМИНИРОВАНИЕ КЕТОКИСЛОТ. Основными типами дезаминирования аминокислот являются окислительное и непрямое дезаминирование. Окислительное дезаминирование – процесс отщепления аминогруппы от аминокислоты в виде аммиака с образованием соответствующей кетокислоты. Окислительному дезаминированию подвергается лишь глутамат, поскольку только для этой аминокислоты имеется специфичная высокоактивная НАД(Ф)-зависимая глутаматдегидрогеназа. Этот фермент локализован как в митохондриях, так и в цитозоле клетки. Реакция протекает в две стадии. На первой стадии происходит ферментативное дегидрирование аминокислоты с образованием иминокислоты. Акцептором атомов водорода является НАД(Ф). На второй стадии иминокислота спонтанно, с участием воды, распадается на аммиак и альфа-кетоглутарат. Продукт реакции может включаться в реакции ЦТК либо использоваться в качестве акцептора аминогруппы в реакциях трансаминирования. Реакция имеет значение также для катаболизма таких аминокислот как пролин, глутамин, аргинин и гистидин, так как их метаболизм происходит через стадию образования глутамата. Дезаминирование других аминокислот является непрямым и происходит в два этапа. На первом этапе аминокислоты подвергаются трансаминированию. Причем, в данном случае акцептором аминогруппы служит 2-кетоглутарат. В результате трансаминирования аминокислота лишается аминогруппы, а ее углеродный скелет подвергается катаболизму. В результате присоединения аминогруппы к 2-кетоглутарату образуется глутамат, который вступает во второй этап непрямого дезаминирования, который заключается в его окислительном дезаминировании. Непрямое дезаминирование является наиболее распространенным типом дезаминирования..
ОБМЕН АММИАКА Основным источником аммиака является дезаминирование аминокислот. Аммиак образуется также в при распаде биогенных аминов и нуклеотидов, гидролизе глутамина и аспарагина. Существенная часть аммиака образуется в кишечнике в результате деятельности микрофлоры и поступает в кровь воротной вены. Образование аммиака происходит во всех тканях, однако его концентрация поддерживается на довольно низком уровне (25–40 мкмоль/л), так как он довольно быстро обезвреживается. Существование механизмов обезвреживания аммиака связано с его токсичностью. Механизмы токсичности аммиака 1.Аммиак сдвигает реакцию восстановительного аминирования кетокислот в сторону образования глутамата 2-кетоглутарат + НАДН2 + NH3 = глутамат + НАД Снижение концентрации a-кетоглутарата вызывает угнетение обмена аминокислот, так как снижается количество акцептора в реакциях трансаминирования, а также гипоэнергетическое состояние в связи со снижением скорости ЦТК. 2.Аммиак усиливает синтез глутамина из глутамата в нервной ткани накопление глутамина в нервных клетках приводит к повышению осмотического давления и может вызвать отек мозга. Снижение концентрации глутамата нарушает образование ГАМК – основного тормозного медиатора Существует несколько способов обезвреживания и выведения аммиака в разных тканях. Основной реакцией обезвреживания аммиака почти во всех тканях является синтез глутамина под действием глутаминсинтазы. глутамат + NH3 + АТФ = глутамин + АДФ + н. Фосфат Глутамин является транспортной формой аммиака, так как представляет собой аминокислоту, способную легко проникать через клеточные мембраны. В наибольших количествах глутамин образуется в мышцах и мозге. Образовавшийся в тканях глутамин транспортируется в печень и почки, где он подвергается действию глутаминазы и расщепляется с образованием глутамата и аммиака. Аммиак в печени вовлекается в реакции орнитинового цикла, в котором образуется мочевина, в почках он используется для образования аммонийных солей. Глутаминаза почек активируется при ацидозе, полученный аммиак используется для образования аммонийных солей, что позволяет нейтрализовать кислые продукты обмена. Экскреция солей аммония составляет 0,5 г/сут. Эта реакция защищает также организм от потери натрия и калия, которые могли бы использоваться в качестве катионов при образовании солей с анионами кислот. Еще одной реакцией обезвреживания аммиака в мозге и некоторых других тканях является восстановительное аминирование 2-кетоглктарата под действием глутаматдегидрогеназы, катализирующей обратимую реакцию. Однако этот путь обезвреживания аммиака используется слабо хотя и представляется выгодным для клеток, так как способствует обезвреживанию сразу 2 молекул аммиака. 2-кетоглутарат +NH3 = глутамат + NH3 = глутамин
ОРНИТИНОВЫЙ ЦИКЛ МОЧЕВИНООБРАЗОВАНИЯ
Орнитиновый цикл мочевинообразования (цикл Кребса-Ген-зелейта) является главным механизмом обезвреживания аммиака в организме. Осуществляется только в клетках печени. Основная часть аммиака для орнитинового цикла поставляется из кишечника, а также при дезаминировании аминокислот в печени и гидролиза глутамина. В ходе этого цикла образуется мочевина – основной конечный продукт азотистого обмена. На долю мочевины приходится 80–85% всего азота, выводимого из организма. Мочевина – нейтральное, хорошо растворимое в воде соединение, легко удаляется из организма с мочой. В среднем за сутки с мочой взрослого человека выводится около 30 г мочевины. Орнитиновый цикл – процесс ферментативный, энергозависимый. На образование одной молекулы мочевины расходуется 3 АТФ. Начальные этапы цикла осуществляются в митохондриях, промежуточные и заключительные – в цитозоле клетки. Орнитиновый цикл начинается с взаимодействия свободного аммиака с углекислым газом, в результате которого образуется карбомоилфосфат. Реакция катализируется карбомоилфосфаттрансферазой и требует присутствия двух молекул АТФ. Одна из них используется в качестве донора фосфатной группы, включаемой в состав карбомоилфосфата. Карбомоилфосфат далее конденсируется с орнитином с образованием цитруллина. Орнитин в данной реакции выступает в качестве своеобразного катализатора, так как от его количества зависит скорость всего цикла. Цитруллин поступает в цитоплазму, где взаимодействует с аспартатом, в результате чего образуется аргининосукцинат. Аспартат приносит в состав мочевины еще одну аминогруппу. Аргининосукцинат в следующей реакции цикла расщепляется с образованием фумарата и аргинина. Аргинин под действием аргиназы расщепляется с образованием мочевины и орнитина. Мочевина выводится из организма с мочой, а орнитин вступает в новый цикл мочевинообразования. Фумарат, образовавшийся в предыдущей реакции, в реакциях ЦТК превращается до оксалоацетата, который в реакции трансаминирования акцептирует аминогруппу аминокислоты и превращается в аспартат и участвует в реакции с цитруллином. Источником азота одной аминогруппы мочевины является свободный аммиак, источником второй – аспартат. Между орнитиновым циклом мочевинообразования и циклом трикарбоновых кислот существует тесная функциональная зависимость. ЦТК поставляет в орнитиновый цикл СО2 и АТФ. При участии ферментов ЦТК происходит превращение фумарата в аспартат, необходимый для образования аргининосукцината. Последовательность реакций превращения фумарата в аспартат, который включается в орнитиновый цикл, выполняет роль своеобразного привода, обеспечивающего функционирование двух циклических процессов: ЦТК и орнитинового цикла.
ЗАНЯТИЕ № 3 СПЕЦИФИЧЕСКИЕ ПУТИ ОБМЕНА АМИНОКИСЛОТ. ОБМЕН НУКЛЕОТИДОВ. ВЗАИМОСВЯЗЬ ОБМЕНОВ ВЕЩЕСТВ
БИОГЕННЫЕ АМИНЫ: ОБРАЗОВАНИЕ И ИНАКТИВАЦИЯ
Биогенные амины являются продуктами декарбоксилирования ряда аминокислот (тирозина, триптофана, гистидина, глутамата) или их гидроксипроизводных (дигидроксифенилаланина – ДОФА, 5-гидрокситриптофана). К биогенным аминам относятся катехоламины (дофамин, норадреналин, адреналин), гистамин, серотонин, триптамин, тирамин, ГАМК (гамма-аминомасляная кислота). Образование биогенных аминов происходит в специализированных клетках (например, катехоламины образуются в клетках мозгового слоя надпочечников, гистамин – в тучных клетках и т.д.) под влиянием специфических тканевых В6-витаминозависимых декарбоксилаз. Синтезированные биогенные амины накапливаются в клетке в комплексе с белками или нуклеотидами. Под влиянием внешнего стимула происходит высвобождение биогенных аминов из связанных форм и активный выход из клетки путем экзоцитоза. Биогенные амины, обладая высокой физиологической активностью, могут выполнять следующие функции: а) нейромедиаторов: дофамин, норадреналин, гистамин, серотонин, триптамин, ГАМК; б) истинных гормонов: адреналин, норадреналин; в) тканевых гормонов: гистамин, серотонин. Накопление биогенных аминов могло бы отрицательно сказаться на течении физиологических процессов и привести к серьезным нарушениям регуляции обменных процессов в отдельных тканях и организме в целом. Однако органы и ткани организма обладают специальными механизмами инактивации биогенных аминов. Основным механизмом инактивации биогенных аминов является их окислительное дезаминирование под влиянием фермента – моноаминооксидазы. Образующиеся в результате окислительного дезаминирования альдегиды окисляются до соответствующих кислот. Моноаминооксидаза является ФАД-содержащим ферментом и локализуется преимущественно в митохондриях. Некоторые ингибиторы моноаминооксидазы используются в медицине для лечения гипертонической болезни, депрессии, шизофрении. Гистамин образуется при декарбоксилировании гистидина, является нейромедиатором. Вызывает расширение кровеносных сосудов, понижает артериальное давление, способствует притоку лейкоцитов к местам воспаления (защитная реакция организма против инфекции). Участвует в процессах сенсибилизации организма (поэтому аллергические состояния лечат противогистаминными препаратами). Способствует отделению соляной кислоты в желудочном соке. ГАМК образуется при декарбоксилировании глутамата. Реакция происходит под действием глутаматдекарбоксилазы, локализованной в сером веществе мозга. Является нейромедиатором, оказывает выраженное тормозное влияние на центральную нервную систему. Используется как компонент лекарственных средств, применяемых при эпилепсии, а также при заболеваниях с выраженным моторным компонентом. Серотонин образуется при декарбоксилировании 5-гидрокситриптофана, является мощным сосудосуживающим агентом и стимулятором сокращения гладких мышц. Серотонин известен как важный нейромедиатор, участвующий в восприятии болевых раздражений (и в блокировке болевой чувствительности в экстремальных ситуациях), координации моторной активности, эмоциональном поведении, поддержании ритма сна и бодрствования (наряду с мелатонином, производным серотонина), терморегуляции, а также во многих других процессах. Серотонин регулирует кишечную перистальтику, вызывает сокращение мускулатуры матки, бронхов и других гладкомышечных органов у животных и человека. Катехоламины образуются в мозговом слое надпочечников, а также в клетках мозга. Предшественником в синтезе является тирозин, который в первой реакции подвергается гидроксилированию с образованием ДОФА – дигидроксифенилаланина. В дальнейшем ДОФА декарбоксилируется и образуется дофамин. b-гидроксилирование дофамина приводит к образованию норадреналина, который в реакции трансметилирования (донором метильной группы выступает S-аденозилметионин) превращается в адреналин. В клетках мозга отсутствует фермент трансметилирования, поэтому образуется только норадреналин. Адреналин и норадреналин являются истинными гормонами. Они обладают сосудосуживающим эффектом, расширяют просвет бронхов, увеличивают частоту сердечных сокращений, способствуют мобилизации жира и гликогена из депо, усиливают гликогенолиз в мышцах.
ТРАНСМЕТИЛИРОВАНИЕ Трансметилирование – это процесс переноса метильной группы (СН3) от метионина, который содержит лабильную метильную группу. Метионин участвует в этом процессе в своей активной форме – в виде S-аденозилметионина, образующегося в реакции с АТФ. S-аденозилметионин под влиянием метилтрансферазы передает свою СН3-группу на вещество, подлежащее метилированию, т.е. акцептору. Сам он при этом превращается в S-аденозилгомоцистеин, а акцептор становится метилированным. Далее S-аденозилгомоцистеин расщепляется на аденозин и гомоцистеин. Наиболее энергично процесс трансметилирования протекает в митохондриях клеток печени. Биороль трансметилирования
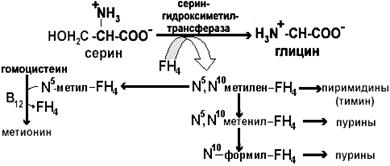
Трансметилирование используется в процессе синтеза адреналина из норадреналина, образования креатина, фосфатидилхолина из фосфатидилэтаноламина, холина из этаноламина, посттрансляционной модификации полипептидных цепей белка, процессинга рибонуклеиновых кислот (расстановка метильных меток в РНК обеспечивает их защиту от собственных эндо- и экзонуклеаз). Трансметилирование является важнейшим механизмом обезвреживания ксенобиотиков путем конъюгации аминов, фенолов и тиоловых соединений с образованием метилпроизводных. Образовавшийся в реакции трансметилирования гомоцистеин может повреждать эндотелий сосудов, в связи с чем повышенная концентрация рассматривается как этиологический фактор развития атеросклероза. Путями утилизации гомоцистеина в организме являются Вс- и В12-зависимое метилирование с образованием метионина и В6-зависимое образование цистеина. Донором метильной группы в первом случае выступает метил-ТГФК. Для успешного протекания реакции требуется присутствие кобаламина, который является коферментом метилтрансферазы. Метильная группа вначале переносится на кобаламин, а уже с метилкобаламина на гомоцистеин. Таким образом, в регенерации метионина задействованы два витамина. Функция фолиевой кислоты шире, чем участие только в реакциях трансметилирования. Она обеспечивает обмен и других одноуглеродных фрагментов – формильных, формимино, метинильных, оксиметильных и метиленовых. Основным источником одноуглеродных фрагментов является серин, который, взаимодействуя с активной формой фолиевой кислоты – тетрагидрофолиевой кислотой (FН4), передает ей метиленовую группу (рис. 1). Метилен в составе FH4 либо восстанавливается до метил-FH4, который затем переносится на гомоцистеин с образованием метионина, либо используется в реакциях синтеза тимина. Другой возможный путь – превращение метилен-FH4 в метинил-FH4 или в формил-FH4, которые используются в реакциях синтеза пуриновых нуклеотидов.
Рис.1 Роль фолиевой кислоты в обмене одноуглеродных фрагментов
|
||||
|
Последнее изменение этой страницы: 2016-08-12; просмотров: 887; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.148.115.187 (0.008 с.) |