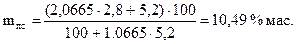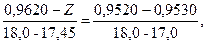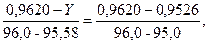Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Загальні технології харчової промисловостіСодержание книги Поиск на нашем сайте
ЗАТВЕРДЖУЮ Ректор ___________ Українець А.І. 14 червня 2010 р. ЗАГАЛЬНІ ТЕХНОЛОГІЇ ХАРЧОВОЇ ПРОМИСЛОВОСТІ
Методичні вказівки До виконання лабораторного практикуму з розділу ‘‘Технологія бродильних виробництв‘‘ студентами денної форми навчання напряму підготовки 6.051701 ‘‘Харчові технології та інженерія‘‘
Київ НУХТ 2010 Загальні технології харчової промисловості: Метод. вказівки до вик. лаб. практикуму з розділу ‘‘Технологія бродильних виробництв‘‘ студ. денної форми навчання напряму підготовки 6.051701 ‘‘Харчові технології та інженерія‘‘ / Укл.: А.М. Куц, В.М. Кошова, Р.Г. Кириленко. – К: НУХТ, 2010. – 31 с.
Рецензент С.Р. Тодосійчук, канд. біол. наук, доц.
Укладачі: А.М. Куц, В.М. Кошова, Р.Г. Кириленко, кандидати техн. наук
Відповідальний за випуск П.Л.Шиян, д-р техн. наук, проф.
Видання подається в авторській редакції Мета, зміст і організація лабораторного практикуму Лабораторний практикум згідно з навчальним планом є складовою частиною дисципліни “Загальні технології харчової промисловості”, основною метою якого є закріплення знань, отриманих під час вивчення теоретичного курсу, опанування загальними методами контролю харчової сировини і продуктів її переробки з подальшою оцінкою відповідності отриманих результатів проаналізованих зразків вимогам нормативно-технічної документації. Внаслідок виконання лабораторного практикуму студент повинен: знати: завдання і організацію роботи заводської лабораторії; терміни, що використовуються під час відбирання середньої проби і виконанні лабораторних робіт; правила безпечної роботи в хімічній лабораторії; суть методу аналізу, реактиви, прилад, посуд, техніку виконання відповідного аналізу та розрахункові формули для обрахування отриманих результатів; вимоги чинної нормативно-технічної документації щодо показників якості проаналізованих зразків; вміти: виконувати аналіз відповідно до затвердженої методики та правил безпеки; працювати з лабораторним посудом і приладами, необхідними для виконання аналізу; обраховувати та аналізувати отримані результати; оформляти результати аналізу у вигляді протоколу; давати оцінку відповідності проаналізованих зразків вимогам нормативно-технічної документації; оцінювати різні методи визначення показників якості щодо їх тривалості, безпечності, застосування відповідного обладнання тощо та обирати більш ефективний; мати навички: виконання аналізу з визначенням якісних і кількісних показників аналізованого зразка згідно затверджених методик з урахуванням правил безпечної роботи; обрахування результатів аналізу відповідних зразків, оформлення їх у вигляді протоколу та оцінювання якості аналізованого зразка відповідно до вимог чинної нормативно-технічної документації. В табл. 1 наведена програма лабораторного практикуму.
Таблиця 1 Програма лабораторного практикуму з розділу "Технологія бродильних виробництв”
Після виконання лабораторних робіт та повного оформлення протоколів, згідно встановлених вимог (п. 2.2) студент повинен їх захистити під час колоквіуму. Лабораторна робота зараховується, якщо студент відпрацював лабораторну роботу відповідно до техніки її виконання і правил безпечної роботи; знає суть аналізу, довів вміння працювати на необхідних приладах, виконав відповідні розрахунки та провів аналіз отриманих результатів; повно або з несуттєвими похибками відповідає на поставлені запитання. Лабораторна робота не зараховується, якщо студент формально відпрацював лабораторну роботу, але не знає суті аналізу; не вміє працювати на необхідних приладах, виконувати відповідні розрахунки та аналізувати отримані результати; протокол роботи оформив неохайно з граматичними помилками і нерегламентованими скороченнями; з грубими похибками відповідає на поставлені запитання. Згідно модульної оцінки знань на опанування лабораторного практикуму відводиться певна кількість балів, які в подальшому враховуються у загальній оцінці знань студентів з даного розділу дисципліни. У разі не відпрацювання або не захисту лабораторних робіт студент не отримує загальної позитивної оцінки з дисципліни. Методичні вказівки до виконання лабораторного практикуму Загальні положення
Практикум виконується в лабораторії кафедри біотехнології продуктів бродіння, екстрактів і напоїв (ауд. Ж-503, Ж-505) під керівництвом викладача. Виконанню практикуму повинна передувати самостійна робота студентів, під час якої вони зобов’язані: ознайомитись з планом роботи на поточне заняття; знати мету, суть і техніку безпечного виконання кожної лабораторної роботи; знати, які прилади, посуд і реактиви використовують для виконання кожної лабораторної роботи; оформити протокол, залишивши місце для внесення результатів аналізу, розрахунків і висновків по роботі згідно наведених нижче рекомендацій. Під час підготовки до занять студенти повинні обов’язково працювати з рекомендованою літературою і відповідними нормативно-технічними документами. До практичної роботи студенти допускаються лише після перевірки їх теоретичних знань і вміння працювати з дотриманням правил безпеки. Робота в лабораторії дозволяється тільки в халатах. Опановуючи різні методи визначення одного і того ж показника, студент повинен зробити аналіз цих методів з точки зору точності, довготривалості, характеристик використаних приладів, посуду і реактивів, а наприкінці порівняти між собою вивчені методи. У кінці кожної теми, якщо опановувалось декілька методів, студент повинен скласти зведену таблицю результатів (табл. 2), проаналізувати отримані значення показників, зробити висновки щодо відповідності проаналізованих зразків вимогам стандарту та опанованих методів. Таблиця 2 Зведена таблиця аналізу меляси
Висновки: проаналізований зразок бурякової меляси відповідає вимогам до нормальної за якістю меляси. Обидва методи визначення вмісту сухих речовин прості, передбачають приготування нормального розчину, але рефрактометричний метод вимагає наявності більш коштовного обладнання. Студент несе повну відповідальність за виконані аналізи, розрахунки та зроблені на їх підставі висновки.
2.2 Приклад оформлення протоколу
Протоколи лабораторних робіт оформляють в окремому зошиті або на стандартних листах формату А4, які скріплені між собою. Оформлені протоколи повинні мати титульний лист на якому обов’язково вказується група, прізвище та ініціали студента. Кожна лабораторна робота повинна починатися на новому аркуші. У загальному вигляді сформований протокол повинен обов’язково містити наступні розділи: напис «Лабораторна робота № ___» з відповідним порядковим номером; тему лабораторної роботи; мета роботи; перелік необхідних приладів, посуду і реактивів; методику аналізу з вказанням вихідних і проміжних результатів (назва і номер зразка, початкова маса бюкса, кількість см3 розчину, що пішла на титрування тощо); розрахункові формули для обрахунку результатів з розшифровкою всіх позначень; результати обрахунків та висновок по роботі. Методику виконання роботи можна наводити у вигляді принципової технологічної схеми. За кінцевий результат аналізу приймають середнє арифметичне двох-трьох паралельних визначень, розходження між якими не повинно перевершувати 0,2 %. Розрахунок проводять до другого десятинного знаку. Нижче наведений зразок оформлення протоколу.
Ареометричним методом
Ареометричний метод визначення масової частки сухих речовинбазується на залежності густини розчину від вмісту в ньому сухих речовин, які визначають за допомогою ареометра. Дія ареометра заснована на гідростатичному законі Архімеда, згідно з яким тіло, що занурене в рідину, виштовхується силою, яка дорівнює масі рідини, що була витіснена. Ареометр являє собою тіло, що плаває в рідині. При одній і тій самій масі ареометра глибина його занурення і витіснений ним об'єм залежать тільки від густини досліджуваного розчину. Чим вище густина рідини, тим менше занурюється в неї ареометр і навпаки. Покази ареометру для світлих розчинів знімають за нижнім меніском, а темних – за верхнім. Ареометр - це скляна циліндрична посудина, запаяна з обох кінців. Нижня, товста частина заповнена дробом, щоб ареометр плавав чітко у вертикальному положенні. У верхній частині міститься шкала з поділками. Шкалу ареометра градуюють залежно від призначення приладу. Ареометри загального призначення мають шкалу відносних густин і тому їх називають денсиметрами. Відносна густина і безрозмірною величиною і визначається відношенням густини досліджуваного розчину до густини стандартної речовини, за яку, як правило, приймають густину води при температурі 20о С і нормальному тиску. Щоб визначити концентрацію СР, використовують ареометри, які градуйовані при температурі 20о С по розчинам чистої цукрози. Їх специфічна назва − цукромір. У нечистих цукрових розчинах вони вказують на видимий вміст СР у масових частках, %. Прилади і посуд: ваги лабораторні загального призначення, хімічний стакан місткістю 100 см3, мірна колба місткістю 250 см3, цукромір, термометр, скляна паличка, лійка, циліндр місткістю 250 см3. Техніка аналізу. Наважку меляси масою 65,00 г (2,5-нормальна) зважують в хімічному стакані. Гарячою дистильованою водою (температура 70-80о С) наважку повністю переводять у мірну колбу місткістю 250 см3. Стакан, лійку і скляну паличку ретельно обполіскують і змиви додають до розчину в мірну колбу. Після цього вміст мірної колби охолоджують до температури 20о С, доводять до мітки, перемішують та виливають у циліндр. Циліндр ставлять на рівну поверхню і в розчин занурюють цукромір. За верхнім меніском знімають покази. Якщо температура розчину дорівнює 20о С, то показ цукроміра вказує на концентрацію СР у розчині меляси. Коли температура розчину не дорівнює 20о С, вводять поправку на температуру (табл. 3). Цукромір тричі занурюють у розчин і для розрахунків беруть середнє значення. Таблиця 3 – Поправки на температуру до показників цукроміра
Знаючи вміст СР в нормальному розчині меляси, за даними табл. 4 знаходять їх вміст у вихідній нерозбавленій мелясі.
Таблиця 4 – Вміст СР у мелясі та в її нормальному розчині, % мас.
Рефрактометричним методом
Метод заснований на визначенні показника заломлення і концентрації мелясного розчину за допомогою рефрактометра. Прилади і посуд: ваги лабораторні загального призначення, хімічний стакан місткістю 100 см3, мірна колба місткістю 250 см3, термометр, рефрактометр РЛ. Техніка аналізу. Нормальний розчин меляси готують за методикою, що наведена в 5.1. Перед початком роботи перевіряють нульову точку приладу. Для цього 2-3 краплі дистильованої води наносять на вимірювальну призму. Поворотом рукоятки зміщують границю світла і тіні з трьома штрихами. Ця границя повинна проходити через нульову поділку правої шкали, яка градуйована в процентах цукрози, і поділку 1,333 лівої шкали – значень показників заломлення. Перевіривши нульову точку, визначають вміст СР у розчині меляси. Для цього 2-3 краплі розчину наносять на суху вимірювальну призму. Далі спостерігаючи в окуляр зорової труби, зміщують рукоятку рефрактометра до сполучення границі світла і тіні з візирною лінією сітки. Досягнувши такого положення знімають покази за концентрацією розчину і значенням коефіцієнта заломлення. Визначивши вміст СР у нормальному розчині, за табл. 4 знаходять концентрацію СР у мелясі.
Рефрактометричним методом Аналіз виконують за методикою, що викладена в п. 4.2. з урахуванням деяких особливостей. Показник заломлення світла етиловим спиртом залежить від його концентрації і має екстремальний характер. Досягнувши максимуму при концентрації спирту 80 % мас., далі із зростанням концентрації показник заломлення світла поступово зменшується. Тому водно-спиртові розчини з концентрацією до 52 % мас. аналізуються безпосередньо. Більш концентровані розчини, для яких одному і тому самому показнику заломлення відповідають дві концентрації спирту, розчиняють дистильованою водою двічі за масою. Тому, визначивши їх міцність, отримане значення збільшують вдвічі. Рефрактометричний метод використовують тільки для чистих водно-спиртових розчинів, тому для аналізу бражки, пива, вина, горілки та інших спиртовмісних продуктів їх попередньо дистилюють і далі працюють з отриманими дистилятами. Для визначення вмісту спирту за показником заломлення застосовують прецизійні занурювальні рефрактометри (ІРФ-1, ІРФ-451 і т.п.), які дозволяють визначити цей показник з точністю ± 2×10-5, а концентрацію розчину з точність до 0,03-0,05 % мас. При роботі з іншими рефрактометрами показник заломлення знаходять з меншою точністю (± 2×10-4), що збільшує абсолютну похибку при визначенні вмісту спирту при його низьких концентрація до ± 0,3 % мас. і середніх до ± 0,6 % мас. Прилади і посуд: прецизійний занурювальний рефрактометр ІРФ-1 або іншого типу, водяна баня, термометр з ціною поділки шкали 0,5о С із шкалою від –25 до +30о С. Техніка аналізу. Під час аналізу готують водяну баню з температурою 20 оС і протягом 10-15 хв. витримують у ній вимірювальну частину рефрактометра і пробу, яку аналізують. Потім рефрактометр виймають із стояка, призму висушують рушником. Далі прилад занурюють у стаканчик з пробою, що аналізується. Знімають не менше трьох показів. За середнім значенням умовної шкали приладу в спеціальних таблицях знаходять вміст спирту в розчині в масових або об'ємних частках, %.
Приклади користування таблицями для визначення міцності водно-спиртових розчинів Якщо температура і показники спиртоміра виражені цілими числами, то дійсну міцність водно-спиртового розчину знаходять у відповідних колонках [5, табл. 3]. При дробових показниках, за винятком показників спиртоміра, що кратні 0,5, користуються методом лінійної інтерполяції. Приклад 1. Покази скляного спиртоміра 89,5 при температурі 12о С. За [5, табл. 3], знаходимо міцність спирту при температурі 20о С – 91,52 об’ємної частки. Приклад 2. Покази скляного спиртоміра 52,5, а температура розчину 18,1о С. За [5, табл. 3] знаходимо дійсний вміст спирту в розчинні при показах спиртоміра 52,5 і температурах 18-19о С; 18о С – 53,24; 19о С – 52,87; 18,1о С – Х. Дійсний вміст спирту при температурі 18,1о С і показах спиртоміра 52,5 визначаємо з рівняння
тоді Х = 53,20 об’ємної частки. Приклад 3. За результатами досліду покази скляного спиртоміра 42,4 при температурі 22,6о С. По таблиці [5, табл. 3] знаходимо дійсний вміст спирту при температурах 22 і 23о С та показах спиртоміра 42,0 і 42,5. Для знаходження дійсного вмісту спирту за результатами досліду складаємо табл. 5.
Таблиця 5 – Вміст спирту при різних температурах і показах спиртоміра
Знаходимо значення Х з рівняння:
тоді Х = 40,96 об’ємної частки; Значення Z знаходимо з рівняння:
тоді Z = 41,46 об’ємної частки. Тепер, коли відомі дійсні значення вмісту спирту при температурі 22,6о С і показах спиртоміра 42,0 і 42,5, визначаємо дійсну міцність розчину Y:
тоді Y = 41,36 % об’ємної частки. Початковому суслі Початковим називають охолоджене сусло, яке подається на зброджування. Концентрація початкового сусла mпс − показник, який регламентується стандартом для кожного виду пива. Розрахунок ведуть за результатами аналізу готового пива і з урахуванням втрат екстракту сусла під час бродіння, які встановлені емпірично. Формула для розрахунку масової частки сухих речовин в початковому суслі mпс в відсотках:
де mс – масова частка спирту в пиві, %; mе – масова частка дійсного екстракту в пиві, %; 2,0665 – маса екстракту, що витрачається на утворення 1 г спирту, г; 1,0665 – маса екстракту, що видаляється з пива (з дріжджами та діоксидом вуглецю) при отриманні 1 г спирту, г. Приклад. Масова частка спирту в пиві 2,8 %, масова частка дійсного екстракту – 5,2 %. Початкова концентрація сусла:
Облік спирту Етиловий спирт змішується з водою в будь-яких співвідношеннях. Цей процес супроводжується виділенням теплоти і зміною об’єму водно-спиртової рідини (адіабатичне стискання – контракція), яка залежить від концентрації спирту в розчині. Окрім того, об’єм водно-спиртових рідин суттєво залежить від їх температури. Тому в спиртовому, лікеро-горілчаному та інших виробництвах, пов’язаних із використанням спирту етилового ректифікованого, його облік здійснюють у перерахунку на безводний спирт. За одиницю виміру беруть 1 дал безводного спирту. Вміст безводного спирту Vб.с у водно-спиртовому розчині при температурі 20о С знаходять, помноживши об’єм водно-спиртового розчину Vср на вміст спирту С в об’ємних частках, дал: Vб.с = Vср∙С дал. При обліку кількості водно-спиртових розчинів їх об’єми доводиться вимірювати при температурах, які в багатьох випадках не дорівнюють 20о С. Але добре відомо, що температура суттєво впливає на густину спирту в одиниці об’єму: з її пониженням густина спирту збільшується, зі збільшенням – зменшується. Відповідно змінюються і покази спиртоміру. Для перерахунку різних об’ємів водно-спиртових розчинів, які мають різну температуру, в безводний спирт при температурі 20о С, використовують таблицю множників [5, табл. 5]. Множник знаходять, коли знають вміст спирту в об’ємних частках і температуру, при якій проводили вимірювання. Об’єм водно-спиртового розчину, який знайшли при даній температурі, множать на знайдений множник K і отримують об’єм безводного спирту в рідині при температурі 20о С, дал: Vб.с = Vср∙K дал. Приклад 1. Об’єм водно-спиртового розчину при температурі 14о С дорівнює 4000 дм3 при вмісті спирту 96,3 об’ємних часток. Знайти об’єм безводного спирту. Оскільки таблиця множників для перерахунку на безводний спирт розрахована на цілі значення спирту і температури, то коли в розрахунках зустрічаються дробові числа, множник знаходять лінійною інтерполяцією. За [5, табл. 5] множники для визначення вмісту спирту при об’ємній частці спирту 0,96 і 0,97 та температурі 14о С дорівнюють відповідно 0,9662 і 0,9762. Щоб знайти множник для визначення вмісту спирту при об’ємній частці 0,963, використовуємо таке рівняння:
тоді Х = 0,9692. Отже, кількість безводного спирту становить: Vб.с = 4000∙0,9692 = 3876,8 дм3. Приклад 2. Об’єм водно-спиртового розчину 20000 дм3 при температурі 17,5о С. Міцність спирту 95,58 об’ємних часток. Знайти кількість безводного спирту. За [5, табл. 5] знаходимо значення множників для ближніх цілих значень вмісту спирту і температури (табл. 6).
Таблиця 6 – Вміст спирту при різних температурах
Знаходимо значення Х з рівняння:
тоді Х = 0,9613.
Знаходимо значення Z з рівняння:
тоді Z = 0,9526; Значення Y знаходимо з рівняння: 0,96261 – Y / 96,0 – 95,58 = (0,96261 – 0,95255) / (96,0 – 95,0),
тоді Y = 0,9626. Кількість безводного спирту: Vб.С.= 20000 ∙ 0,9626 = 19242,6 дм3.
Питання для самоперевірки 1. Види та характеристика скляних спиртомірів, які використовують для визначення вмісту етилового спирту? 2. Від чого залежить відносна густина водно-спиртового розчину? 3. Як і в чому градуйованні шкали скляних спиртомірів? 4. За яких умов покази спиртоміра вказують на дійсну міцність водно-спиртового розчину і коли для визначення цього показника використовують спеціальні таблиці? 5. Методика визначення міцності водно-спиртового розчину за допомогою скляного спиртоміра. 6. Визначити за допомогою спиртомірних таблиць вміст спирту, якщо температура розчину (о С) і покази спиртоміра відповідно становлять: 1) 12о С і 86,5; 2) 25,2о С і 68,4; 3) 31,2о С і 89,3. 7. Для чого і як визначається об’єм безводного спирту? 8. Знайти кількість безводного спирту в збірнику місткістю 10000 дм3, якщо температура і вміст спирту відповідно дорівнюють: 1) 20о С і 96,0 % об.; 2) 26,3о С і 97,2 % об. 9. Техніка визначення вмісту спирту рефрактометричним методом. 10. Охарактеризуйте значення коефіцієнта заломлення від вмісту спирту в розчині. 11. Чому для визначення вмісту спирту застосовують виключно прецизійні рефрактометри та як градуйована їх шкала вимірювання? 12. З якою метою здійснюють перегонку спирту із пива? 13. Як впливають сухі речовини пива на дійсний вміст спирту при застосування скляних спиртомірів? 14. Яким чином запобігають втратам спирту під час його перегонки із пива? 15. Як розраховують концентрацію початкового сусла? 16. Що характеризує і як дійсна ступінь зброджування пива? 17. На чому базуються хімічні методи визначення спирту? Напишіть відповідні хімічні реакції. 18. Техніка визначення вмісту спирту дихроматно-йодометричним методом. 19. В яких межах повинна бути концентрація спирту в розчині при застосуванні дихроматно-йодометричного методу? 20. Основні переваги і недоліки дихроматно-йодометричного методу визначення вмісту спирту порівняно з іншими методами.
6 Методи визначення екстрактивності солоду та інших харчових продуктів
Навчальне видання
Методичні вказівки ЗАТВЕРДЖУЮ Ректор ___________ Українець А.І. 14 червня 2010 р. ЗАГАЛЬНІ ТЕХНОЛОГІЇ ХАРЧОВОЇ ПРОМИСЛОВОСТІ
Методичні вказівки
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-12; просмотров: 402; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.76.168 (0.026 с.) |

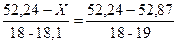
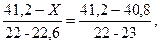
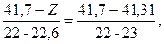
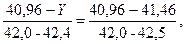
 (1)
(1)