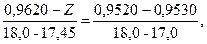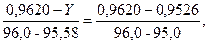Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дихромато-йодометричним методомСодержание книги Поиск на нашем сайте
Хімічні методи ґрунтуються на окисленні етилового спирту в оцтову кислоту. В якості окислювача використовують дихромат калію K2Cr2О7. За витратами окислювача встановлюють кількість спирту в аналізованій пробі. Такі методи відносяться до непрямих. Вони є одними з найбільш точних методів визначення спирту в низькоконцентрованих спиртовмісних продуктах. Із збільшенням кількості домішок (альдегідів, естерів, кислот, вищих спиртів) точність методу знижується. Дихроматно-йодометричний методоснований на окисленні спирту дихроматом калію до оцтової кислоти з подальшим визначення об’єму дихромату калію, що пішов на окислення спирту. Його визначають як різницю між об’ємом дихромату калію, взятим для аналізу, та його надлишком, що залишився після окислення спирту. Надлишок дихромату калію визначають йодометричним методом відповідно до реакції:
K2Cr2O7 + 6KJ + 7H2SO4 = 3J2 + 4K2SO4 + Cr2(SО4)3 + 7H2O.
Вільний йод, що при цьому виділяється, титрують тіосульфатом натрію. При цьому йод окислює тіосульфат натрію до тетратіонату натрію з одночасним відновленням до катіону йоду за реакцією:
2Na2S2O3 + J2 = 2NaJ + Na2S4O6.
У ході цієї реакції властиве йоду темно-буре забарвлення зникає поступово, тому для визначення кінця реакції застосовується як індикатор 1%-ний розчин крохмалю, який з йодом утворює з’єднання інтенсивно синього забарвлення. Титрування закінчують, коли яскраво синє забарвлення розчину перейде в блакитно-зелене. За кількістю витраченого тіосульфату натрію встановлюють витрати дихромату калію на окислення спирту, як різницю між вихідним об’ємом і надлишком, який не вступив в реакцію окиснення спирту. Знаючи еквівалент розчину дихромату калію по спирту, визначають вміст етилового спирту в дослідному розчині. Еквівалент 0,5 н. розчину K2Cr2O7 по спирту розраховують із реакції окислення спирту: 2K2Cr2O7=3C2H5OH 2×294,22 г = 3×46,01 г. 0,0245=х г; де х – кількість спирту, окисленого 1 см3 0,5 н. розчину K2Cr2O7, г. 0,0245 – вміст K2Cr2O7 в 1см3 0,5 н. розчину, г.
Отже, 1 см3 0,5 н. розчину K2Cr2O7 еквівалентний 0,0073 см3 спирту. Дихроматно-йодометричний метод визначення спирту широко використовується в харчовій промисловості. Основною перевагою методу є те, що ним можна достатньо точно визначати спирт в невеликих об’ємах рідини. Метод дає добре відтворені результати дослідів при аналізі водно-спиртових продуктів з вмістом спирту 0,5-25 %. Точність методу значно підвищується за рахунок йодометричного визначення надлишку дихромату калію. Для гарантії повноти окислення спирту до оцтової кислоти надлишок дихромату калію повинен бути не меншим 2-3 см3, а окислюватись завжди повинна одна і та ж кількість спирту. Тому продукти за вмістом спирту 5-15 % розводять в 10 разів, а більш концентровані розчини – в 20 разів. Розчини з вмістом спирту до одного відсотку аналізують без розбавлення. Дослід проводять при температурі 18-20оС. Внаслідок високої концентрації титрованого розчину дихромату калію вимір його в ході досліду повинно бути дуже точним, оскільки помилка в 0,1 см3 дає відхилення в міцності ± 0,2 % об. На точність результатів аналізу впливають домішки спирту, які також окислюються дихроматом калію, але ці похибки значно нижчі тих, які мають місце при пікнометричних і аерометричних визначеннях спирту в низькоконцентрованих водно-спиртових розчинах. Як в ареометричному і рефрактометричному методах, аналізують тільки чисті водно-спиртові розчини, тому спиртовмісні продукти з домішками попередньо дистилюють і далі працюють з отриманими дистилятами. Реактиви і посуд: 0,5 н. розчин дихромату калію, 0,1 н. розчин тіосульфату натрію, хімічно чиста сірчана кислота з густиною 1,84 г/см3, 1 %-ний розчин крохмалю, 10 %-ний розчин йодиду калію, конічна колба місткістю 500 см3, бюретка на 10 см3, циліндри на 5 і 10 см3, часове скло. Техніка аналізу. В конічну колбу місткістю 500 см3 відмірюють з бюретки точно 10 см3 розчину дихромату калію і обережно циліндром по стінці прибавляють 5 см3 сірчаної кислоти. Коли колба прохолоне, до неї додають 5 см3 досліджуваного розчину з вмістом спирту біля 1 %. У разі потреби вихідний розчин розбавляють у 10 або 20 разів. Через 15 хв. (цього часу достатньо для окислення спирту при кімнатній температурі) до суміші добавляють 10 см3 10 %-го розчину йодиду калію і колбу накривають часовим склом. Через 5 хв. в колбу добавляють 200-250 см3 дистильованої води і вільний йод, що виділився, титрують 0,1 н. розчином тіосульфату натрію, прибавляючи в кінці титрування 2-3 см3 1 %-ного розчину крохмалю. Титрування закінчують при появі голубувато-зеленого забарвлення розчину. Приклад. Визначити кількість спирту в водно-спиртовому розчині, якщо відомо, що на титрування вільного йоду потрачено 1 см3 0,1 н. розчину тіосульфату натрію. Початковий розчин розбавлений в 20 разів. Кількістьспирту С визначають з урахуванням витрати 0,5 н. розчину дихромату калію на його окислення, еквіваленту 0,5 н. розчину дихромату калію по спирту (1 см3 розчину відповідає 0,0073 см3 спирту), а також розбавлення початкового продукту (100:5=20);
де а – кількість 0,5 н. розчину дихромату калію, взяте на окислення спирту, см3; б – кількість 0,1 н. розчину тіосульфату натрію, витрачено на титрування утвореного вільного йоду, см3; 5 – коефіцієнт переведення 0,1 н. розчину тіосульфату натрію у 0,5 н. розчин. Таким чином, якщо в 5 см3 досліджуваного розчину міститься 1,43 см3 спирту, то в 100 см3 його буде Х:
Облік спирту Етиловий спирт змішується з водою в будь-яких співвідношеннях. Цей процес супроводжується виділенням теплоти і зміною об’єму водно-спиртової рідини (адіабатичне стискання – контракція), яка залежить від концентрації спирту в розчині. Окрім того, об’єм водно-спиртових рідин суттєво залежить від їх температури. Тому в спиртовому, лікеро-горілчаному та інших виробництвах, пов’язаних із використанням спирту етилового ректифікованого, його облік здійснюють у перерахунку на безводний спирт. За одиницю виміру беруть 1 дал безводного спирту. Вміст безводного спирту Vб.с у водно-спиртовому розчині при температурі 20о С знаходять, помноживши об’єм водно-спиртового розчину Vср на вміст спирту С в об’ємних частках, дал: Vб.с = Vср∙С дал. При обліку кількості водно-спиртових розчинів їх об’єми доводиться вимірювати при температурах, які в багатьох випадках не дорівнюють 20о С. Але добре відомо, що температура суттєво впливає на густину спирту в одиниці об’єму: з її пониженням густина спирту збільшується, зі збільшенням – зменшується. Відповідно змінюються і покази спиртоміру. Для перерахунку різних об’ємів водно-спиртових розчинів, які мають різну температуру, в безводний спирт при температурі 20о С, використовують таблицю множників [5, табл. 5]. Множник знаходять, коли знають вміст спирту в об’ємних частках і температуру, при якій проводили вимірювання. Об’єм водно-спиртового розчину, який знайшли при даній температурі, множать на знайдений множник K і отримують об’єм безводного спирту в рідині при температурі 20о С, дал: Vб.с = Vср∙K дал. Приклад 1. Об’єм водно-спиртового розчину при температурі 14о С дорівнює 4000 дм3 при вмісті спирту 96,3 об’ємних часток. Знайти об’єм безводного спирту. Оскільки таблиця множників для перерахунку на безводний спирт розрахована на цілі значення спирту і температури, то коли в розрахунках зустрічаються дробові числа, множник знаходять лінійною інтерполяцією. За [5, табл. 5] множники для визначення вмісту спирту при об’ємній частці спирту 0,96 і 0,97 та температурі 14о С дорівнюють відповідно 0,9662 і 0,9762. Щоб знайти множник для визначення вмісту спирту при об’ємній частці 0,963, використовуємо таке рівняння:
тоді Х = 0,9692. Отже, кількість безводного спирту становить: Vб.с = 4000∙0,9692 = 3876,8 дм3. Приклад 2. Об’єм водно-спиртового розчину 20000 дм3 при температурі 17,5о С. Міцність спирту 95,58 об’ємних часток. Знайти кількість безводного спирту. За [5, табл. 5] знаходимо значення множників для ближніх цілих значень вмісту спирту і температури (табл. 6).
Таблиця 6 – Вміст спирту при різних температурах
Знаходимо значення Х з рівняння:
тоді Х = 0,9613.
Знаходимо значення Z з рівняння:
тоді Z = 0,9526; Значення Y знаходимо з рівняння: 0,96261 – Y / 96,0 – 95,58 = (0,96261 – 0,95255) / (96,0 – 95,0),
тоді Y = 0,9626. Кількість безводного спирту: Vб.С.= 20000 ∙ 0,9626 = 19242,6 дм3.
Питання для самоперевірки 1. Види та характеристика скляних спиртомірів, які використовують для визначення вмісту етилового спирту? 2. Від чого залежить відносна густина водно-спиртового розчину? 3. Як і в чому градуйованні шкали скляних спиртомірів? 4. За яких умов покази спиртоміра вказують на дійсну міцність водно-спиртового розчину і коли для визначення цього показника використовують спеціальні таблиці? 5. Методика визначення міцності водно-спиртового розчину за допомогою скляного спиртоміра. 6. Визначити за допомогою спиртомірних таблиць вміст спирту, якщо температура розчину (о С) і покази спиртоміра відповідно становлять: 1) 12о С і 86,5; 2) 25,2о С і 68,4; 3) 31,2о С і 89,3. 7. Для чого і як визначається об’єм безводного спирту? 8. Знайти кількість безводного спирту в збірнику місткістю 10000 дм3, якщо температура і вміст спирту відповідно дорівнюють: 1) 20о С і 96,0 % об.; 2) 26,3о С і 97,2 % об. 9. Техніка визначення вмісту спирту рефрактометричним методом. 10. Охарактеризуйте значення коефіцієнта заломлення від вмісту спирту в розчині. 11. Чому для визначення вмісту спирту застосовують виключно прецизійні рефрактометри та як градуйована їх шкала вимірювання? 12. З якою метою здійснюють перегонку спирту із пива? 13. Як впливають сухі речовини пива на дійсний вміст спирту при застосування скляних спиртомірів? 14. Яким чином запобігають втратам спирту під час його перегонки із пива? 15. Як розраховують концентрацію початкового сусла? 16. Що характеризує і як дійсна ступінь зброджування пива? 17. На чому базуються хімічні методи визначення спирту? Напишіть відповідні хімічні реакції. 18. Техніка визначення вмісту спирту дихроматно-йодометричним методом. 19. В яких межах повинна бути концентрація спирту в розчині при застосуванні дихроматно-йодометричного методу? 20. Основні переваги і недоліки дихроматно-йодометричного методу визначення вмісту спирту порівняно з іншими методами.
6 Методи визначення екстрактивності солоду та інших харчових продуктів
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-12; просмотров: 244; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.009 с.) |

 або
або