
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Термодинаміка змочування і адгезії
Розглянемо краплю рідини із крайовим кутом Θ (рис. 1.1), поміщену на тверду поверхню. Для видалення краплі з поверхні повинна бути витрачена робота із заміни поверхні взаємодії Т-Р на поверхні взаємодій Т-Г і Р-Г (де Т – тверде тіло; Р – рідина; Г – газова фаза). Робота адгезії, яку необхідно затратити для такого роз’єднування на одиниці площі, визначається рівнянням Дюпре:
де γS, γL, γSL – питомі вільні поверхневі енергії (або міжфазний натяг) на границях Т-Г, Р-Г, Т-Р. Ці величини пов’язані зі значенням крайового кута наступним співвідношенням (закон Юнга):
Комбінуючи рівняння (1.1) і (1.2), одержуємо:
Таким чином, робота адгезії визначається крайовим кутом змочування і поверхневим натягом рідини. Енергія, необхідна для когезійного руйнування усередині рідини Wког, становить 2∙ γL і дорівнює Wад для θ = 0 (тобто при повному змочуванні рідиною твердого тіла). При θ = 0 когезійне руйнування в рідині відбувається з тією ж вірогідністю, що й адгезійне руйнування на границі поділу Р-Т. За неповного змочування (θ > 0) адгезійне руйнування відбувається легше, тому що Wад < 2 ×γL. У рівнянні (1.1) γS являє собою енергію поверхні Т-Г тільки при умові, що рідина повністю вилучена з поверхні. І в цьому випадку рівняння (1.3) є застосовним. Однак, при видаленні рідини з поверхні частина її може бути адсорбована поверхнею, і, отже, рідина повністю не видаляється. У цьому випадку поверхня Т-Г буде мати дві частини: незмінену первісну частину й частину з адсорбованим шаром, яка матиме меншу поверхневу енергію, тому що відбулася адсорбція. Якщо цій частині поверхні відповідає γS у рівнянні (1.1), то чистій поверхні відповідає більш висока енергія γS+П. Тоді
Різниця між роботою адгезії на чистій і покритій поверхні П не може бути виміряна безпосередньо, але може бути обчислена з ізотерми адсорбції пари рідини на твердому тілі. Якщо V − кількість парів, адсорбованої за тиску Р, то рівняння Гіббса матиме вигляд:
звідки
де Р − тиск насиченої пари. На практиці використовують значення роботи адгезії без урахування цієї поправки.
Робота адгезії Wад безпосередньо пов’язана з міцністю молекулярних зв’язків на поверхні Т-Р, і зростає зі збільшенням міцності цих зв’язків. Звичайно розривна міцність адгезійного зчеплення визначають після того, як адгезив затвердів у результаті охолодження, полімеризації або видалення розчинника. Всі розрахунки Wад відносяться до рідкого адгезиву і їх не можна переносити на твердий адгезив, тому що зміни структури підчас твердіння впливають на адгезію. Крім того, на адгезію впливає виникнення внутрішніх напружень у ході твердіння. Роботу адгезії Wад між двома твердими тілами (1) і (2) можна визначити так:
де γi – відповідна вільна поверхнева енергія. Робота адгезії тих же двох тіл у серодовищі рідини
звідки
Якщо рідина не розтікається по поверхні цих твердих тіл і характеризується різними крайовими кутами, то у стані рівноваги
Підставляючи (1.10) і (1.11) у (1.9) одержимо:
Якщо за допомогою введення поверхнево-активної речовини (ПАР) знизити вільну поверхневу енергію рідини настільки, що робота адгезії рідини дорівнюватиме нулю, то рівняння (1.12) матиме вигляд:
де Більшість рідин на поверхнях з високою енергією схильна розтікатися з утворенням крайового кута, рівного нулю (поверхня оксидів металів: рутилy TiO2, корунду Al2O3). У цьому випадку для обчислення роботи адгезії необхідно визначати теплоту занурення твердого тіла в рідину: qi(S,L) = – hi(S,L), де hi(S,L ) – зміна ентальпії в процесі занурення, пов’язана з ентальпією адгезії hА рівнянням:
де hL – ентальпія, віднесена до одиниці поверхні рідини, обчислена з поверхневого натягу і його температурного коефіцієнта. Оскільки
то hА повинна змінюватися пропорційно Wад, тому що зміна ентропії в процесі адгезії залишається майже незмінною для великої кількості рідин. Величину hА можна зв’язати зі зміною істинної енергії адсорбції, тобто з різницею між енергією молекули рідини в адсорбованому стані ЕА й енергією молекули в рідині ЕL. Якщо число адсорбованих молекул на одиницю поверхні дорівнює NA, то
Отже, знаючи NA, ЕА можна обчислити із hА. За здатністю змочуватись тверді тіла звичайно підрозділяють на два класи: - речовини з високою поверхневою енергією; - речовини з низькою поверхневою енергією. Поверхні з високою поверхневою енергією цілком змочуються майже всіма чистими рідинами, тобто крайовий кут змочування для них дорівнює нулю. Поверхні з низькою енергією обмежено змочуються багатьма рідинами (Θ > 0). До першого класу таких речовин відносяться метали, кварц, скло; до другого - органічні речовини, смоли, полімери. Пряме знаходження γS є проблематичним. Тому для кількісної оцінки вільної поверхневої енергії твердого тіла введене поняття критичного поверхневого натягу γС, який визначають як максимально припустиме значення поверхневого натягу рідини, за якого для випадку нанесення цієї рідини на поверхню тіла cosΘ = 1 (тобто має місце повне змочування). Якщо поверхневий натяг γС (табл. 2) відомий, можна передбачити значення рівноважного крайового кута будь-якої рідини на цій поверхні й на підставі цього визначити, чи буде вона розтікатися на поверхні, чи ні.
Таблиця 2. Значення γС деяких полімерів при 200 °С
Якщо γL < γС, крайовий кут Θ = 0 і рідина мимовільно розтікається на поверхні. Якщо рідина не розтікається на твердій поверхні з високою енергією, то, отже, на ній утворилася плівка, яка зменшила поверхневу енергію настільки, що поверхня поводиться подібно поверхні з низькою енергією. Це може мати місце внаслідок адсорбції летких речовин або домішок на поверхневому шарі. Рідина може адсорбуватися на поверхні з високою енергією, утворюючи моношар, по якому вона сама не здатна розтікатися (аутофобна рідина). Ці випадки дуже важливі у разі одержання склопластиків, коли використовувані скловолокно й смола, а також середовище забруднені хімічними речовинами, що мають зазначені вище властивості. На поверхні скла легко адсорбуються ПАР, що суттєво знижують γS таких поверхонь і змінюють їх змочування полімерними рідинами. Отже, будь-яка речовина, що адсорбується на поверхні скловолокна в процесі його виробництва (наприклад замаслювач) не повинна зменшувати γS до значення, меншого, ніж поверхневий натяг рідкої смоли (апрети повинні підвищувати γS на поверхні скловолокна). За визначення адгезії методом відриву силу, подолану підчас одночасного відриву по всій площі контакту, віднесену до одиниці площі, називають адгезійним тиском, або тиском прилипання, і вимірюють у Н/м2, дін/см2 (1 дін/см2 = 10-1 Н/м2). У разі визначення адгезії шляхом поступового порушення контакту знаходять опір розшаровуванню. Роботу розшаровування, віднесену до одиниці площі контакту, називають питомою роботою розшаровування, або роботою адгезії й вимірюють в ерг/см2, дін/см, Дж/м2 або Н/м (1 ерг/см2 = 10-3 Дж/м2 = 10-3 Н/м).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-06; просмотров: 230; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.118.198 (0.011 с.) |

 ,
,

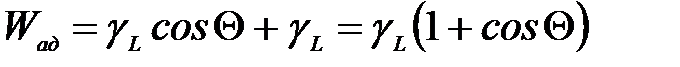 .
.
 .
.
 ,
,

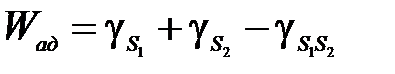 ,
,
 ,
,
 .
.
 ;
;
 .
.

 .
.
 ,
,
 – поверхневий натяг рідини, що забезпечує нульову адгезію.
– поверхневий натяг рідини, що забезпечує нульову адгезію. ,
,
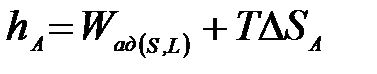 ,
,
 .
.



