Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Активация гексозаминового пути метаболизма глюкозыСодержание книги
Поиск на нашем сайте
В условиях гипергликемии образовавшийся из глюкозы фруктозо-6-фосфат не используется для гликолитических реакций, но служит субстратом для образования уридин-дифосфат-N-ацетилглюкозамина, а также некоторых протеогликанов и гликопротеинов. Остатки N-ацетилглюкозамина способны взаимодействовать с сериновыми и треониновыми остатками факторов транскрипции в эндотелиоцитах и сосудистых гладкомышечных клетках. Это приводит к перемещению факторов транскрипции в ядро и активации там целого ряда генов. В частности, в результате такого действия факторов транскрипции увеличивается синтез трансформирующего фактора роста-β гладкомышечными клетками кровеносных сосудов, который стимулирует синтез соединительнотканных волокон фибробластами сосудистой стенки; в эндотелиоцитах и сосудистых гладкомышечных клетках увеличивается образование ингибитора активатора плазминогена-1, приводящее к нарушению фибринолиза; в эндотелиоцитах снижается активность конституциональной NO-синтазы. Кроме того, установлено, что активация гексозаминового пути метаболизма глюкозы вносит определенный вклад в механизмы развития инсулинорезистентности. Развитие «окислительного стресса» В сосудистой стенке При гипергликемии увеличивается поступление глюкозы в эндотелиоциты. При дефиците инсулина другие клетки сосудистой стенки могут в качестве субстрата энергии использовать свободные жирные кислоты. Глюкоза (или жирные кислоты) метаболизируются до ацетил-КоА, который используется в цикле трикарбоновых кислот. В итоге при увеличении концентрации глюкозы внутри клеток в них образуются бόльшие, чем в обычных условиях, количества доноров электронов. Это приводит к повышению мембранного потенциала митохондрий и к увеличению периода активного «полусуществования» ферментов дыхательной цепи, генерирующих супероксидный радикал. Таким образом, в клетках накапливается супероксидный радикал, а при его дальнейших химических превращениях - и другие АФК. Если АФК накапливаются в промежуточных концентрациях, они могут посредством механизмов редокс-регуляции изменять характер активности целого ряда как структурных, так и функциональных протеинов, в частности, факторов транскрипции с последующей активацией клеток сосудистой стенки и развитием в ней воспаления. С другой стороны, при накоплении АФК может произойти снижение активности антиоксидантных ферментов и уменьшение концентрации низкомолекулярных неферментных антиоксидантов, важнейшим из которых является восстановленный глутатион. Это приведет к тому, что АФК вызовут повреждение липидов, белков и нуклеиновых кислот с последующим необратимым повреждением клеток и их гибелью. Существует тесная взаимосвязь между повреждающим действием АФК и развитием вышеперечисленных патогенетических механизмов, лежащих в основе развития диабетических микроангиопатий. Так, увеличение образования О2 -. в митохондриях эндотелиоцитов при увеличении содержания в них глюкозы приводит к разрыву цепей ДНК. При этом в ядре активируется фермент, участвующий в процессах репарации ДНК – поли(АДФ-рибоза)-полимераза. В процессе ферментативной реакции, катализируемой ею, НАД расщепляется до никотиновой кислоты и АДФ-рибозы. Последняя взаимодействует с ферментом глицеральдегид-3-фосфат-дегидрогеназой. Этот фермент, подобно челноку, перемещается из цитоплазмы в ядро и обратно. АДФ-рибоза способна инактивировать этот фермент. Снижение активности глицеральдегид-3-фосфат-дегидрогеназы сопровождается активацией в эндотелиоцитах полиолового и гексозаминового путей метаболизма глюкозы, а также активацией протеинкиназы С и увеличением образования конечных продуктов гликозилирования, что лежит в основе патогенеза прогрессирования диабетических микроангиопатий. Важно, что при увеличении образования в клетках сосудистой стенки супероксидного радикала в условиях гипергликемии он может вступать в реакцию с оксидом азота с образованием больших концентраций пероксинитрита: О2 .- +NO→ONOO . Пероксинитрит, образующийся в концентрациях, заметно превышающих физиологические, способен уменьшать содержание тетрагидробиоптерина – кофактора конституциональной эндотелиоцитарной NO-синтазы, что, наряду с накоплением эндогенного ингибитора NO-синтазы – N-метил-D-аргинина приводит к снижению активности этого фермента. Важнейшим следствием таких событий является дисфункция эндотелия.
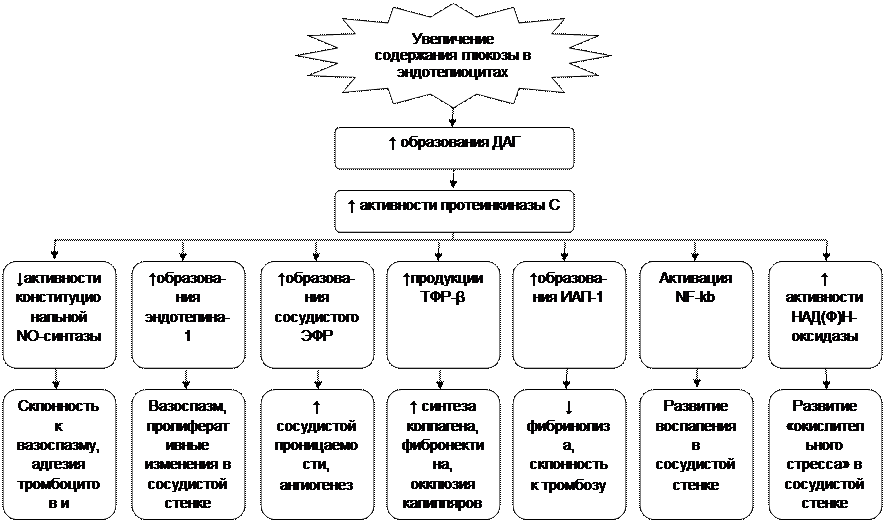
Рис. 15. Важнейшие следствия активации протеинкиназы С в эндотелиоцитах (в соответсвии с Koya D, Jirousek MR, Lin YW, et al. 1997, с дополнениями) Условные сокращения: ДАГ – диацилглицерол, ЭФР – эндотелиоцитарный фактор роста, ТФР - трансформирующий фактор роста-β, ИАП-1 – ингибитор активатора плазминогена-1 Снижение активности конституциональной изоформы NO-синтазы при сахарном диабете сочетается с повышением активности ее индуцированной изоформы, продуцирующей значительные количества оксида азота и пероксинитрита, что приводит к развитию «нитрозилирующего стресса» и повреждению клеток сосудистой стенки.
Роль нарушений ангиогенеза в механизмах
|
||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 362; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.196.141 (0.009 с.) |