
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Перехід газу з одного стану в інший при сталій температурі називають ізотермічним процесом.Содержание книги
Поиск на нашем сайте
Якщо маса газу не змінюється, то для цього процесу можна записати:
– У даному процесі температура не змінюється, тобто Т1 = Т2. Який зв’язок між іншими двома параметрами стану? ( Одержана формула виражає закон, встановлений дослідним шляхом в середині 19 століття англійським ученим Р.Бойлем і французьким фізиком Е.Маріоттом, тому цей закон має назву закону Бойля-Маріотта. Його можна сформулювати так: добуток тиску даної маси газу на його об’єм при сталій температурі є величина стала. Зверніть увагу на твердження "даної маси газу". Це означає, що тільки для процесу, в якому маса газу не змінюється і стала температура можна застосовувати закон Бойля-Маріотта. Наприклад, як відповісти на запитання: "Ви надули щоки. Збільшується і об’єм і тиск повітря, а температура стала. Як це узгодити із законом Бойля-Маріотта?" Отже, при сталій температурі, тобто при ізотермічному процесі, закон Бойля-Маріотта не виконується. І це природно, адже маса повітря збільшується. б) Як графічно зобразити залежність між тиском і об’ємом газу в ізотермічному процесі?
Цю криву називають ізотермою. Кожна точка кривої визначає тиск і об’єм газу при даній температурі, тобто стан газу. В ізотермічному процесі стан газу змінюється, відповідно на графіку точка, що визначає стан газу, рухається вздовж ізотерми. в) А який вигляд має ізотерма, якщо маса газу та сама, а температура вище? Запишемо рівняння Менделєєва-Клапейрона
У системах координат р,Т і V,T ізотерма має вигляд:
Таким чином, для ізотермічного процесу виконується закон Бойля-Маріотта, а на графіку цей процес зображується ізотермою 2. У другій частині задачі мова йде про процес у газі при сталому тиску. Який зв’язок між об’ємом і температурою? а) Перехід газу з одного стану в інший при сталому тиску називається ізобарним.
– Який зв’язок між об’ємом і температурою в ізобарному процесі? Чому?
Цей закон встановлений експериментально французьким фізиком Ж.Гей-Люссаком у 1892р. і названий на честь вченого законом Гей-Люссака. Він формулюється так: при незмінній масі газу і сталому тиску об’єм газу прямо пропорційний його абсолютній температурі. – Перепишемо останнє рівняння так:
– Як на графіку зображується лінійна залежність? (прямою лінією) – Зобразити цей графік в координатах V, T. – Як ви думаєте, чим відрізнятиметься графік ізобарного процесу, якщо тиск матиме більше значення? Чому? більшому р при даній Т відповідає менше значення V, отже кут нахилу буде меншим).
Зверніть увагу на е, як зображена ізобара біля абсолютного нуля.
– Зобразити ізобару в координатах р,Т і р,V. 3. У третій частині задачі мова йде про процес при сталому об’ємі. Який зв’язок між тиском і температурою у даному процесі? а) Такий процес має назву ізохорного. – Який зв’язок між тиском і температурою при ізохорному процесі? Чому?
– Яка залежність між тиском і температурою? (прямо пропорційна) Ця залежність між тиском і температурою була експериментально встановлена французьким ученим Ж.Шарлем і має назву закону Шарля. Формулюється закон так: Для даної маси газу при сталому об’ємі тиск газу прямо пропорційний його абсолютній температурі. – Як графічно зобразити залежність
(На графіку цей процес зображується ізохорою)
– Зобразити дві ізохори для даної маси газу при умові, що V2 > V1. Обґрунтуйте. (
– Зобразити ізохори в координатах V,T і р,Т.
Двадцять четверте лютого Класна робота Пароутворення і конденсація. Насичена і ненасичена пара. Вологість повітря. Методи вимірювання вологості повітря. Вміст водяної пари у повітрі називається вологістю повітря. У повітрі завжди є водяна пара, але вона не є насиченою. Переміщення повітряних мас призводить до того,що в одних місцях нашої планети випаровування переважає над конденсацією, в інших-навпаки.
Щоб дізнатися, скільки міститься у повітрі водяної пари, можна пропустити певний об’єм повітря через речовину, яка вбирає водяну пару, і знайти масу пари,яка знаходиться в 1 Величину, яка вимірюється кількістю водяної пари (в грамах), що міститься в 1 Практично виміряти кількість водяної пари в 1
Наскільки водяна пара, яка знаходиться в повітрі, близька до стану насичення, показує відносна вологість. Відносною вологістю повітря називають виражене у відсотках відношення абсолютної вологості до густини насиченої пари за даної температури Отже, відносна вологість повітря показує, який відсоток становить абсолютна вологість З рівняння Менделєєва-Клапейрона: р Тому в метеорології відносною вологістю називають величину, яка вимірюється відношенням тиску водяної пари,яка міститься в повітрі, до тиску водяної пари, яка насичує повітря за тієї самої температури. Величини
|
|||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-11; просмотров: 1055; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.132.253 (0.01 с.) |

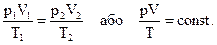
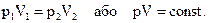 )
)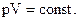 Отже залежність між тиском і об’ємом обернено пропорційна, а графік цієї залежності – гіпербола.
Отже залежність між тиском і об’ємом обернено пропорційна, а графік цієї залежності – гіпербола.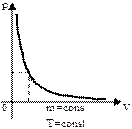
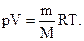 Звідси видно, що чим вище температура Т, тим більший добуток pV. Отже, ізотерма при більшій температурі для даної маси газу розміщується вище. Для даного V, р має більше значення.
Звідси видно, що чим вище температура Т, тим більший добуток pV. Отже, ізотерма при більшій температурі для даної маси газу розміщується вище. Для даного V, р має більше значення.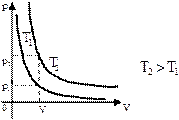
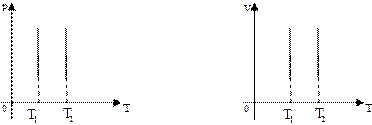 Ізотерми на цих графіках біля осі Т зображуються пунктиром, тому що при Т близькому до абсолютного нуля будь-який газ стає або рідиною, або твердим тілом.
Ізотерми на цих графіках біля осі Т зображуються пунктиром, тому що при Т близькому до абсолютного нуля будь-який газ стає або рідиною, або твердим тілом.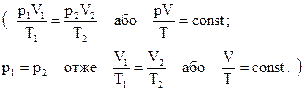
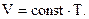 Яка це залежність між об’ємом і температурою? (лінійна)
Яка це залежність між об’ємом і температурою? (лінійна)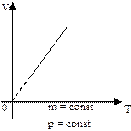
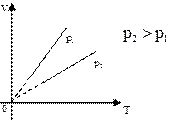
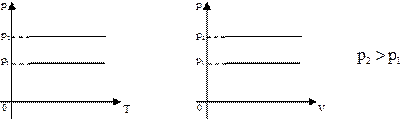
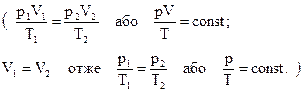
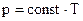 ?
?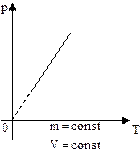
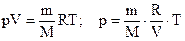 більшому V при даній Т відповідає менше значення р, отже кут нахилу буде меншим).
більшому V при даній Т відповідає менше значення р, отже кут нахилу буде меншим).
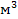 повітря.
повітря.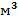 повітря, називають абсолютною вологістю повітря (позначають
повітря, називають абсолютною вологістю повітря (позначають 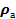 ).
).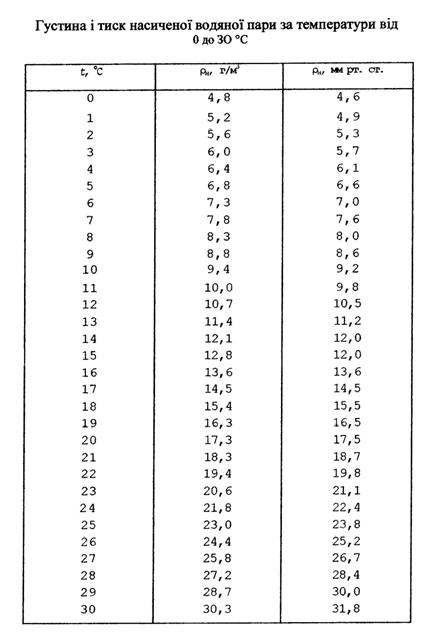 За абсолютною вологістю повітря чи парціальним тиском ще
За абсолютною вологістю повітря чи парціальним тиском ще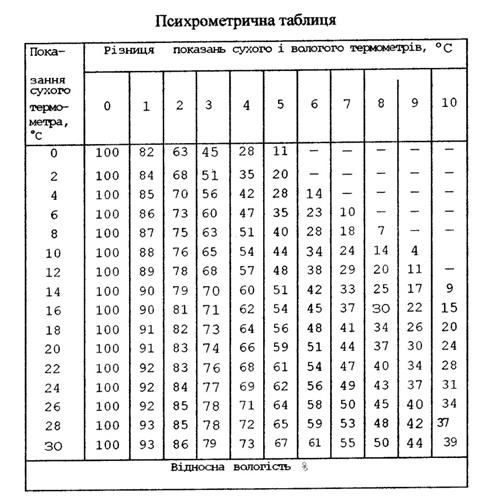 не можна встановити,наскільки воно сухе чи вологе. Якщо температура низька,то дана кількість водяної пари в повітрі може виявитися близькою до насичення, тобто повітря буде вологим. За вищої температури та сама кількість водяної пари далека від насичення і повітря сухе.
не можна встановити,наскільки воно сухе чи вологе. Якщо температура низька,то дана кількість водяної пари в повітрі може виявитися близькою до насичення, тобто повітря буде вологим. За вищої температури та сама кількість водяної пари далека від насичення і повітря сухе.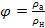 .100 %
.100 %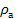 від густини водяної пари
від густини водяної пари 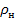 , яка насичує повітря за даної температури.
, яка насичує повітря за даної температури.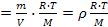 , тобто р
, тобто р 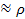 і
і 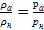 .
.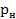 і
і 


