
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Перегляд відео сюжету «Дифузія».Содержание книги
Поиск на нашем сайте
Завдяки силам відштовхування молекули не проникають одна в одну. Хоч молекули електронейтральні, між ними на малих відстанях діють значні електричні сили, бо молекула - складна система, що складається з електронів і ядер атомів. Відбувається взаємодія між електронами і ядрами сусідніх молекул. Як визначити діаметр молекули? Об’єм 1 мм
Діаметр молекули води приблизно !!! Знайти кількість молекул у краплі води масою 1 г і об’ємом 1 см Об’єм однієї молекули води приблизно
Розміри атома: D = 10 Маса молекули води:
Десяте лютого Класна робота Властивості газів. Ідеальний газ. Тиск газу. Температура. Рівняння стану ідеального газу Властивості газів. 1. Газ завжди заповнює об'єм, обмежений непроникними для нього стінками. 2. Стисливість., летючість. 3. З підвищення температури швидкість руху молекул зростає. 4. З підвищенням температури збільшується об’єм. 5. Теплопровідність. 6. Електропровідність. В фізиці широко використовують моделі – ідеалізовані поняття. Для пояснення властивостей речовини в газоподібному стані використовується модель ідеального газу. Ідеальним газом називається такий газ, молекули якого ні при яких умовах не взаємодіють одна з одною і розмірами молекул можна знехтувати. Одним з перших і важливих успіхів молекулярно-кінетичної теорії було якісне і кількісне пояснення явища тиску газу на стінки посудини. Тиск газу на стінки посудини визначається ударами його молекул. Якісне пояснення тиску газу полягає в тому, що молекули ідеального газу при зіткненнях зі стінками посудини взаємодіють з ними за законами механіки як пружні тіла. При зіткненні молекули зі стінкою посудини проекція вектора швидкості на вісь ОХ, перпендикулярну стінці, змінює свій знак на протилежний, але залишається постійною за модулем
Це рівняння називається основним рівнянням МКТ газу. Також, тиск газу залежить від кількості молекул в одиниці об’єму –
р=nkT Якщо температуру зменшити, то і тиск газу зменшиться, оскільки зменшується швидкість руху молекул. Температура, при якій повинен припинитись поступальний рух молекул, називається абсолютним нулем. Шкала температур, в якій за початок відліку взята температура абсолютного нуля, називається термодинамічною шкалою температур (шкалою Кельвіна). Температура по цій шкалі називається термодинамічною і вимірюється у кельвінах.
Вісімнадцяте лютого Класна робота Газові закони для ізопроцесів. У розрідженого газу відстані між молекулами в багато разів перевищують їхні розміри, тому взаємодія між молекулами така мала, що нею можна знехтувати, і кінетична енергія молекул набагато більша за потенціальну енергію взаємодії. Ідеальний газ – це газ, взаємодія між молекулами якого така мала, що нею можна знехтувати. Об’єм і тиск – механічні величини, які описують стан газу. Температура характеризує внутрішній стан газу. Температура характеризує ступінь нагрітості тіла (холодне, тепле, гаряче). Тепловою рівновагою називають такий стан, коли всі макроскопічні параметри як завгодно довго лишаються незмінними. Молекула ідеального газу має кінетичну енергію:
Основне рівняння МКТ газів встановлює зв’язок між мікроскопічними величинами і макроскопічною величиною – тиском.
оскільки Рівняння, яке пов’язує три величини (p, V, T) називають рівнянням стану газу.
Добуток Рівняння стану газу:
Коли в газі, як це ми бачили у розв’язаних нами задачах, відбуваються будь-які процеси, то, як правило, змінюються всі три параметри стану газу – тиск, об’єм, температура. Природно, що найбільш простими є такі процеси, які відбуваються при зміні двох з цих параметрів, а третій залишається незмінним. Такі процеси називають ізопроцесами.
Розв’яжемо задачу:
2. Потім посудину нагрівають до 570С, змінюючи об’єм її так, щоб тиск газу залишався сталим. 3. Нарешті посудину охолоджують до початкової температури при сталому об’ємі газу. Визначити значення тиску, об’єму, температури в останньому стані газу. Що необхідно з’ясувати для вирішення цієї задачі? Ми бачимо, що газ послідовно переходить з одного стану в інший: при сталій температурі, при сталому тиску, при сталому об’ємі. Маса газу – повітря в посудині не змінюється. Отже, нам необхідно знайти усі параметри газу в кінці кожного процесу, враховуючи, що в кожному з цих процесів змінюються тільки два параметри, а третій залишається сталим. Тому нас цікавитиме зв’язок між двома параметрами, які змінюються в кожному ізопроцесі. Для того щоб встановити ці зв’язки між параметрами, які мають назву газових законів, мабуть треба виходити з наступного: якщо маса газу в процесі переходу його з одного стану в інший не змінюється, то незалежно від того які параметри стану газу змінюються, а які залишаються сталими, до двох станів можна записати рівняння Клапейрона:
1. В задачі, в першій її частині, газ переходить з одного стану в інший при сталій температурі. Який зв’язок між параметрами стану газу, що змінюються? а) Враховуючи, що один із параметрів стану – температура не змінюється, то мова йде про ізопроцес.
|
|||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-11; просмотров: 357; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.66.170 (0.011 с.) |

 олії розпливається на поверхні води і займає площу 0,6 м
олії розпливається на поверхні води і займає площу 0,6 м  .
.
 ;
;  ;
; 


 .
. см = 10
см = 10  м.
м.


 Молекул газу дуже багато, і удари їх об стінку слідують один за одним з дуже великою частотою. Середнє значення геометричної суми сил, що діють з боку окремих молекул при їх зіткненнях із стінкою посудини, і є силою тиску газу.
Молекул газу дуже багато, і удари їх об стінку слідують один за одним з дуже великою частотою. Середнє значення геометричної суми сил, що діють з боку окремих молекул при їх зіткненнях із стінкою посудини, і є силою тиску газу. На основі використання основних положень МКТ можна обчислити тиск газу, якщо відомі маса молекули m0 газу, середнє значення квадрату швидкості молекул і концентрація n молекул:
На основі використання основних положень МКТ можна обчислити тиск газу, якщо відомі маса молекули m0 газу, середнє значення квадрату швидкості молекул і концентрація n молекул: і від середньої кінетичної енергії поступального руху молекул -
і від середньої кінетичної енергії поступального руху молекул - 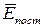 .
.

 , де. Т – абсолютна температура.
, де. Т – абсолютна температура.  - стала Больцмана.
- стала Больцмана.
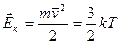 , k – стала Больцмана,
, k – стала Больцмана, 
 , або
, або  ;
;  ;
; 
 - основне рівняння МКТ газів,
- основне рівняння МКТ газів, - густина газу, то
- густина газу, то  .
.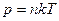 ;
;  ;
; 


 - універсальна газова стала.
- універсальна газова стала. , або
, або 
 - рівняння Клапейрона-Менделєєва.
- рівняння Клапейрона-Менделєєва. 1. У посудині, об’єм якої може змінюватися і спочатку дорівнює 1л при температурі 270С знаходиться повітря, тиск якого 105Па. Повільно, щоб не змінилася температура газу, зменшують об’єм вдвічі.
1. У посудині, об’єм якої може змінюватися і спочатку дорівнює 1л при температурі 270С знаходиться повітря, тиск якого 105Па. Повільно, щоб не змінилася температура газу, зменшують об’єм вдвічі.



