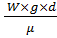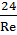Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методы разделения и концентрирования проб.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Использование разделения и концентрирования позволяет увеличить селективность и чувствительность метода. РАЗДЕЛЕНИЕ – операция, в которой компоненты исследуемой смеси отделяются друг от друга. КОНЦЕНТРИРОВАНИЕ– увеличение концентрации микрокомпонентов относительно основных компонентов пробы. Способы разделения: хим-е, физ-е, физ-хим. К хим. методам относ-ят методы образования нераств-х или малораств-х осадков с последующим отделением их от растворов. К физ.: различные гидромеханические процессы разделения и массообменные процессы разделения. Гидромех-е процессы: процессы отстаивания, фильтрования, центрифугирования, раздел. в поле эл. сил и др. Массообмен-е: перегонка, ректификация, процессы абсорбции, адсорбции, сублимации. К физ - хим. относ-ся экстракция, ионный обмен, хромотография и др. Отстаивание – разделение неоднородных систем под действием силы тяжести. 2 осн. вида гидродинам. движения частиц в жидкости: ламинарный и турбулентный. Экспериментально установлено, что ламинарный режим наблюдается при числах Рейнольдса < 2: Re = Свыше Re=500 наблюдается развитый турбулентный режим движения жидкости. Если Re > 2 и Re < 500, то движение частицы происходит в переходной области, причём коэффициент сопротивления для ламинарного режима равен: 𝛏 = Если режим переходный: 𝛏 = В развитом турбулентном режиме 𝛏 –> const. Фильтрование – процесс разделения неоднородных систем, содержащих твёрдую фазу (суспензии и запыленные газы), с помощью пористых перегородок, способных пропускать жидкость или газ и задерживать твёрдые частицы. Фаза – область вещества с одинаковым агрегатным состоянием и одинаковым качественным составом компонентов в любой её точке (количественный состав может меняться в пространстве и времени). По агрегатному состоянию выделяют следующие неоднородные системы: суспензии, запыленный газ, пена, газокапельная система, эмульсия (многофазовая система). Жидкая фаза, прошедшая пористую перегородку, - фильтрат, а тв. частицы, отложившиеся на перегородке, образуют слой осадка тв. частиц. Центрифугирование. При нём разделяют суспензии и эмульсии в поле центробежных сил. При вращении суспензии (эмульсии) в барабане центрифуги на каждую частичку суспензии действует центробежная сила инерции. При перегонке происходит взаимодействие жидкой фазы и паровой фазы, полученной при кипячении самой жидкости. При этом их жидкости в пар переходит низкокипящий компонент, а из пара в жидкость – высококипящий компонент. В промышленных условиях используют непростую перегонку, а ректификацию. Ректификация – многоступенчатое взаимодействие жидкой и паровой фаз в ректифик. колоннах на ступенях контакта, каждая из которых аналогична одному перегон. кубу. Жидкая фаза стекает вниз под действием силы тяжести и попадает в куб-испоритель, кипит. Образ. пары подним. вверх по колонне противотоком к жидкости. На контактных тарелках образуется поверхность взаимодействия фаз и происходит разделение компонентов по фазам. Теплота, кот. выдел-ся при конденсации, идёт на испарение низкокип-х компонентов. (Рисунок) Разделение смесей методом жидкостной экстракции основано на различной растворимости компонентов смесей в двухфазной жидк. сист., в кот., например, 1 фаза – вода, а 2 – нераствор-й или частично раствор-й в ней органический растворитель. При этом целевой компонент переходит из родной фазы в другую через активную поверхность из раздела. Хромотография она, как и экстракция основана на избирательном распределении вещества между жидкой фазой иногда газовой фазой и твёрдым пористым материалом. В ионообменных методах твёрдые поглотители, так называемые иониты, сорбируют ионы только одного знака заряда. В то время как ионы противоположного знака или нейтральные молекулы не сорбируются. Титриметрический анализ: титр, тированный раствор, титрование, точка эквивалентности. Требования к реакциям в титровании. Титриметрический анализ базируется на точном измерении количества реактива израсходованного на реакцию с определяемым веществом. ТИТР – способ выражения состава раствора. Он как правило показывает число граммов растворённого вещества в 1 мл раствора, т.е. титр является концентрацией. ТИТРОВАННЫЙ или СТАНДАРТНЫЙ раствор – раствор, концентрация которого известна с высокой точностью. ТИТРОВАНИЕ – прибавление титрованного раствора к анализируемому раствору для определения точного эквивалентного количества. Анализируемый раствор часто называют рабочим раствором или титрантом. Момент титрования, когда количество добавленного титранта химически эквивалентно количеству титруемого вещества называется ТОЧКОЙ ЭКВИВАЛЕНТНОСТИ. Требования к реакциям в титровании: 1. Реакция должна протекать количественно, т.е. константа равновесия реакции должна быть достаточно велика. Это означает, что реакция между определяемым веществом и реагентом должна протекать практически до конца в прямом направлении. 2. Реакция должна протекать с достаточно большой скоростью. 3. Реакция не должна осложняться протекание побочных реакций. 4. Должен существовать достаточно точный способ определения окончания реакции.
|
||||
|
Последнее изменение этой страницы: 2016-07-11; просмотров: 1162; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.242.169 (0.009 с.) |