
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Предмет и задачи курса миси. Принцип анализа. Метод анализа. Методика анализа.Содержание книги
Поиск на нашем сайте
Предмет и задачи курса МиСИ. Принцип анализа. Метод анализа. Методика анализа. Наука МиСИ изучает методы и способы исследования веществ и смесей веществ, материалов, предметов и различ. зделий как естественного, так и искусственного происхождения, с установлением их хим. и физ. состава, свойств, изменения свойств во времени и влияния на них различных условий. Эта наука изучает устройства, принципы действия, назначения, характеристики и область применения различных приборов, измерительных устройств, а также различные вещества и реактивы, применяемые исследователями. К методам анализа проводимым в МиСИ относятся: титриметрический анализ, электрохимические методы анализа, методы разделения и концентрирования. Эта дисциплина связана и базируется на таких науках как физика, химия, математика, она тграет важную рольв подготовке товароведов, особенно при проведении экспертизы продукции. Обработка результатов измерений, методы оценки точности измерений, анализа и методик. Экспериментальные исследования основаны на проведении ряда измерений и анализе полученных результатов, поэтому конечная точность исследований и возникшие при этом ошибки зависят как от точности самих измерений, так и от точности обработки полученных данных. Точность измерений зависит от точности измерительных приборов, а также от правильности техники проведения измерений. Точность анализа рез-ов определяется способом обработки данных, при этом учитываются: погрешности вычислений, а также статистически обрабатываются результаты измерений с послед. анализом. Погрешности измерений и анализа. Классификация ошибок. Измерение и анализ всегда сопровождаются ошибками или погрешностями. В расчетах пользуются понятиями абсол. и отсосит. погрешности. Абс.погрешность – это отклонение результата измерения от истинного значения измеряемой величины. ∆хi=xi-µ; xi – рез-т измерения, µ - истинное знач. величины. В большинстве случаев µ не известно поэтому абс. Погрешность не может быть точно определена и на практике используют предельную абс. Погрешность - ∆х, которая ∆х≥│∆хi│, тогда интервал в котором заключено точное значение величины: х-∆х≤µ≤х+∆х Абс. Погрешность не полностью характеризует отклонение величины от истинного значения µ1=10 µ2=1000 ∆x=1, поэтому используют понятие относительной погрешности для относительной ошибки, которая есть отношение ∆хi и истинного значения измеряемой величины: ε= Погрешности условно подразделяют на: систематические, случайные, грубые. Погр-ти существенно превышающие ожидаемые при данных условиях наз-ся грубыми или промахами. Одно или несколько значений отличающихся от основной массы по величине, вероятно образуют грубые ошибки, хотя не всегда(например это не так в условиях разрыва функциональной зависимости в критических точках. Грубые ошибки часто явл-ся следствием грубых погрешностей аналитика. Погр-ть измерения, которая при повторных измерениях остается постоянной или закономерно изменяется наз-ся систематической, при этом знак систем прогр-ти от опыта к опыту не измен-ся т.е. такая погр-ть или только занижает или только завыш результат. Ее источниками может быть: использование неколеброванных приборов. Для уменьщения систематич. ошибок в расчеты вводят поправки. Погр-ть которая при повтор. измерениях изменяются случайным образом наз-ся случайной. Знак такой погр-ти может изменяться от опыта к опыту. Титриметрический анализ: титр, тированный раствор, титрование, точка эквивалентности. Требования к реакциям в титровании. Титриметрический анализ базируется на точном измерении количества реактива израсходованного на реакцию с определяемым веществом. ТИТР – способ выражения состава раствора. Он как правило показывает число граммов растворённого вещества в 1 мл раствора, т.е. титр является концентрацией. ТИТРОВАННЫЙ или СТАНДАРТНЫЙ раствор – раствор, концентрация которого известна с высокой точностью. ТИТРОВАНИЕ – прибавление титрованного раствора к анализируемому раствору для определения точного эквивалентного количества. Анализируемый раствор часто называют рабочим раствором или титрантом. Момент титрования, когда количество добавленного титранта химически эквивалентно количеству титруемого вещества называется ТОЧКОЙ ЭКВИВАЛЕНТНОСТИ. Требования к реакциям в титровании: 1. Реакция должна протекать количественно, т.е. константа равновесия реакции должна быть достаточно велика. Это означает, что реакция между определяемым веществом и реагентом должна протекать практически до конца в прямом направлении. 2. Реакция должна протекать с достаточно большой скоростью. 3. Реакция не должна осложняться протекание побочных реакций. 4. Должен существовать достаточно точный способ определения окончания реакции. Кривые титрования и точка эквивалентности. Скачок титрования и точка конца титрования. Методы установления точки эквивалентности. Индикаторы, применяемые в титрометрии. 23. Типы и примеры реакций, используемых при титрометрическом анализе. Способы титрования: прямое титрование, обратное титрование, титрование по заместителю. Требования, предъявляемые к индикаторам. Погрешности титрования. Очень важным в титриметрии является правильный подбор индикатора. В большинстве случаев используются индикаторы изменяющие свою окраску при изменении pH. У правильно выбранных индикаторов интервал перехода окраски полностью или частично перекрывается скачком титрования. Если такого перехода нет, то данный индикатор для титрования не подходит. При кислотно-основном титровании широко используют такие классические индикаторы, как лакмус, метиловый оранжевый, метиловый красный, фенолфтолеин и др. Так, например, лакмус в кислой среде даёт красную окраску, а в щелочной – синюю. Фенолфтолеин в щелочной среде – ярко-малиновая окраска, а в нейтральной или кислой – бесцветная (но при очень большоя значении pH он опять становится бесцветным). Метиловый оранжевый в щелочной среде имеет желто-оранжевый цвет, а в кислой среде – оранжево-красный цвет. Для фиксирования точки стехиометричности по промежуточным оттенкам окраски индикатора вводят понятия ПОКАЗАТЕЛЬ ТИТРОВАНИЯ, соответствующий такому значению pH, при котором титрование заканчивается (соответствует конечной точке титрования). Погрешности титрования м.б. обусловлена тем, что pH индикаторы сами нередко имеют кислотно-основную природу, т.е. наличие индикатора несколько меняет pH раствора. Следовательно, с уменьшением количества индикатора эта ошибка уменьшается, а значит, при титровании рекомендуется обходиться минимальным количеством индикатора. Кроме того, при титровании с вводом титранта в раствор происходит постепенное разбавление раствора и количество воды в растворе будет увеличиваться из-за протекания реакции нейтрализации. Для случая титрования раствора соляной кислоты водным раствором NaOH: C (HCl)*V (HCl)=C (NaOH)*V(NaOH) Массу кислоты в исходном растворе: m(HCl)=C(HCl)*V(HCl)/1000*M(HCl)= C(NaOH)*V(NaOH)/1000*M(Cl) Относительная погрешность результатов титрования рассчитывается по формулам относительной погрешности произведения и частного:
Законы электролиза Согласно 2 закону Фарадея, масса в-ва m, выделяющаяся в разных электролитах при пропускании через р-р одинакового кол-ва электричества Q пропорционально их масс. эквивалентам. Э=М/Z (Э – масс. эквивалент; М – мол. масса в-ва; Z – кол-во электронов, отдав. или получ-х в-вом при эл-зе. m=I*t*(Э/F)=(Q*M)/(Z*F) (t – время протекания тока с силой I; F-число Фарадея, =96500 Кл. Э/F – электрохим. эквив-т). M/Z*F=const. Прямая кулонометрия. В этом методе определяемое в-во окисл. или восст. на одном из электродов, а побочные хим. реакции не протекают. Наиболее часто использ реакции: 1) восст-я катионов металла до свободного состояния (Ме (n+) + ne (-) → Me). Данным способом анализируют и смеси катионов, выделяя электролизом сначала более электроположит. катионы с < Е разл., а затем более электроотриц. с > Еразл. 2) Анодное окисление Ме, предварительно выделенных электролизом из р-ра (Ме – n*e(-) → Me (n+)) 3) электролитическое окисление или восстановление ионов в р-ре (Ме (n+) ± a*e (-) → Me (n±a)). Протекают без осаждения в-ва на эл-дах. Этот метод примен. для определения многих органических в-в. На практике примен. кулонометрию при постоянном потенциале и при пост. силе тока. Если электролиз проводят при постоянной силе тока, то количество электричества за время электролиза t, при постоянном токе I равно, так как интеграл постоянного тока по времени представляет собой произведение величины тока на отрезок времени. Предмет и задачи курса МиСИ. Принцип анализа. Метод анализа. Методика анализа. Наука МиСИ изучает методы и способы исследования веществ и смесей веществ, материалов, предметов и различ. зделий как естественного, так и искусственного происхождения, с установлением их хим. и физ. состава, свойств, изменения свойств во времени и влияния на них различных условий. Эта наука изучает устройства, принципы действия, назначения, характеристики и область применения различных приборов, измерительных устройств, а также различные вещества и реактивы, применяемые исследователями. К методам анализа проводимым в МиСИ относятся: титриметрический анализ, электрохимические методы анализа, методы разделения и концентрирования. Эта дисциплина связана и базируется на таких науках как физика, химия, математика, она тграет важную рольв подготовке товароведов, особенно при проведении экспертизы продукции.
|
||||
|
Последнее изменение этой страницы: 2016-07-11; просмотров: 184; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.247.17 (0.01 с.) |

 =∆хотн
=∆хотн
 – относительная погрешность при определении концентрации;
– относительная погрешность при определении концентрации; 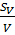 – относительная погрешность при определении объёма добавленного титранта;
– относительная погрешность при определении объёма добавленного титранта;  – относит.погрешность при определении молярной массы вещества.
– относит.погрешность при определении молярной массы вещества.


