
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Термическая обработка чугунов и сталейСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте 4.1. Основные понятия и определения Металлические материалы и сплавы имеют кристаллическое строение. Всего имеется семь разновидностей кристаллических решеток, та или иная форма решетки оказывает существенное влияние на физико-механические свойства металла. Полиморфизм – это способность металлов образовывать различные типы кристаллических решеток в зависимости от температуры и давления. При этом происходят изменения свойств металлов. Это явление широко используют в технике для улучшения обрабатываемости металлов, снятия остаточных напряжений, при термической обработке и в других процессах. Полиморфизмом обладает примерно половина всех металлов. Наибольшее число полиморфных модификаций: шесть – у плутония, четыре – у марганца. У семи металлов, в том числе урана, три модификации. Существует двадцать девять металлов, имеющих по две кристаллические модификации. В число диморфных металлов входят широко используемые железо, титан, олово (табл. 10). Полиморфизм железа сыграл выдающуюся роль в истории человеческой цивилизации: ведь именно благодаря ему сталь можно подвергать закалке, а широкое использование закаленной стали означало переход от бронзового века к железному. Полиморфные модификации обозначают греческими буквами α, β и т.д. по возрастанию температурного интервала их существования (например, α –Fе и α –Ti).
Таблица 10. Металлы с полиморфным превращением
Эти типы кристаллических решеток представлены на рис. 13.
Рис. 13. Типы элементарных ячеек кристаллических решеток металлов и схемы упаковки в них атомов: а – гранецентрированная кубическая; б – объемно центрированная кубическая; в – гексагональная плотноупакованная решетка
Система – группа тел, выделяемых для наблюдения и изучения. Принято системами называть металлы и металлические сплавы. В технике практически повсеместно используются не чистые металлы, а сплавы. Компоненты – вещества, образующие систему. В качестве компонентов выступают чистые вещества и химические соединения, если они не диссоциируют на составные части в исследуемом интервале температур. Сплав – твердый раствор нескольких металлов. Чистый металл является простой однокомпонентной системой, сплав – сложной системой, состоящей из двух и более компонентов. Строение металлического сплава зависит от того, в какое взаимодействие вступают компоненты А и В, составляющие сплав. Почти все металлы в жидком состоянии растворяются друг в друге в любых соотношениях. При образовании сплавов в процессе их затвердевании возможно различное взаимодействие компонентов. Фаза – однородная часть сплава, отделенная от других частей поверхностью раздела. Фаза может быть жидкой или твердой, но обязательно однородной по химическому составу и свойствам. Растворы после кристаллизации существуют в следующих формах – механическая смесь, химическое соединение, твердый раствор. Механическая смесь образуется, когда компоненты не способны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соединения. Это означает, что компоненты значительно различаются по строению и свойствам. В таких сплавах сохраняются кристаллические решетки компонентов (рис. 14).
Рис. 14. Схема микроструктуры механической смеси Химическое соединение – индивидуальное вещество, в котором атомы одного или различных элементов соединены между собой химической связью. В сплавах химические соединения образуются между элементами, значительно различающимися по строению и свойствам. При этом сила взаимодействия между разнородными атомами больше, чем между однородными. Особенности этих сплавов следующие: - постоянство состава, то есть сплав образуется при определенном соотношении компонентов; - образуется специфическая, отличающаяся от решеток элементов, составляющих химическое соединение, кристаллическая решетка с правильным упорядоченным расположением атомов (рис. 15);
Рис. 15. Кристаллическая решетка химического соединения - ярко выраженные индивидуальные свойства; - постоянство температуры кристаллизации, как у чистых компонентов. Твердые растворы – сплавы, в которых соотношения между компонентами могут изменяться. Являются кристаллическими веществами. Характерной особенностью твердых растворов является наличие в их кристаллической решетке разнородных атомов при сохранении типа решетки растворителя. Твердый раствор состоит из однородных зерен (рис. 16).
Рис. 16. Схема микроструктуры твердого раствора
По степеням растворимости компонентов различают твердые растворы с неограниченной и ограниченной растворимостью компонентов. При неограниченной растворимости компонентов кристаллическая решетка растворителя по мере увеличения концентрации растворенного компонента плавно переходит в его кристаллическую решетку. Для образования растворов с неограниченной растворимостью должны выполняться следующие условия: - изоморфность (однотипность) кристаллических решеток компонентов; - близость атомных радиусов компонентов, которые не должны отличаться более чем на 8-13 %; - близость физико-химических свойств, подобных по строению валентных оболочек атомов. При ограниченной растворимости компонентов возможна концентрация растворенного вещества до определенного предела. При дальнейшем увеличении концентрации однородный твердый раствор распадается с образованием двухфазной смеси. По характеру распределения атомов растворенного вещества в кристаллической решетке растворителя различают твердые растворы замещения, внедрения и вычитания. В твердых растворах замещения в кристаллической решетке растворителя часть его атомов замещена атомами растворенного элемента (рис. 17, а). Замещение осуществляется в случайных местах, поэтому такие растворы называют неупорядоченными твердыми растворами.
а) б)
Рис. 17. Кристаллическая решетка твердых растворов: Растворы замещения (а) и внедрения (б); А и В – компоненты раствора
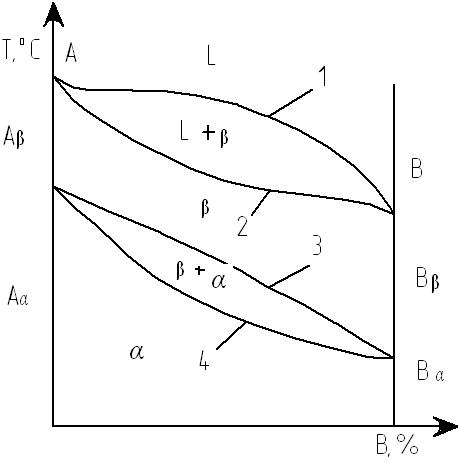
При образовании растворов замещения периоды решетки изменяются в зависимости от разности атомных диаметров растворенного элемента и растворителя. Если атом растворенного элемента больше атома растворителя, то элементарные ячейки увеличиваются, если меньше – сокращаются. В первом приближении это изменение пропорционально концентрации растворенного компонента. Изменение параметров решетки при образовании твердых растворов – важный момент, определяющий изменение свойств. Уменьшение параметра ведет к большему упрочнению, чем его увеличение. Твердые растворы внедрения (см. рис. 17, б) образуются внедрением атомов растворенного компонента в поры кристаллической решетки растворителя. Образование таких растворов, возможно, если атомы растворенного элемента имеют малые размеры. Таковыми являются элементы, находящиеся в начале периодической системы Менделеева: углерод, водород, азот, бор. Размеры атомов превышают размеры межатомных промежутков в кристаллической решетке металла, это вызывает искажение решетки и в ней возникают напряжения. Массовая доля растворенного компонента в таких растворах не превышает 2-2,5 %. Твердые растворы вычитания или растворы с дефектной решеткой образуются на базе химических соединений, при этом возможна не только замена одних атомов в узлах кристаллической решетки другими, но и образование пустых, не занятых атомами, узлов в решетке. К химическому соединению добавляют, один из входящих в формулу элементов, его атомы занимают нормальное положение в решетке соединения, а места атомов другого элемента остаются незанятыми. Переход металла или сплава из жидкого состояния в твердое называется кристаллизацией. Диаграмма состояния представляет собой графическое изображение состояния любого сплава изучаемой системы в зависимости от массовой доли растворенного компонента и температуры (рис. 18).
Рис. 18. Диаграмма состояния
Диаграмма состояния показывает устойчивое состояние, которое при данных условиях обладает минимумом свободной энергии. Поэтому такую диаграмму называют диаграммой равновесия: она показывает, какие равновесные фазы существуют при данных условиях. Построение диаграмм состояния наиболее часто осуществляется при помощи термического анализа. В результате получают серию кривых охлаждения, на которых при температурах фазовых превращений наблюдаются точки перегиба и температурные остановки. Температуры, соответствующие фазовым превращениям, называют критическими точками. Некоторые критические точки имеют названия, например, точки отвечающие началу кристаллизации называют точками ликвидус, а концу кристаллизации – точками солидус. По кривым охлаждения строят диаграмму состава в координатах: по оси абсцисс – массовая доля компонентов, по оси ординат – температура. Шкала массовой доли показывает содержание компонента В. Основными линиями являются линии ликвидус (1) и солидус (2), а также линии. соответствующие фазовым превращениям в твердом состоянии (3, 4). По диаграмме состояния можно определить температуры фазовых превращений, изменение фазового состава, свойства сплава, виды обработки, которые можно применять для сплава. Железо – серебристый металл с плотностью 7,86 г/см3 и температурой плавления 1539 °С. Имеет низкую твердость (80 НВ) и прочность sВ = 250 МПа, но высокую пластичность δ = 50 %. В твердом состоянии железо находится в двух модификациях: α-железо, существующее при температуре от 1539 до 1400 и ниже 910 °С, и γ-железо в интервале температур 910-1392 °С. Плотность γ-железа выше 8 г/см3. Разница между этими модификациями заключается в строении кристаллической решетки: для α–железа это объемно центрированный куб, а для γ-железа – гранецентрированный куб. В чистом виде железо не применяется и практически не встречается. Углерод – неметаллический элемент с плотностью 2,25 г/см3 и температурой плавления 3500 °С. В сплавах с железом углерод обычно существует в виде графита со сложной решёткой. Железо с углеродом образует следующие соединения: - цементит (карбид железа) – химическое соединение Fe3Cс массовой долей углерода 6,67 %, неустойчивое при высоких температурах. Твердость цементита очень высока (70 HRC), он имеет большое сопротивление деформации, но низкую пластичность. - феррит – твердый раствор внедрения углерода в α -железо с минимальной массовой долей углерода: 0,02 % при 727 °С и 0,06 % при нормальной температуре. - аустенит – твердый раствор внедрения углерода в γ-железо с максимальной массовой долей углерода: 2,14 % при 1147°С и 0,8 % при 727 °С. При температуре ниже 727 °С аустенит или превращается в феррит при низком содержании углерода или распадается на цементит и феррит, образуя перлит, при высоком содержании углерода. Графит – свободно выделившийся углерод, наблюдаемый в сплавах с массовой долей углерода более 2 % (чугунах). Имеет слоистое строение и низкую твердость. Перлит – эвтектоид, состоящий из двух фаз: феррита и цементита. Эвтектоид – сплав, который кристаллизуется при постоянной температуре, самой низкой из возможных для этой системы. Перлит кристаллизуется при температуре 727 °С и ниже в результате разложения аустенита на феррит и цементит. Массовая доля углерода в нём постоянна и равна 0,8 %. Все сплавы, с массовой долей углерода до 0,8 %, называются доэвтектоидными сталями. Их структура состоит из феррита и перлита. Сплав железа с массовой долей углерода 0,8 % называется эвтектоидной сталью и имеет перлитную структуру. Сплав с массовой долей углерода от 0,8 до 2,14 % называется заэвтектоидной сталью со структурой из перлита и цементита. Все эти структуры изображены на рис. 19-21.
Рис. 19. Микроструктура сплавов: а – доэвтектоидного, б – эвтектоидного, в – заэвтектоидного
Рис. 20. Микроструктуры сталей:
а – доэвтектоидная сталь (Ф+П); б – эвтектоидная сталь (пластинчатый перлит); в – эвтектоидная сталь (зернистый перлит); г – заэвтектоидная сталь (П+Ц2)
Переход сплавов из жидкого состояния в твердое и обратно принято изображать графически в виде диаграммы состояния сплавов. Диаграмма состояния «железо – углерод» дает основное представление о строении железоуглеродистых сплавов: сталей и чугунов.
Рис. 21. Микроструктуры белых чугунов: а – доэвтектический белый чугун (П+Л+Ц2); б – эвтектический белый чугун (Л); в – заэвтектический белый чугун (Л+Ц1)
Начало изучению диаграммы состояния «железо–углерод» положил русский ученый Чернов Д.К. в 1868 году. Он впервые указал насуществование в стали критических точек и зависимость их положения от содержания углерода. Диаграмма состояния «железо–углерод» должна распространяться от железа до углерода. Железо образует с углеродом химическое соединение: цементит Fe3C. Каждое устойчивое химическое соединение можно рассматривать как компонент, а диаграмму – по частям. Так как на практике применяют металлические сплавы с массовой долей углерода до 5 %, то рассматриваем часть диаграммы состояния от железа до химического соединения - цементита с массовой долей углерода 6,67 %. Фрагмент диаграммы состояния «железо–углерод» (стальной угол) приведен на рис. 22. Линия АВСD– ликвидус системы. На участке АВначинается кристаллизация феррита (δ), на участке ВСначинается кристаллизация аустенита, на участке СD – кристаллизация цементита первичного. Линия AHJECF – линия солидус. На участке АН заканчивается металлизация феррита (δ). На линии HJB при постоянной температуре 1499 oС идет перетектическое превращение, заключающееся в том, что жидкая фаза реагирует с ранее образовавшимися кристаллами феррита (δ), в результате чего бразуется аустенит:
L +Ф(δ) → A (9)
На участке JЕ заканчивается кристаллизация аустенита. На участке ECF при постоянной температуре 1147 oС идет эвтектическое превращение, заключающееся в том, что жидкость,с массовой долей углерода 4,3 %, превращается в эвтектическую смесь аустенита и цементита первичного:
L → эвт (А + Ц1) (10)
Эвтектика системы «железо – цементит» называется ледебуритом (Л) (по имени немецкого ученого Ледебура) и содержит 4,3 % (по массе) углерода. При температуре ниже 727 oС в состав ледебурита входят цементит первичный и перлит, его называют ледебурит превращенный (ЛП). По линии HN начинается превращение феррита (δ) в аустенит, обусловленное полиморфным превращением железа. По линии NJ превращение феррита (δ) в аустенит заканчивается. По линии GS происходит переход аустенита в феррит, обусловленное полиморфным превращением железа. По линии PG превращение аустенита в феррит заканчивается. По линии ES начинается выделение цементита вторичного из аустенита, обусловленное снижением растворимости углерода в аустените при понижении температуры. По линии МО при постоянной температуре 768 oС имеют место магнитные превращения.
По линии PSK при постоянной температуре 727 oС идет эвтектоидное превращение, заключающееся в том, что аустенит, с массовой долей углерода 0,8 %, превращается в эвтектоидную смесь феррита и цементита вторичного: А0,83 → эвт (Ф + Ц2) (11)
По механизму данное превращение подобно эвтектическому, но протекает в твердом состоянии. Эвтектоид системы «железо – цементит» называется перлитом (П) и содержит 0,8 % (по массе) углерода. Название получил за то, что на полированном и протравленном шлифе наблюдается перламутровый блеск. Перлит может существовать в зернистой и пластинчатой форме в зависимости от условий образования. По линии PQ начинается выделение цементита третичного из феррита, обусловленное снижением растворимости углерода в феррите при понижении температуры. Температуры, при которых происходят фазовые и структурные превращения в сплавах системы «железо – цементит», т.е. критические точки, имеют условные обозначения. Они обозначаются буквой А (от французского arret – остановка): А1 – линия PSK (727 °С) – превращение П A2 – линия MO (768 °С) – магнитные превращения; A3 – линия GOS (переменная температура, зависящая от содержания углерода в сплаве) – превращение Ф A4 – линия NJ (переменная температура, зависящая от содержания углерода в сплаве) – превращение А ↔ Ф(δ); Acm – линия SE (переменная температура, зависящая от содержания углерода в сплаве) – начало выделения цементита вторичного (иногда обозначается A3). Так как при нагреве и охлаждении фазовые превращения происходят при различных температурах, для разделения этих процессов вводятся дополнительные обозначения. При нагреве добавляют букву «с», т.е Ас1, при охлаждении – букву «r», т.е. Аr1. В результате превращения углерод может не только химически взаимодействовать с железом, но и выделяться в элементарном состоянии в форме графита. Жидкая фаза, аустенит и феррит могут находиться в равновесии и с графитом. При высоких температурах цементит разлагается с выделением графита, поэтому диаграмма состояния «железо–цементит» является метастабильной, а диаграмма «железо–графит» – стабильной. Процесс образования графита в сплавах железа с углеродом называетсяграфитизацией. 4.2. Термическая обработка углеродистых сталей
Свойства сплава зависят от его структуры. Основным способом, позволяющим изменять структуру, а следовательно, и свойства является термическая обработка. Основными видами термической обработки углеродистых сталей являются: отжиг, нормализации и закалка с отпуском. Термическая обработка представляет собой совокупность операций нагрева, выдержки и охлаждения, выполняемых в определенной последовательности при определенных режимах, с целью изменения внутреннего строения сплава и получения нужных свойств. Любая разновидность термической обработки состоит из комбинации четырех основных превращений, в основе которых лежит стремление системы к минимуму свободной энергии. Режимы термической обработки назначают в соответствии с диаграммой состояния и диаграммой изотермического распада аустенита. Нагрев может осуществляться в нагревательных топливных или электрических печах, в соляных ваннах или ваннах с расплавленным металлом. С точки зрения повышения производительности термической операции, ее надо проводить с максимальной скоростью нагрева. Кроме того, быстрый нагрев уменьшает образование окалины, замедляет обезуглероживание и рост аустенитного зерна. Однако необходимо учитывать, что перепад температур по сечению ведет к возникновению термических напряжений. Если растягивающие напряжения превысят предел прочности или предел текучести, то возможно коробление заготовки или образование трещин. Отжиг – подготовительная термическая обработка отливок и поковок, производимая с целями: 1) измельчение зерна и уменьшение структурной неоднородности; 2) снятие внутренних напряжений; 3) повышение пластичности; 4) улучшение обрабатываемости резанием (снижение твердости). В зависимости от температуры нагрева различают следующие виды отжига. Полный отжиг применяется для доэвтектоидных и заэвтектоидных сталей. Он заключается в нагреве стали на 30-50 °С выше линии GS (см. рис. 22), выдержки при этой температуре и медленном охлаждении. Подлежащие отжигу заготовки загружаются в печь, разогретую до рабочей температуры. Время выдержки при этой температуре зависит от химического состава стали, формы и размеров заготовки. Ориентировочно время нагрева и выдержки определяется как 0,5-1,0 ч на каждые 25 мм диаметра или минимальной ширины заготовки. Скорость охлаждения при отжиге должна быть такова, чтобы обеспечить распад аустенита и превращение его в перлит. Для этого легированные стали охлаждают со скоростью 70-100 °С/ч, а углеродистые – со скоростью 150-200 °С/ч. После распада аустенита, то есть от температур порядка 600-500 °С охлаждение можно проводить не в печи, а на воздухе (для снижения энергозатрат). В результате полного отжига доэвтектоидные стали приобретают мелкую ферритно-перлитную, а заэвтектоидные – перлитную структуры. Неполный отжиг применяют для заэвтектоидных сталей. Он заключается в нагреве стали на 10-30 °С выше линии PSK, выдержке при этой температуре и медленном охлаждении в печи со скоростью 20-60 °С/ч до температуры 650-700 °С. Дальнейшее охлаждение ведется на воздухе. В результате неполного отжига заэвтектоидные стали приобретают структуру зернистого перлита. При закалке стали с такой структурой менее склонны к образованию трещин и деформации. Нормализация (нормализованный отжиг) проводится с целью: - устранения крупнозернистой структуры (то есть для измельчения зерна) заготовок после литья, ковки, штамповки и прокатки; - улучшения обрабатываемости резанием; - подготовки структуры металла к последующей окончательной термообработке: закалке и отпуску; - иногда и как окончательная термообработка, формирующая структуру и свойства стали. При нормализации детали нагревают на 50 ° Свыше линии GS (для доэвтектоидных) или линии SE (для заэвтектоидных) сталей, непродолжительное время (несколько минут) выдерживают при этой температуре и охлаждают на спокойном воздухе. В результате формируется мелкодисперсная структура перлита, что повышает прочность и твердость стали по сравнению с отожженной. Нормализация более экономична по сравнению с отжигом, поскольку время выдержки меньше и охлаждение ведется на воздухе, а не в печи. Закалка – термическая обработка, направленная на получение требуемой твёрдости конструкционного материала. Для сталей в зависимости от температуры нагрева различают полную и неполную закалку. Полная закалка заключается в нагреве доэвтектоидной стали на 30-50 °С выше линии GS, выдержке при этой температуре и быстром охлаждении. Нагрев под закалку проводят в печах различной конструкции: с электрическим или газовым обогревом в расплавах свинца, стекла и солей; в муфельных печах; в установках с индукционным нагревом токами высокой частоты (ТВЧ) или лазерными лучами, а также другими способами. Время выдержки в печи определяется так же, как и при отжиге. Быстрое охлаждение достигается использованием охлаждающих сред: воды, растворов солей и щелочей, минеральных масел. При прогреве заготовки по всему сечению получается объёмная закалка, в результате которой структура и твердость материала по всему сечению изделия получаются одинаковыми. Структура стали после полной закалки состоит из мелкоигольчатого мартенсита и небольшого количества остаточного аустенита. Мартенсит – твердый раствор углерода в α-железе. Мартенсит имеет структуру, состоящую из очень мелких пластин – игол. Мартенсит образуется из аустенита в результате его быстрого охлаждения. Он обладает высокой твердостью (55…65HRC). Сталь, закалённая на мартенсит, находится в сильно напряжённом состоянии, отличается высокой хрупкостью и поэтому не пригодна для практического использования. Неполная закалка применяется для заэвтектоидных сталей и заключается в нагреве стали до температуры на 35-60 °С выше линии PSK и последующем резком охлаждении. Окончательно структура и свойства стали формируется в процессе отпуска. Отпуск – окончательная операция термообработки закаленных на Цель отпуска – уменьшение внутренних напряжений и снижение хрупкости закаленной стали. Механические свойства закаленной и отпущенной стали связаны с её твердостью. Поэтому в качестве режима отпуска задается требуемая твердость. Нужную твердость можно получить, варьируя температуру и время отпуска. Время отпуска обычно не превышает 1,5-3 часов. Зная состав стали, требуемую твердость и задав время отпуска по специальным таблицам, определяют его температуру. Различают три вида отпуска. Низкий отпуск (120-250 °С) применяют для изделий, от которых требуется высокая твердость и износостойкость (например, режущий и измерительный инструмент). Цель – уменьшение остаточных напряжений после закалки. Структура стали – мартенсит отпуска и остаточный аустенит. Средний отпуск (350-450 °С) проводится при необходимости сочетания высокой прочности с упругостью и достаточной вязкостью материала изделий (рессоры, торсионы, пружины). Структура стали – троостит отпуска. Высокий отпуск (450-680 °С) широко применяют для изделий, которые должны обладать и достаточной прочностью, и хорошей сопротивляемостью ударным нагрузкам (валы, шатуны и так далее). Структура стали – сорбит отпуска. В машиностроении часто требуется получитьизделие, вязкое внутри, но твёрдое и износостойкое снаружи. Для этого используют высокочастотные индукторы, обеспечивающие прогрев детали на заданную, обычно небольшую (до 1-1,5 мм) глубину. Толщина закаленного слоя при поверхностной закалке определяется глубиной нагрева. Закалка ТВЧ называется поверхностной. Поверхностная закалка проводится с целью упрочнения поверхности стальной детали.В результате такой закалки увеличивается твердость поверхностного слоя детали с одновременным повышением сопротивления истиранию и предела выносливости. Общим для всех видов поверхностной закалки является нагрев поверхностного слоя детали до температуры закалки с последующим быстрым охлаждением. Различие заключается в методах нагрева деталей. Наибольшее распространение имеют электротермическая закалка с нагревом изделий токами высокой частоты и газопламенная закалка с нагревом газово-кислородным или кислородно-керосиновым пламенем. Структура поверхностного слоя после закалки состоит из мартенсита, мартенсита и феррита. Глубина закаленного слоя может достигать 2-4 мм, твердость 50…56 HRC. Метод применяется для закалки крупных изделий, имеющих сложную поверхность (коленчатые валы, косозубые шестерни, червяки), для закалки стальных и чугунных прокатных валков. Используется как в массовом, так и в единичном производстве, а также при ремонтных работах. При нагреве крупных изделий горелки и охлаждающие устройства перемещаются вдоль изделия, а мелких деталей – наоборот. Недостаток метода – невысокая производительность и сложность регулирования глубины закаленного слоя и температуры нагрева (возможность перегрева). Закалка токами высокой частоты основана на том, что если в переменное магнитное поле, создаваемое проводником-индуктором, поместить металлическую деталь, то в ней будут индуцироваться вихревые токи, вызывающие нагрев металла. Чем больше частота тока, тем тоньше получается закаленный слой. Обычно используются машинные генераторы с частотой 50-15000 Гц и генераторы с частотой больше 106 Гц. Глубина закаленного слоя – до 2 мм. Индукторы изготавливаются из медных трубок, внутри которых циркулирует вода, благодаря чему они не нагреваются. Форма индуктора соответствует внешней форме изделия, при этом необходимо соблюдать постоянство зазора между индуктором и поверхностью изделия. Схема технологического процесса закалки ТВЧ представлена на рис. 23.
Рис. 23. Схема технологического процесса закалки ТВЧ
После нагрева в течение 3-5 секунд деталь 1 быстро перемещается из индуктора 2 в специальное охлаждающее устройство – спрейер 3, через отверстия которого на нагретую поверхность разбрызгивается закалочная жидкость. Высокая скорость нагрева смещает фазовые превращения в область более высоких температур. Температура закалки при нагреве ТВЧ должна быть выше, чем при обычном нагреве. При правильных режимах нагрева после охлаждения получается структура мелкоигольчатого мартенсита. Твердость повышается на 2-4 единицы по шкале HRC по сравнению с обычной закалкой, возрастает износостойкость и предел выносливости. Перед закалкой ТВЧ изделие подвергают нормализации, а после закалки низкому отпуску при температуре 150-200 oС (самоотпуск). Наиболее целесообразно использовать закалку ТВЧ для изделий из сталей с массовой долей углерода более 0,4 %. Преимущества метода: - большая экономичность, нет необходимости нагревать все изделие; - обеспечение более высоких механических свойств материала; - отсутствие обезуглероживания и окисления поверхности детали; - снижение брака по короблению и образованию закалочных трещин; - возможность автоматизации процесса; - использование закалки ТВЧ позволяет заменить легированные стали на более дешевые углеродистые без ухудшения механических свойств; - возможность проводить закалку лишь отдельных участков детали. Основной недостаток метода – высокая стоимость индукционных установок и индукторов, поэтому его целесообразно использовать в серийном и массовом производстве. Также к процессам термической обработки относится старение, которое проводится для ответственных деталей требующих высокую стабильность формы в процессе эксплуатации, в основном – конструктивных элементов станочного оборудования.Старение применяется к материалам, подвергнутым закалке без полиморфного превращения. Закалка без полиморфного превращения – термическая обработка, фиксирующая при более низкой температуре состояние, свойственное сплаву при более высоких температурах (пересыщенный твердый раствор). Старение – термическая обработка, при которой главным процессом является распад пересыщенного твердого раствора. В результате старения происходит изменение свойств закаленных сплавов. В отличие от отпуска, после старения увеличиваются прочность и твердость и уменьшается пластичность. Старение сплавов связано с переменной растворимостью избыточной фазы, а упрочнение при старении происходит в результате дисперсионных выделений при распаде пересыщенного твердого раствора и возникающих при этом внутренних напряжений. В стареющих сплавах выделения из твердых растворов встречаются в следующих основных формах: тонкопластинчатой (дискообразной), равноосной (сферической или кубической), игольчатой. Форма выделений определяется конкурирующими факторами: поверхностной энергией и энергией упругой деформации, стремящимися к минимуму. Поверхностная энергия минимальна для равноосных выделений. Энергия упругих искажений минимальна для выделений в виде тонких пластин. Основное назначение старения – повышение прочности и стабилизация свойств. Различают старение естественное, искусственное и после пластической деформации. Естественное старение – самопроизвольное повышение прочности и уменьшение пластичности закаленной детали, происходящее в процессе его выдержки при нормальной температуре. Нагрев сплава увеличивает подвижность атомов, что ускоряет процесс. Искусственное старение – повышение прочности в процессе выдержки детали при повышенных температурах. Предел прочности, предел текучести и твердость стали с увеличением продолжительности старения возрастают, достигают максимума и затем снижаются (явление перестаривания) При естественном старении перестаривания не происходит. С повышением температуры стадия перестаривания достигается раньше. Деформационное старение – деталь из закаленной стали, имеющей структуру пересыщенного твердого раствора, подвергается пластической деформации, при этом протекают процессы старения. Старение охватывает все процессы, происходящие в пересыщенном твердом растворе: процессы, подготавливающие выделение, и сами процессы выделения. Для практики большое значение имеет инкубационный период – время, в течение которого в закаленном материале совершаются подготовительные процессы, когда сохраняется высокая пластичность. Это позволяет проводить холодную деформацию после закалки. Если при старении происходят только процессы выделения, то явление называется дисперсионным твердением. После старения повышается прочность и снижается пластичность низкоуглеродистых сталей в результате дисперсных выделений в феррите цементита третичного и нитридов. Старение является основным способом упрочнения алюминиевых и медных сплавов, а также многих жаропрочных сплавов. Обработка стали холодом. Высокоуглеродистые и многие легированные стали имеют температуру конца мартенситного превращения (Мк) ниже 0 oС. Поэтому в структуре стали после закалки наблюдается значительное количество остаточного аустенита, который снижает твердость изделия, а также ухудшает магнитные характеристики. Для устранения аустенита остаточного проводят дополнительное охлаждение детали в области отрицательных температур, до температуры ниже температуры превращения Мк (минус 80 oС). Обычно для этого используют сухой лед. Такая обработка называется обработкой стали холодом. Обработку холодом необходимо проводить сразу после закалки, чтобы не допустить стабилизации аустенита. Увеличение твердости после обработки холодом обычно составляет от 1 до 4 единиц по шкале HRC. После обработки холодом сталь подвергают низкому отпуску, так как обработка холодом не снижает внутренних напряжений. Обработке холодом подвергают детали шарикоподшипников, точных механизмов, измерительные инструменты.
4.3. Термическая обработка чугунов
Отжиг чугуна проводят для снятия внутренних напряжений в отливках. При этом в чугуне происходят структурные превращения улучщающие обрабатываемость, а внутренние напряжения перераспределяются и частично снимаются, что предотвращает последующую деформацию отливок при их механической обработке и в процессе эксплуатации. Технологические ре
|
|||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-19; просмотров: 775; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.62 (0.02 с.) |










 А;
А;



