
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Типы межатомных связей в твердых телах. Строение и свойства кристаллических тел с различными межатомными связями.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Типы межатомных связей в твердых телах. Строение и свойства кристаллических тел с различными межатомными связями. Ионная связь – присуща химическим соединениям, образованным элементами с резко различающейся валентностью. Так металлы, имея 1 или 2 электрона на внешней орбите, которые не прочно связаны с ядром, вступая в реакцию с неметаллами, металлы отдают электроны и превращаются в ионы. Неметаллы принимают эти электроны, превращаясь в отрицательные ионы => ионная связь обеспечивает электро – статическое притяжение. Кристаллографические обозначения атомных плоскостей и направлений. Под кристаллографическими плоскостями понимается 3 целых взаимно простых числа обратно пропорциональных числу осевых единиц, отсекаемых данной плоскостью по координатным осям x,y,z. ABCD (100), AFKB (001), BKLD (010) Под индексами кристаллографических плоскостей и направлений было вызвано потребностью объяснить зависимость свойств металлов от направлений кристаллографических плоскостей. Иными словами, дать объяснение с точки зрения техники понятие влияния анизотропии. По различным направлениям в кристалле располагаются различные количества атомов: физические, химические, механические при прочих равных условиях и определяются числом атомов, расположенным в данном направлении; чем больше количество атомов расположено в данном направлении, тем выше уровень свойств. Неодинаковость свойств по различным направлениям в кристалле и называется анизотропией. Любой кристалл – анизотропен. Однако, поскольку реальные металлы состоят из большого числа зерен (на 1 см2 – десятки тыс. зерен) создается впечатление, что металл изотропен, т.к. каждое из зерен ориентировано по-своему – это явление получило название квазианизотропией (ложной). Поэтому, если испытывать металл по различным направлениям, то свойства его будут одинаковы. Деформирование металлов приводит к ориентации зерен, а также кристаллографических плоскостей в направлении деформации. Закономерная ориентация кристаллографических плоскостей в направлении действующих нагрузок называется текстурой. Анизотропия металлов Анизотропия — неоднородность физических, механических и других свойств кристаллов в различных направлениях. При обработке давлением, особенно при штамповке изделий из меди и других металлов и сплавов, анизотропия вызывает так называемый брак по «фестонистости». В поликристаллических телах с бессистемной ориентировкой кристаллитов явление анизотропии не должно иметь места. На практике, однако, это явление наблюдается на отожженном материале и обусловливается главным образом технологическими факторами. В меди анизотропия свойств резко выражена в том случае, если холодная прокатка в последнем пропуске связана с сильной деформацией, а отжиг- перед последним пропуском производится при пониженных температурах. Последний отжиг наготово-(при любых температурах) не устраняет анизотропии, так как в этом случае вместо текстуры деформации появляется текстура рекристаллизации. Анизотропию свойств поликристаллической меди можно ослабить до минимума, применяя рациональную технологию. Однако такая оптимальная технология не может быть одинаковой для всех сортов меди, так как на анизотропию свойств прокатанной меди значительное влияние оказывают также примеси, присутствующие в металле. В частности, примесь сурьмы, по данным Д. И. Лайнера, в значительной мере уменьшает явление фестонистости в меди. Например, в кубических решетках по направлениям вдоль ребер насчитывается меньше атомов, чем вдоль диагоналей куба в ОЦК-решетке или диагоналей граней в ГЦК-решетке. На плоскостях, проходящих через грани ОЦК- и ГЦК-решеток, находится меньше атомов, чем на диагональных плоскостях. Поскольку механические, физические и химические свойства вдоль различных направлений зависят от плотности находящихся на них атомов, то перечисленные свойства вдоль различных направлений в кристаллических телах должны быть неодинаковыми. Анизотропия проявляется только в пределах одного монокристалла или зерна-кристаллита. В поликристаллических телах она не наблюдается из-за усреднения свойств по каждому направлению для огромного количества произвольно ориентированных друг относительно друга зерен. Поэтому реальные металлы являются квазиизотропными телами, т. е. псевдоизотропными. Строение реальных металлов Реальное строение металлов значительно отличается от идеального. При идеальном строении кристаллов (металлов) все атомы теоретически должны находиться строго в узлах кристаллической решетки. Теоретическая прочность такого металла чрезвычайно высока. Так, теоретическая прочность при сдвиге (под действием касательных напряжений) тсдв = G/ (2ri), где G — модуль сдвига (модуль Юнга). В соответствии с этой формулой теоретический предел прочности железа должен составлять примерно 13000 МПа, при такой прочности проволока диаметром 1 мм выдержала бы груз массой более тонны (для железа G = 80 ГПа). В действительности же, прочность железа примерно в 100 раз меньше — 150 МГТа. Такое несоответствие объясняется различием идеального и реального строения металлов. Во-первых, технические металлы состоят из большого количества кристаллов (зерен), т.е. являются поликристаллическими веществами. При этом кристаллы (зерна) в реальном металле не имеют правильной формы и идеально упорядоченного расположения атомов. Во-вторых, даже в самих поликристаллах имеются различного рода несовершенства (дефекты). Различают точечные, линейные и поверхностные несовершенства кристаллического строения. Точечные дефекты малы во всех трех измерениях. К ним относят вакансии и междоузелъные (дислоцированные) атомы (рис. 2.5). Образование точечных дефектов связано с диффузионным перемещением атомов под действием тепловых колебаний. С повышением температуры металла число вакансий растет. Точечные дефекты оказывают влияние на некоторые физические свойства металлов (электропроводность, магнитные свойства и т.д.) и фазовые превращения в металлах и сплавах. Линейные дефекты имеют малые размеры в двух измерениях и большую протяженность в третьем измерении. Эти несовершенства называются дислокациями. Дислокации образуются в процессе кристаллизации и главным образом при деформации металла. Кристаллизация металлов Переход металла из жидкого состояния в твердое называется первичной кристаллизацией. Она протекает вследствие перехода системы из неустойчивого термодинамического состояния в устойчивое, т.е. из состояния с большей энергией в состояние с меньшей энергией. Проиллюстрируем этот процесс с помощью схемы, изображенной на рис. 2.10. Шарик из положения 1 стремится занять более устойчивое положение 2, так как его потенциальная энергия в положении 2 меньше, чем в положении 1.
При очень медленном охлаждении степень переохлаждения мала и кристаллизация происходит при температуре, близкой к равновесной. С увеличением скорости охлаждения степень переохлаждения возрастает (кривые, соответствующие скоростям охлаждения v2 и i3), и процесс кристаллизации протекает при температурах значительно более низких, чем равновесная температура кристаллизации. Строение слитка Кристаллы, образующиеся в процессе затвердевания металла, могут иметь различную форму в зависимости от скорости охлаждения и количества примесей. В направлении отвода теплоты кристалл растет быстрее, чем в других направлениях, в результате образуется древовидный кристалл — дендрит (рис. 2.15). Схематическое изображение дендрита впервые было сделано Д.К.Черновым. Дендритное строение кристаллов является типичным для литого металла. Кристаллизация жидкого металла начинается у стенок изложницы. При этом весьма интенсивное охлаждение приводит к образованию огромного числа центров кристаллизации. Из-за большой скорости охлаждения образовавшиеся кристаллы не успевают вырасти, поэтому первая зона слитка имеет мелкозернистое строение (рис. 2.16). После образования первой зоны условия кристаллизации изменяются. Снижение температур охлаждаемого металла и повышение температуры стенок изложницы приводят к уменьшению скорости охлаждения. Для этой стадии кристаллизации характерен направленный отвод теплоты перпендикулярно стенкам изложницы. Кристаллы, образующиеся в этот момент, растут перпендикулярно стенкам изложницы внутрь жидкого металла. Это приводит к образованию второй зоны слитка — зоны столбчатых кристаллов.
Жидкий металл имеет больший удельный объем, чем твердый, поэтому в верхней части слитка, которая застывает в последнюю очередь, образуется полость — усадочная раковина, обычно окруженная наиболее загрязненной частью металла. Верхнюю часть слитка отрезают и переплавляют, а остальной металл подвергают обработке давлением. Правило отрезков. Правило отрезков устанавливает количественное соотношение фаз в период кристаллизации. Так, например, при температуре t1 (см. рис. 15) количество жидкой и твердой фазы в сплаве определится соотношением:
Таким образом, количество жидкой фазы Жс пропорционально отрезку аб, прилегающему к линии солидус, а количество твердой фазы αа – отрезку бс, прилегающему к линии ликвидус. По мере развития процесса кристаллизации отрезок аб, определяющий количество жидкой фазы, уменьшается, а отрезок бс, наоборот, растет. Углеродистые стали. В основу классификации положено содержание в стали серы и фосфора, т. е. вредных примесей. Качество стали тем выше, чем меньше в ней серы и фосфора. По качеству можно выделить следующие основные группы сталей: • стали обыкновенного качества, содержащие до 0,06% серы и 0,07% фосфора; • качественные стали, содержащие до 0,04% серы и 0,035% фосфора; • высококачественные стали, содержащие до 0,025% серы и 0,025% фосфора, выплавляемые в электропечах. Сера в таких количествах растворяется в железе, поэтому сульфиды не образуются, следовательно, высококачественные стали не подвержены красноломкости; • особовысококачественные стали получают путем применения специальных металлургических технологий: электрошлакового переплава (ЭШП) — переплав стали под слоем специального шлака позволяет снизить содержание серы до 0,002… 0,008%; вакуум нодуговой переплав (ВДП) почти полностью выводит из стали газы.
Стали обыкновенного качества обозначают буквами Ст и цифрой, указывающей порядковый номер стали: СтО, Ст1, Ст2, СтЗ, Ст4, Ст5, Стб. С увеличением номера повышаются содержание углерода и прочностные свойства, но снижается пластичность. Так, в зависимости от марки (номера) содержание углерода в сталях увеличивается от 0,06 до 0,43%, возрастают предел прочности ав от 300 до 600 МПа и предел текучести а0,2 от 150 до 300 МПа, а относительное удлинение 8 снижается от 32 до 14%. Стали обыкновенного качества используют в основном как строительн ы е. Их не подвергают термической обработке. Качественные углеродистые стали являются машиностроительными, их применяют для изготовления деталей машин (конструкционные стали) или инструментов(инструментальные стали). Для обеспечения требуемых свойств они подвергаются термической обработке и поэтому поставляются с гарантированным химическим составом, который указывается в обозначении марки. Конструкционные стали обозначаются цифрами, указывающими среднее содержание углерода в сотых долях процента. В машиностроении используются следующие марки сталей: 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70. Для каждой марки стали установлены пределы содержания углерода; например, сталь 20 содержит 0,18…0,22%, сталь 25 — 0,23…0,27%, сталь 40 — 0,37…0,42% и т.п. Цифры, обозначающие марку стали, получаются округлением концентрации углерода до ближайшего числа, кратного пяти. Инструментальные углеродистые стали содержат от 0,7 до 1,3% С. Они обозначаются буквой У и цифрами, показывающими среднее содержание углерода в десятых долях процента. Так, содержание углерода в стали У7 — 0,7%, в стали У12 — 1,2%. Для инструментов применяются следующие стали: У7, У8, У9, У10, У11, У12 и У13. Высококачественные стали (инструментальные углеродистые и легированные и конструкционные легированные) обозначают буквой А в конце марки сталей. Например, У8А, У10А, У12А. Нагартованная сталь. Наклёп — упрочнение поверхности металлов и сплавов вследствие изменения их структуры и фазового состава в процессе пластической деформации, при температуре ниже температуры рекристаллизации. Наклёп сопровождается выходом на поверхность образца дефектов кристаллической решётки, увеличением прочности и твёрдости и снижением пластичности, ударной вязкости, сопротивления металлов деформации противоположного знака (эффект Баушингера). Различают два вида наклёпа: фазовый и деформационный. Деформационный наклёп является результатом действия внешних деформационных сил. При фазовом наклёпе источником деформаций служат фазовые превращения, в результате которых образуются новые фазы с отличным от исходной (-ых) удельными объёмами. Деформационный наклёп: - Дробеструйный наклёп — упрочнение, которое достигается за счёт кинетической энергии потока круглой чугунной или стальной дроби, а также других круглых дробей, например керамической, направляемым скоростным потоком воздуха, или роторным дробомётом. - Центробежно-шариковый наклёп (нагартовка) — создаётся за счёт кинетической энергии шариков (роликов), расположенных на периферии обода, взаимодействуют с обрабатываемой поверхностью и отбрасываются вглубь гнезда. Перенаклёп. При значительных деформациях вследствие перенаклепа в материале возникают поры, субмикротрещины и другие дефекты. Такое состояние металла (сплава) называется перенаклёпом. Перенаклёп — одна из причин хрупкости, а также снижения конструкционной прочности сплавов. Разупрочнение. При нагреве, например во время отжига, подвергнутого наклёпу металла, происходит его разупрочнение, вследствие развития процессов отдыха, полигонизации, рекристаллизации. Упрочнение деталей наклёпом. В машиностроении наклёп используется для поверхностного упрочнения деталей. Наклёп приводит к возникновению в поверхностном слое детали благоприятной системы остаточных напряжений, влияние которых главным образом и определяет высокий упрочняющий эффект поверхностной пластической деформации (ППД), выражающийся в повышении усталостной прочности, а иногда и износостойкости. Для получения упрочненного наклёпом поверхностного слоя заготовку подвергают обработке различными видами ППД, например, обкатка роликами, дробеструйная обработка, поверхностное дорнование и др. Распад аустенита. Основное превращение, протекающее во время охлаждения при отжиге эвтектоидной стали, — это распад аустенита при комнатной температуре ниже точки А1 (727 оС) на смесь феррита с цементитом. При скорости охлаждения стали, обеспечивающей полное протекание диффузионных процессов и соответственно близкое к равновесному состоянию стали, в структуре последней согласно диаграмме «железо—углерод» образуется перлит. В зависимости от степени переохлаждения аустенита различают три температурные области превращения: перлитную (переохлаждение до 500 °С), мартенситную (переохлаждение ниже Мн — для эвтектоидной стали ниже температуры 240 °С) и промежуточного (бейнитного) превращения (переохлаждение для эвтектоидной стали в интервале от 500 до 240 °С). Рассмотрим структуры, образующиеся при диффузионном превращении аустенита. При температуре 650–700 °С образуется собственно перлит. При перлитном превращении ведущей фазой является цементит. В результате образования пластинок цементита соседние участки аустенита обедняются углеродом, что в свою очередь приводит к образованию пластинок феррита. При увеличения переохлаждения увеличивается количество зародышей новой фазы. Естественно, что с ростом числа чередующихся пластин феррита и цементита уменьшаются их размеры и расстояния между ними (рис. 8.6). Другими словами, с понижением температуры растет дисперсность продуктов превращения аустенита. Под степенью дисперсности понимают расстояние между соседними пластинками феррита и цементита. Схема феррито-цементитных структур: а) перлит; б) сорбит; в) троостит Перлит, сорбит, троостит являются структурами одной природы — механической смесью феррита и цементита и отличаются друг от друга лишь степенью дисперсности. С увеличением степени дисперсности пластин цементита растут твердость и прочность стали. Наибольшую пластичность имеют стали с сорбитной структурой. Троостит, образующийся при более низкой температуре превращения, характеризуется меньшей пластичностью (меньшими d и y). Перлит, сорбит и троостит называют перлитными структурами. Перлитные структуры в зависимости от формы цементита могут быть пластинчатыми или зернистыми. Пластинчатые структуры образуются при превращении однородного (гомогенного) аустенита, а зернистые — неоднородного аустенита. В первом случае нагрев доэвтектоидных сталей должен производиться выше АС3, а заэвтектоидных — выше Аcm. Соответственно для получения зернистых структур нагрев должен производиться ниже АС3 (Аcm). Таким образом, дисперсность перлитных структур определяется степенью переохлаждения, а форма цементита — гомогенностью исходного аустенита. Так как в доэвтектондных и заэвтектоидных сталях, в отличие от эвтектоидных, в интервале температур А1–А3 сначала выделяются избыточные фазы — феррит (в доэвтектоидных сталях) или избыточный цементит (в заэвтектоидных сталях), то на диаграмме изотермического распада аустенита для этих сталей характерно появление дополнительной кривой, характеризующей начало выделения соответствующих избыточных фаз. Мартенситное превращение. При больших степенях переохлаждения возрастает термодинамическая неустойчивость аустенита, а скорость диффузии углерода резко падает. При переохлаждении аустенита в эвтектоидной стали до 240 °С подвижность атомов углерода близка к нулю и происходит бездиффузионное превращение аустенита. При этом меняется лишь тип решетки g ® a, а весь углерод, ранее растворенный в решетке аустенита, остается в решетке феррита несмотря на то, что равновесная концентрация углерода в феррите не превышает 0,006 % при комнатной температуре. В результате образуется пересыщенный твердый раствор внедрения углерода в a -железе, который называется мартенситом. Из-за пересыщенности углеродом решетка мартенсита сильно искажена и вместо кубической приобретает тетрагональную форму, в которой отношение периодов решетки существенно отличается от единицы, т. е. с/а ¹ 1. Чем больше углерода, тем выше степень тетрагональности мартенсита. Мартенсит имеет высокую хрупкость и твердость (до 65 НRCЭ). Высокая твердость мартенсита обусловлена искажениями кристаллической решетки и соответственно большими внутренними напряжениями, определяемыми растворенным углеродом, а также возникновением фазового наклепа вследствие увеличения объема при превращении аустенита в мартенсит, в результате чего плотность дислокации в мартенсите достигает уровня плотности дислокации холоднодеформируемой стали и равняется 1010–1012 см–2. Скорость образования кристаллов мартенсита очень велика и достигает 1000 м/с. Пластины мартенсита растут до границы аустенитного зерна либо до имеющегося в стали дефекта. Последующие пластины мартенсита, расположенные под углом к первым (60°, 120°), ограничены их размерами. Высокая скорость образования кристаллов мартенсита при низкой температуре протекания превращения объясняется тем, что имеет место непрерывный переход от кристаллической решетки аустенита к решетке мартенсита. При практически мгновенном (скорость в 3 раза больше скорости звука) g ® a переходе атомы смещаются упорядоченно, строго ориентированно на расстояния, меньшие межатомных. При этом сохраняется общая сопрягающаяся плоскость решеток g - и a -Fe — так называемая когерентная связь. Когерентное превращение обусловливает перемещение атомов только на близкие расстояния при переходе атомов из одной решетки в другую. Поэтому кристаллическая решетка новой фазы мартенсита закономерно ориентирована относительно исходной фазы — аустенита. Из-за когерентного сопряжения решеток и различия удельных объемов фаз (аустенита и мартенсита) мартенситное превращение приводит к возникновению больших внутренних напряжений. Мартенситное превращение идет в интервале температур начала и конца мартенситного превращения Мн и Мк. Для эвтектоидной стали оно начинается при 240 и заканчивается при –50 °С. Однако при этой температуре в стали сохраняется еще некоторое количество непревращенного, так называемого «остаточного аустенита». Охлаждение ниже температуры Мк не приводит к его окончательному распаду. Положение точек Мн и Mк не зависит от скорости охлаждения, но зависит от содержания углерода в стали (рис. 8.9). Все легирующие элементы, растворенные в аустените, за исключением кобальта и алюминия, понижают точки Мн и Мк. Мартенситное превращение очень чувствительно к напряжению, а деформация аустенита может вызвать превращения даже при температурах выше Мн (образуется мартенсит деформации). Кристаллы в зависимости от состава сплава, а следовательно в зависимости от температуры своего образования, могут иметь различную морфологию и субструктуру. Различают два вида мартенсита: пластинчатый (игольчатый) и пакетный (реечный). Пластинчатый мартенсит образуется в высокоуглеродистых сталях, имеющих низкие значения Мн и Мк. В этом случае кристаллы мартенсита в средней зоне содержат большое число микродвойников, образующих зону повышенной травимости, называемой мидрибом. Сами кристаллы мартенсита в этом случае представляют собой широкие пластины, которые в плоскости шлифа имеют вид игл. Пакетный (реечный) мартенсит характерен для низко- и среднеуглеродистых, а также конструкционных легированных сталей. В этом случае кристаллы мартенсита имеют форму тонких реек, вытянутых в одном направлении (рис. 8.10, б) и объединенных в пакеты. Тонкая структура пакетного (реечного) мартенсита представляет собой запутанные дислокации высокой плотности (» 1010–1012см2) при полном отсутствии двойников. В легированных сталях внутри мартенситных пакетов между кристаллами мартенсита, как правило, присутствуют прослойки остаточного аустенита. Размеры кристаллов любой морфология мартенсита определяются величиной исходного зерна аустенита. Они тем крупнее, чем больше зерно аустенита. Первая пластина мартенсита имеет протяженность, соответствующую поперечному размеру зерна аустенита. Кристаллы, образующиеся при более низких температурах, имеют уже меньшую протяженность. Если эвтектоидную сталь охладить только до комнатной температуры, то в структуре кроме мартенсита будет присутствовать некоторое количество остаточного аустенита. Наличие остаточного аустенита нежелательно, так как это приводит к неоднородности свойств по сечению и изменению размеров деталей. Последнее обстоятельство объясняется тем, что мартенсит имеет наибольший удельный объем по сравнению с другими структурами, а аустенит — наименьший. Поэтому при переходе от аустенитной структуры к мартенситной объем и размеры деталей увеличиваются. К особенностям мартенситного превращения относится то, что оно происходит только при непрерывном охлаждении. Задержка охлаждения при температуре выше температуры конца мартенситного превращения приводит к стабилизации аустенита. Аустенит становится более устойчивым. При последующем охлаждении его превращение затруднено и протекает с меньшей интенсивностью и полнотой. Эффект стабилизации аустенита зависит от температуры остановки при охлаждении. Таким образом, особенностями мартенситного превращения являются его бездиффузионный характер, ориентированность кристаллов и образование при непрерывном охлаждении в интервале температур Мн–Мк. Характерной чертой мартенсита является его высокая твердость и прочность, значения которых возрастают с увеличением содержания углерода в мартенсите. Временное сопротивление низкоуглеродистого мартенсита (0,025 % С) составляет 1000 МПа, а мартенсит с содержанием 0,6–0,7 % С имеет временное сопротивление 2 600–2 700 МПа. Однако с повышением в мартенсите содержания углерода возрастает и его склонность к хрупкому разрушению. Мартенсит, содержащий более 0,35–0,4 % С, имеет низкое сопротивление зарождению и распространению трещины, а также низкие значения вязкости разрушения KIс. Увеличение удельного объема при образовании мартенсита является одной из основных причин возникновения при закалке больших внутренних напряжений, вызывающих деформацию и коробление изделий, а также появление закалочных трещин. Типы межатомных связей в твердых телах. Строение и свойства кристаллических тел с различными межатомными связями. Ионная связь – присуща химическим соединениям, образованным элементами с резко различающейся валентностью. Так металлы, имея 1 или 2 электрона на внешней орбите, которые не прочно связаны с ядром, вступая в реакцию с неметаллами, металлы отдают электроны и превращаются в ионы. Неметаллы принимают эти электроны, превращаясь в отрицательные ионы => ионная связь обеспечивает электро – статическое притяжение.
|
||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 1014; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.134.165 (0.016 с.) |


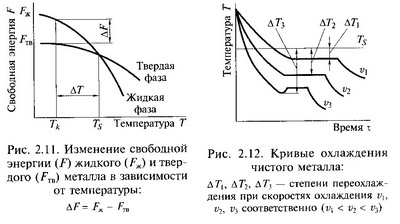 Одной из характеристик энергетического состояния системы является свободная энергия. Свободной энергией называется часть полной энергии вещества, которая обратимо изменяется при изменении температуры, полиморфных превращениях, плавлении и т.д. С повышением температуры величина свободной энергии уменьшается. Изменение свободной энергии жидкого и твердого вещества показано на рис. 2.11. При равновесной температуре Ts величины свободных энергий металла в жидком и твердом состояниях равны.
Одной из характеристик энергетического состояния системы является свободная энергия. Свободной энергией называется часть полной энергии вещества, которая обратимо изменяется при изменении температуры, полиморфных превращениях, плавлении и т.д. С повышением температуры величина свободной энергии уменьшается. Изменение свободной энергии жидкого и твердого вещества показано на рис. 2.11. При равновесной температуре Ts величины свободных энергий металла в жидком и твердом состояниях равны. На рис. 2.12 показаны кривые охлаждения, характеризующие кристаллизацию чистых металлов при охлаждении с разной скоростью. Кристаллизация происходит при постоянной температуре, поэтому на кривой охлаждения появляется горизонтальная площадка (остановка в падении температуры), образование которой объясняется выделением скрытой теплоты кристаллизации. Во время плавления происходит поглощение теплоты, которая расходуется на повышение энергии атомов, т.е. на разрушение кристаллической решетки металла. Эта теплота называется скрытой. В процессе кристаллизации происходит обратное явление, а именно выделение энергии в виде скрытой теплоты кристаллизации, которая задерживает падение температуры.
На рис. 2.12 показаны кривые охлаждения, характеризующие кристаллизацию чистых металлов при охлаждении с разной скоростью. Кристаллизация происходит при постоянной температуре, поэтому на кривой охлаждения появляется горизонтальная площадка (остановка в падении температуры), образование которой объясняется выделением скрытой теплоты кристаллизации. Во время плавления происходит поглощение теплоты, которая расходуется на повышение энергии атомов, т.е. на разрушение кристаллической решетки металла. Эта теплота называется скрытой. В процессе кристаллизации происходит обратное явление, а именно выделение энергии в виде скрытой теплоты кристаллизации, которая задерживает падение температуры. В процессе дальнейшей кристаллизации направленность отвода теплоты теряется, скорость охлаждения значительно уменьшается, поэтому в центральной части слитка образуются крупные равноосные кристаллы. По мере кристаллизации металла примеси оттесняются в жидкую часть. Это предопределяет неравномерное распределение элементов как в микрообъеме, так и в различных зонах слитка. Неравномерное распределение химических элементов в объеме металла называется ликвацией.
В процессе дальнейшей кристаллизации направленность отвода теплоты теряется, скорость охлаждения значительно уменьшается, поэтому в центральной части слитка образуются крупные равноосные кристаллы. По мере кристаллизации металла примеси оттесняются в жидкую часть. Это предопределяет неравномерное распределение элементов как в микрообъеме, так и в различных зонах слитка. Неравномерное распределение химических элементов в объеме металла называется ликвацией. гдеЖс + αа – общее количество сплава.
гдеЖс + αа – общее количество сплава. Маркировка углеродистых сталей. Углеродистые стали выпускают обыкновенного качества, качественные и высококачественные. Легированные стали — качественные, высококачественные и особовысококачественные.
Маркировка углеродистых сталей. Углеродистые стали выпускают обыкновенного качества, качественные и высококачественные. Легированные стали — качественные, высококачественные и особовысококачественные.


