Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
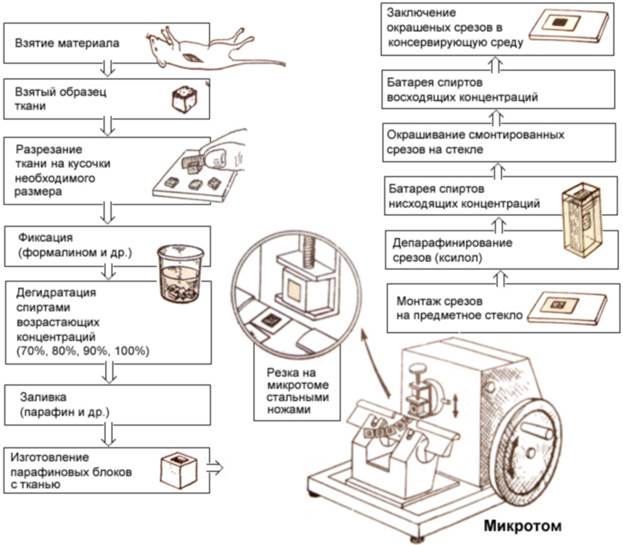
III. Промывка в воде – для водорастворимых фиксаторов и в спирте – для спирторастворимых фиксаторов.Содержание книги
Поиск на нашем сайте
Цель: освобождение от фиксатора. IV. Обезвоживание и уплотнение - проводят по батарее спиртов возрастающей концентрации (крепости). Основное правило: правило постепенного воздействия применяемых веществ на исследуемые ткани. Если применяли водорастворимый фиксатор, тогда батарея спиртов следующая: 300→400→500→600→700→800→900→960 I→960 II→1000 абсолютный спирт Если применяли спирторастворимый фиксатор, батарея спиртов начинается с 700 спирта: 700→800→900→960I→960 II→1000 абсолютный спирт V. Заливка – пропитывание веществами представляющими собой плотные среды. Заливку производят в парафин и в целлоидин. А) Парафиновая заливка Парафин не растворяется в спирте, зато растворяется в органических растворителях (бензол, ксилол, толуол, хлороформ). Прежде чем материал залить в парафин, его нужно провести через ряд промежуточных сред: спирт + ксилол → ксилол I → ксилол II → ксилол + парафин (t = 370) → парафин I (t = 560) → парафин II(t = 560) → заливочный парафин (содержит 5% воска) Положительные стороны парафиновой заливки: 1) Можно делать тонкие срезы ≈ 5 мкм 2) Относительная быстрота проводки: время нахождения в различных средах зависит от структуры органа и размера кусочка и подбирается опытным путем. Отрицательные стороны парафиновой заливки: 1) Воздействие на объект высоких температур, что часто приводит к высушиванию и деформации материала. 2) Возможность заливать только мелкие объекты Б) Целлоидиновая заливка Целлоидин – это нитроклетчатка, для этой цели используют рентгеновские пленки, которые растворяются в смеси спирт + эфир. Получается жидкий целлоидин. Проводку осуществляют в последовательности: Спирт + эфир → 2% целлоидин → 4% целлоидин → 6% целлоидин → 8-10% целлоидин. Далее помещают заливаемый объект в чашку Петри с 10% целлоидином и приоткрывают крышку, чтобы среда получилась эластичной. Затем вырезают объект вместе со средой и приклеивают с помощью густого целлоидина к деревянному блоку. Такой гистологический блок хранят в банке с 70-градусным спиртом, чтобы предотвратить от высыхания. Парафиновые блоки можно хранить при комнатной температуре. Положительные стороны парафиновой заливки: 1) можно заливать более крупные объекты Отрицательные стороны парафиновой заливки: 1) невозможность получить тонкие срезы, толщина срезов =20 мкм VI. Резка Резку осуществляют на приборе под названием микротом. Основной элемент микротома – стальной нож. Микротом может находиться внутри прибора, который поддерживает постоянную t ≈ - 18-200. Он носит название криостат. Этот прибор широко используется для экспресс–диагностики во время хирургических операций, для научных исследований, для гистохимических методов исследования, так как этапы фиксации и уплотнения осуществляются одновременно благодаря замораживанию при низких температурах и существенно экономят время исследования. После резки парафиновый срез помещают в каплю воды на предметное стекло и слегка подогревают на термостолике, чтобы срез расправился. Далее оставляют стекло до полного высыхания воды. VII. Депарафинизация. Прежде чем окрашивать гистологический срез, необходимо освободиться от парафина и наводнить препарат, так как обычные гистологические красители водные. Препарат на предметном стекле погружают в следующие растворы: ксилол I → ксилол II → 960 I → 960 II → 700 → Н2О VIII. Окрашивание Препарат окрашивают сначала ядерным красителем, затем цитоплазматическим. Виды красителей: А) ядерные (основные) · гематоксилин (окрашивает ядро в синий цвет) · железный гематоксилин · азур II (в фиолетовый цвет) · кармин (в красный цвет) · сафранин (в красный цвет) · метиловый синий (в синий цвет) · толуидиновый синий (в синий цвет) · тиониновый синий (в синий цвет) Б) цитоплазматические (кислые) · эозин – окрашивает цитоплазму в розовый цвет · эритрозин · оранжевый «G» · кислый фуксин – в красный · пикриновая кислота – в желтый · конго красный- в красный В) специальные · судан III – окраска липидов и жиров в оранжевый цвет · осмиевая кислота – окраска липидов и жиров в черный цвет · орсеин – окраска эластических волокон в коричневый цвет · азотнокислое серебро – импрегнация нервных элементов в темно-коричневый цвет Структуры клетки, окрашиваемые кислыми красителями называются оксифильными (ацидофильными ) – окрашивание в розовый цвет. Структуры клетки, окрашиваемые основными красителями называются базофильными – окрашивание в синий цвет. Структуры клетки, окрашиваемые как основными, так и кислыми красителями одновременно называются нейтрофильными – окрашивание в фиолетовый цвет. IX. Просветление осуществляют в следующих растворах: Н2О → 700 → 960 I→ 960 II→ ксилолI → ксилол I X. Заключение в бальзам. Используют канадский бальзам, так как его коэффициент преломления равен коэффициенту преломления стекла. После нанесения бальзама срез покрывают покровным стеклом. После высушивания гистологический препарат готов для проведения гистологического анализа.
Микроскоп
Рисунок 1. Приготовление гистологических препаратов для световой микроскопии.
ТЕХНИКА РАБОТЫ С МИКРОСКОПОМ Основным прибором, который используют студенты на занятиях, является световой микроскоп. Он позволяет получить увеличенное и обратное изображение объекта. I. Устройство микроскопа. В микроскопе различают оптическую, осветительную и механическую части. Оптическая часть. Эта часть включает в себя объективы, устанавливаемые в гнезда револьверного устройства тубуса; окуляр, расположенный в тубусе. Объектив — сложная система линз. Чаще используют объективы Х8, Х20. Х40, Х90. По особенностям использования и конструкции объективы подразделяют на сухие (Х8, Х20, Х40) и иммерсионные (Х90). Окуляр увеличивает изображение, данное объективом. Чаще всего применяют окуляры Х5, X 7, Х10, Х15. Основной технической характеристикой объектива является разрешающая способность, т. е. наименьшее расстояние, на котором две близлежащие точки объекта воспринимаются раздельно. В световом микроскопе это расстояние определяется в основном длиной световой волны и соответствует ее второй части. Осветительная часть включает в себя зеркало (с одной стороны вогнутое, которое используют при расходящемся источнике света (лампочка накаливания), с другой — плоское); конденсора, с помощью которого пучок света фокусируется на препарате; ирисовую диафрагму, вмонтированную в конденсор для изменения степени освещенности препарата. С помощью зеркала пучок света посылается в конденсор и через него на препарат (при изучении препарата в проходящем свете). Механическая часть. К ним относят штатив, колонку с микро- и макровинтами, тубус. Увеличение, получаемое в микроскопе, определяют произведением увеличения объектива на увеличение окуляра. Наиболее распространенные в нашей стране микроскопы типа "МБИ" и "Биолам" дают увеличение до 2000 раз.
|
||||
|
Последнее изменение этой страницы: 2016-04-20; просмотров: 504; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.51.72 (0.007 с.) |